LIM结构域蛋白FHL1C与GNB2不存在相互作用
2015-12-25赵俊龙王媛媛秦鸿雁张丙芳第四军医大学西京医院老年病科西安7003第四军医大学医学遗传学与发育生物学教研室肿瘤生物学国家重点实验室通讯作者mailfanpenfmmueducn
刘 娟,赵俊龙,王媛媛,韩 骅,秦鸿雁,张丙芳(第四军医大学西京医院老年病科,西安 7003;第四军医大学医学遗传学与发育生物学教研室肿瘤生物学国家重点实验室;通讯作者,E-mail:fanpen@fmmu.edu.cn)
LIM结构域是一类富含半胱氨酸的蛋白基序,可介导蛋白与蛋白间相互作用,并在基因表达调控、信号转导和细胞骨架形成中发挥作用[1-4]。这种特点使其在细胞组织结构的维持、信号通路的传递等过程中发挥重要作用。隶属于LIM蛋白FHL1分子亚家族的KyoT2分子(人FHL1C在小鼠中的同源物),由日本学者Taniguchi等[5]首先发现,并在哺乳动物细胞体系中验证了LIM结构域蛋白KyoT2可以与调控发育的 Notch信号途径关键转录因子RBP-Jk相互作用形成复合物,进而竞争性抑制RBP-Jk介导的Notch信号下游基因的转录,抑制Notch信号的活化。同时,我们课题组的前期研究发现,KyoT2蛋白N端的LIM结构域作为介导蛋白相互作用的重要结构,可通过募集PcG蛋白家族(polycomb group protein,PcG)RING1和HPC2共同参与转录调控[6,7]。KyoT2的人源同源蛋白 FHL1C同样已被发现可以通过特异性地阻断Notch信号,进而促进急性T细胞淋巴瘤细胞的凋亡,发挥可能的治疗效果[8]。然而,FHL1C/KyoT2分子都不含有核定位信号,因此该蛋白的入核很有可能通过不同方式的修饰,或者与其他核蛋白的相互作用实现。此外,FHL1C/KyoT2的生理功能尚未明确,KyoT2基因敲除小鼠并未发现发育异常。因此对于FHL1C相互作用分子的研究,将有助于进一步理解其特异性抑制Notch信号的分子机制。本实验室前期的蛋白质谱数据显示,FHL1C作为介导蛋白相互作用的分子,可与多种蛋白结合形成复合物,如GNB2等[9]。本研究旨在验证由此发现的鸟嘌呤核苷酸结合蛋白β亚基中的GNB2蛋白与FHL1C蛋白之间的相互作用,为进一步研究FHL1C/KyoT2抑制Notch信号途径的生物功能提供重要理论依据。
1 材料和方法
1.1 质粒、细胞株及主要试剂
真核表达载体 pCMX-VP16、pCMV-Flag、pCMVGAL4-DBD-FHL1C、pCMV-myc-FHL1C及含报告基因的质粒 TK MH100×4Luc、pRL-TK均为本室保存。HeLa细胞及其cDNA为本室保存。细菌培养用酵母提取物和蛋白胨、琼脂粉购自Oxoid公司;感受态XL-10由本室保存;细胞培养用DMEM购自GIBCO公司;胎牛血清、Lysis Buffer购自杭州四季青生物工华舜生物工程有限公司;抗myc标签抗体购自CHEMICON,辣根过氧化物酶(HRP)标记的羊抗鼠、羊抗兔IgG均购自博士德公司。限制性内切酶、DNA Ligation Kit、质粒抽提以及胶回收试剂盒均购自TaKaRa生物制品公司,LARⅡ和SG buffer双报告基因试剂、Lipofectamine2000购自Invitrogen公司;rTaq mix购自 Promega公司。DNA Marker DL2000购于华美公司,PVDF膜购于Amersham公司;测序及引物合成由北京奥科鼎盛生物科技有限公司完成。
1.2 真核表达载体pCMV-VP16-GNB2的构建
以HeLa细胞系cDNA为模板,上游引物:5'-GCGAATCATGAGTGAGCTGGAGCAACTGAGA-3';下游引物:5'-GGGTCGACTTAGTTCCAGATCTTGAGGAAGGAG-3';按以下条件扩增GNB2基因的开放读框序列片段:cDNA 1 μl,rTaq mix 10 μl,上游引物(10 nm)0.5 μl,下游引物(10 nm)0.5 μl,最后用去离子水补足20 μl。PCR反应条件:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃1 min共35个循环;72℃延伸 5 min。取5 μl进行2%凝胶电泳。将纯化回收的目的片段与pCMX-VP16载体分别进行EcoRⅠ和SalⅠ双酶切反应后,进行连接,构建pCMV-VP16-GNB2真核表达质粒。将连接产物转化感受态大肠杆菌XL-10,37℃孵育12h后挑取单克隆菌落培养,并按照TaKaRa质粒小提说明书进行质粒提取操作。所有质粒经过EcoRⅠ和SalⅠ酶切及DNA测序鉴定。
1.3 真核表达载体pCMV-FLAG-GNB2的构建
以已经构建成功的质粒pCMV-VP16-GNB2为模板,上游引物:5'-GCGAATTCCATGAGTGAGCTGGAGCAACTGAGA-3',下游引物:5'-GGGTCGACTTAGTTCCAGATCTTGAGGAAGGAG-3';按同上条件扩增GNB2基因的开放读框序列片段并连接入pCMV-Flag载体,构建融合Flag标签的真核表达质粒pCMV-Flag-GNB2,所有质粒经过EcoRⅠ和SalⅠ酶切及DNA测序鉴定。
1.4 哺乳动物双杂交
转染前12-16 h将HeLa细胞按5×104/ml均匀接种于在24孔板中,置于37℃恒温孵箱中培养过夜。待细胞融合至80%-90%时,吸去上清替换为无血清培养液,按照 Lipofectamine2000∶DNA=2.5 μl∶1 μg 比例将 pCMX-GAL4-DBD-FHL1C 质粒和不同剂量的pCMV-VP16-GNB2质粒及报告基因质粒TK和MH100×4Luc共转染入HeLa细胞内(组合策略见结果),同时把 pCMX-GAL4-DBDFHL1C及 pCMV-VP16-RBP-J共转染作为阳性对照。4-6 h后将无血清培养液换为完全培养液,培养48 h后收集细胞,加入裂解液冰上裂解20 min,吸出上清液4 μl,先加入 10 μl LARⅡ,上机检测内参海肾基因荧光信号;再加入10 μl SG Buffer,上机检测荧光素酶荧光信号;将两次所得荧光信号比值进行统计分析,每组实验设置三个副孔并重复实验三次。
1.5 免疫共沉淀
按同上转染方法,将结果中描述的不同组合质粒用脂质体法瞬时共转染接种好的HeLa细胞。转染后60 h,用预冷的PBS将细胞洗一遍,收集细胞加入1 ml含1%PMSF的IP专用RIPA裂解液,4℃孵育30 min后置于冰上待用。4℃充分混匀磁珠,分别吸取30 μl于新管中,置于磁体架上使磁珠和溶液分离,将上清吸出,并用PBS冲洗一遍磁珠。用PBST将Myc抗体稀释100倍,每份样本加入200 μl PBST抗体稀释液重悬并充分混匀,以20 r/min转速4℃低温旋转2 h。将EP管放置于磁体上吸出上清,加入已制备好于冰上保存的蛋白样品,4℃旋转孵育过夜,同时每管留取少量样品作为Input对照组。次日用PBS冲洗磁珠-抗体-抗原复合物后,每管加入50 mmol/L甘氨酸溶液使靶抗原复合物洗脱,并加入含有β-巯基乙醇的蛋白缓冲液在沸水中煮沸5 min后,用抗Flag和抗Myc标签的单克隆抗体分别对不同组别的Input样品和Co-IP样品进行Western blot检测。
1.6 统计学处理
数据分析采用SPSS11.5统计分析软件,采用方差分析和t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 pCMV-VP16-GNB2 载体构建
以HeLa细胞为模板扩增GNB2基因开放读框片段结果(图1A)。GNB2基因开放读框大小为1 023 bp。如图A可见,以56℃为退火温度未扩增出相应条带,以58℃为退火温度可扩增出与GNB2一致的1 023 bp条带。重组质粒pCMV-VP16-GNB2经EcoRⅠ和SalⅠ酶切后可扩增出1 023 bp大小条带,与预期的一致(图1B)。DNA测序结果与GNB2编码区序列一致(图2)。

图1 pCMV-VP16-GNB2载体构建及鉴定Figure 1 The construction and identification of recombinant plasmid pCMV-VP16-GNB2

图2 pCMV-VP16-GNB2部分测序图Figure 2 Partial sequencing map of pCMV-VP16-GNB2
2.2 pCMV-Flag-GNB2 载体构建
以pCMV-VP16-GNB2质粒为模板可扩增出与GNB2一致的1 023 bp大小条带(见图3A),重组质粒pCMV-Flag-GNB2经EcoRⅠ和SalⅠ酶切可扩增出1 023 bp大小条带,与预期的一致(见图3B),GNB2基因开放读框大小为1 023 bp。DNA测序结果与GNB2编码区序列一致(见图4)。

图3 pCMV-Flag-GNB2载体构建及鉴定Figure 3 The construction and identification of recombinant plasmid pCMV-Flag-GNB2
图4 pCMV-Flag-GNB2基因全长部分测序图Figure 4 Partial sequencing map of pCMV-Flag-GNB2
2.3 哺乳动物双杂交实验结果
质粒构建正确后,在HeLa细胞中通过哺乳动物双杂交实验对FHL1C和GNB2在体内的相互作用关系进行了验证(图5),通过实验组和阳性对照组的结果进行对比并统计分析得出,相对于阳性对照组,在体外环境中,FHL1C和GNB2之间不能通过相互结合而激活下游报告基因Luciferase的表达。提示FHL1C和GNB2在体外可能不存在相互作用。
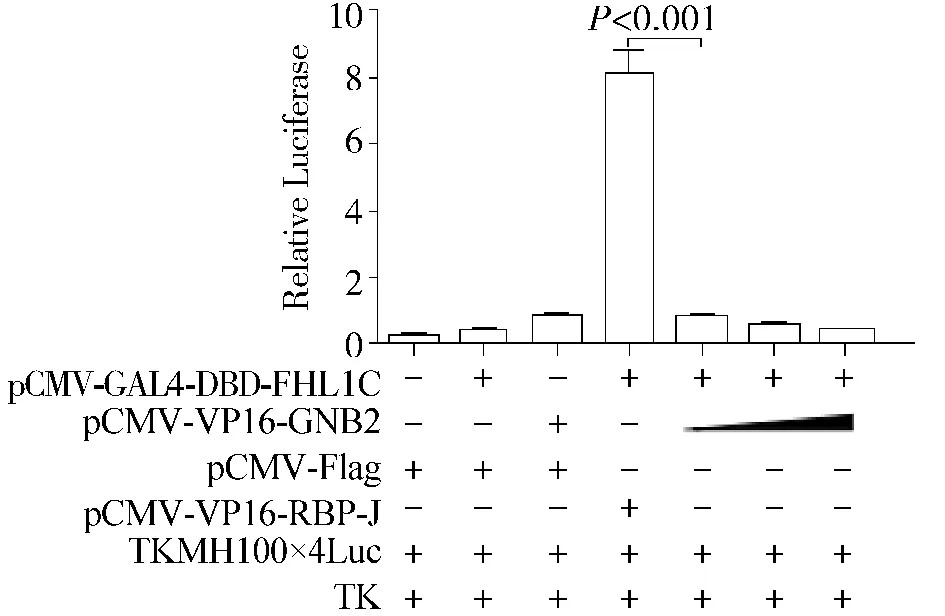
图5 哺乳动物双杂交实验中报告基因结果Figure 5 The report gene assay results of mammalian twohybrid experiments
2.4 免疫共沉淀实验结果
为了进一步验证FHL1C与GNB2之间是否存在体内的相互作用,我们将Flag标签标记的GNB2与Myc标签标记的FHL1C质粒在HeLa细胞中共转染,pCMV-Flag空载体作为阴性对照。细胞裂解后的共沉淀蛋白复合物用Myc标签抗体捕获,并分别用Myc、Flag抗体进行Western blot检测。结果显示,实验组和Input组均可检测出FHL1C条带,而实验组免疫沉淀复合物中未能发现GNB2与FHL1C形成共沉淀(见图6)。提示FHL1C和GNB2在体内可能不存在生理上的相互作用。
3 讨论

图6 免疫共沉淀实验中ECL发光结果Figure 6 The ECL results of co-immunoprecipitation experiments
当今,人们对蛋白质药物越来越关注。已有人预测过,2014年销售额前100位的处方药中几乎有近一半为蛋白质药物[10]。蛋白与蛋白间的相互作用通过介导不同的信号通路,在细胞增殖、定向分化等细胞行为的调节中发挥重要作用[11]。Notch信号通路通过其胞内段NICD与转录因子RBP-k相结合而激活下游基因的转录[11,12]。γ-分泌酶抑制剂能有效地抑制Notch信号途径,但因为其并非特异性的Notch信号途径抑制剂[13],而且具有显著的肠毒性[14],使其在临床中的应用受到了限制。因此,设计及优化Notch信号通路的新型抑制剂尤为重要。以往文献表明,LIM结构域蛋白 FHL1C(鼠源KyoT2)可通过竞争性结合RBP-J而抑制Notch信号转录激活作用[15]。FHL1C在睾丸、骨骼肌和心脏中高表达,并通过同其他蛋白的相互作用从而发挥转录调控作用[15]。因此对于FHL1C功能的研究,特别是相互作用蛋白的研究,将有助于我们进一步理解其特异性抑制Notch信号的分子机制,并为寻找可能的抑制Notch信号的新的阻断剂奠定基础。GNB2为调节蛋白鸟嘌呤核苷酸结合蛋白G蛋白β亚基中的一个亚型。目前,有关其生物学功能的报道比较少。一般认为,GNB2主要依赖其包含的7个重复的WD40区[16]招募和固定激活因子与效应蛋白,并使它们结合成多种蛋白复合物。Jung等[17]发现,GNB2可以通过激活Axin并启动泛素介导的蛋白降解途径将Dishevelled降解掉,从而负反馈调节t/Frizzled→Gβγ→PLC→Ca2+/PKC信号通路。本实验通过一系列的分子相互作用的实验证实了经质谱分析获得的FHL1C的候选分子GNB2与FHL1C之间不存在细胞内的相互作用,从而排除FHL1C可能通过与小G蛋白家族分子相互作用调控Notch信号的机制,提示FHL1C可能通过与其他相互作用候选分子调控Notch信号途径。我们推测,质谱实验中显示的FHL1C与GNB2之间的相互作用可能为假阳性。其可能的原因是,FHL1C是富含LIM结构域的蛋白,LIM结构域是蛋白-蛋白之间相互作用的界面,而GNB2的功能也是募集和固定各种相互作用的分子。因而,当GNB2在体外过表达后,其过量招募相互作用蛋白,尤其是可与FHL1C形成蛋白复合物的蛋白组分,从而可能改变了蛋白复合物的空间构向,通过占位效果使得FHL1C蛋白复合物的定位或结构发生改变,从而无法观察检测到FHL1C与GNB2的相互作用。然而,其在生理状态下,是否能够相互作用,以及其可能的功能和作用,仍需进一步的探讨。同时,为进一步研究KyoT2的生理功能,其与其他相互作用候选分子的关系仍需进一步研究和确认。
[1]Feuerstein R,Wang X,Song D,et al.The LIM/double zinc-finger motif functions s a protein dimerization domain[J].Proc Natl Acad Sci USA,1994,91(22):10655-10659.
[2]Liang L,Zhang HW,Liang J,et al.KyoT3,an isoform of murine FHL1,associates with the transcription factor RBP-J and represses the RBP-J-mediated transactivation[J].Biochim Biophys Acta,2008,1779(12):805-810.
[3]Sanchez-Garcia I,Rabbitts TH.The LIM domain:a new structural motif found in zinc-finger-like proteins[J].Trends Geneti,1994,10(9):315-320.
[4]Schmeichel KL,Beckerle MC.The LIM domain is a modular protein-binding interface[J].Cell,1994,79(2):211- 219.
[5]Taniguchi Y,Furukawa T,Tun T,et al.LIM protein KyoT2 negatively regulates transcription by association with the RBP-J DNA-binding protein[J].Mol Cell Biol,1998,18(1):644- 654.
[6]Qin H,Du D,Zhu Y,et al.The PcG protein HPC2 inhibits RBP-J-mediated transcription by interacting with LIM protein KyoT2[J].FEBS Lett,2005,579(5):1220-1226.
[7]Qin H,Wang J,Liang Y,et al.RING1 inhibits transactivation of RBP-J by Notch through interaction with LIM protein KyoT2[J].Nucleic Acids Res,2004,32(4):1492-1501.
[8]Fu W,Wang K,Zhao JL,et al.FHL1C induces apoptosis in Notch1-dependent T-ALL cells through an interaction with RBP-J[J].BMC Cancer,2014,14:463.
[9]Zhao JL,Liang SQ,Fu W,et al.The LIM domain protein FHL1C interacts with tight junction protein ZO-1 contributing to the epithelial-mesenchymal transition(EMT)of a breast adenocarcinoma cell line[J].Gene,2014,542(2):182- 189.
[10]Strohl WR,Knight DM.Discovery and development of biopharmaceuticals:current issues[J].Curr Opin Biotechnol,2009,20(6):668-672.
[11]Yin L,Velazquez OC,Liu ZJ.Notch signaling:emerging molecular targets for cancer therapy[J].Biochem Pharmacol,2010,80(5):690-701.
[12]Weng AP,Nam Y,Wolfe MS,et al.Growth suppression of pre-T acute lymphoblastic leukemia cells by inhibition of notch signaling[J].Mol Cell Biol,2003,23(2):655-664.
[13]Boulton ME,Cai J,Grant MB.Gamma-Secretase:a multifaceted regulator of angiogenesis[J].J Cell Mol Med,2008,12(3):781-795.
[14]Milano J,McKay J,Dagenais C,et al.Modulation of notch processing by gamma-secretase inhibitors causes intestinal goblet cell metaplasia and induction of genes known to specify gut secretory lineage differentiation[J].Toxicol Sci,2004,82(1):341- 358.
[15]Ng EK,Lee SM,Li HY,et al.Characterization of tissue-specific LIM domain protein(FHL1C)which is an alternatively spliced isoform of a human LIM-only protein(FHL1)[J].J Cell Biochem,2001,82(1):1-10.
[16]Hsu JM,Lee YC,Yu CT,et al.Fbx7 functions in the SCF complex regulating Cdk1-cyclin B-phosphorylated hepatoma up-regulated protein(HURP)proteolysis by a proline-rich region[J].J Biol Chem,2004,279(31):32592-32602.
[17]Jung H,Kim HJ,Lee SK,et al.Negative feedback regulation of Wnt signaling by Gβγ-mediated reduction of Dishevelled[J].Exp Mol Med,2009,41(10):695-706.
