荧光共振能量转移技术阳性参照质粒的构建及应用
2015-12-25金艳燕金良韵肖忠新徐志卿张进禄赵君朋首都医科大学医学实验与测试中心激光扫描共聚焦显微镜室北京00069首都医科大学神经生物学系通讯作者mailxuebingbjcom
金艳燕,邓 君,金良韵,肖忠新,徐志卿,张进禄,赵君朋,薛 冰(首都医科大学医学实验与测试中心激光扫描共聚焦显微镜室,北京 00069;首都医科大学神经生物学系;通讯作者,E-mail:xuebing_bj@6.com)
荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术是目前用于研究生物大分子相互作用的一项较新的技术。在国内被广泛的用于研究细胞内生物大分子相互作用、酶的活性测定、核酸检测、离子浓度和细胞膜电位测定等方面[1-4]。随着生命科学研究的深入和细化,越来越多的研究认为蛋白质-蛋白质间的相互作用是生命现象发生机制的关键因素。一些传统的研究方法存在缺陷:如酵母双杂交、磷酸化抗体、免疫荧光、放射性标记等方法应用的前提都是要破碎细胞或对细胞造成损伤,无法做到在活细胞生理条件下实时的对细胞内蛋白质-蛋白质间相互作用进行动态研究[5]。而FRET则更适用于活细胞和固定细胞的各类分子,灵敏度和分辨率高,并能清晰成像,最直观地提供蛋白质相互作用的定位和定量信息[6]。随着绿色荧光蛋白(GFP)应用技术的发展,GFP近年来发展出了多种突变体,通过引入各种点突变使发光基团的激发光谱和发射光谱均发生变化而发出不同颜色的荧光,有蓝色荧光蛋白(BFP)、黄色荧光蛋白(YFP)、青色荧光蛋白(CFP)等。这些突变体使GFP应用于FRET成为可能,为FRET技术用于活体检测蛋白质相互作用提供了良好的支持[5,6]。利用基因工程的方法,用不同颜色的荧光标记目的蛋白,通过荧光蛋白发生FRET现象,从而间接地观察目的蛋白间是否发生相互作用,这种相互作用研究是在无损细胞的状态下完成,并且可以实时动态地观察,更加符合细胞正常的生理状态。正因为FRET研究在生命科学研究中的优势,所以建立稳定的FRET技术应用平台、深入探索FRET技术应用的条件和应用范围很必要的。本研究拟利用已有的两种黄色荧光蛋白(YFP)和青色荧光蛋白(CFP)真核表达载体,通过基因工程的方法,将两种基因相连,通过细胞转染使其表达青色荧光蛋白和黄色荧光蛋白相连的融合蛋白,并进行了FRET效率的测定实验,进一步观察融合蛋白是否符合FRET现象发生的条件,能否用于FRET研究并作为阳性参照物。
1 材料与方法
1.1 主要试剂
E.coli DH5α感受态细胞(中国天根公司);RNA提取试剂盒和转染试剂盒(德国Qiagen公司);胶回收及纯化试剂盒和质粒提取及纯化试剂盒(美国Omega公司);pAmCyan1-N1载体、pZsYellow1-N1(美国Clonetech公司);载体限制性内切酶、DNA聚合酶(日本 Takara公司);T4 DNA连接酶、2-Log DNA Ladder(美国NEB公司);高糖DMEM无血清培养基、胎牛血清(美国GIBICO公司)。
1.2 细胞系及培养方法
HEK293细胞(American Type Culture Collection,ATCC)。培养条件:90%高糖DMEM培养基加入10%胎牛血清。在37℃、饱和湿度、5%CO2培养箱中培养。
1.3 AmCyan1基因的克隆
根据pAmCyan1-N1(以下简称pCFP)真核表达载体中AmCyan1基因序列设计引物:上游引物含有HindⅢ酶切位点,序列为5'-CCCAAGCTTATGGCCCTGTCC-3';下游引物含有SacⅡ酶切位点,序列为 5'-ATACCGCGGGAAGGGCACCAC-3'。以pAmCyan1-N1为模板PCR扩增。
1.4 真核表达质粒pAmCyan1-ZsYellow1的构建
将扩增产物进行1%琼脂糖凝胶电泳,回收和纯化700 bp的PCR产物,产物和pZsYellow1-N1(以下简称pYFP)载体进行HindⅢ/SacⅡ双酶切,进一步胶回收纯化产物,室温连接。重组质粒经过酶切鉴定和基因测序,利用NCBI在线Nucleotide BLAST比对工具Basic Local Alignment Search Tool对pAm-Cyan1-ZsYellow1(以下简称pCFP-YFP)测序结果与已知AmCyan1基因序列进行分析比对。
1.5 真核表达质粒pCFP-YFP在HKE293细胞的表达
HEK293细胞转染前24 h传代于35 mm培养皿中,常规培养。转染当天,加入0.4 μg质粒。转染后24-36 h,传代于共聚焦专用皿中,在激光共聚焦显微镜Leica TCS-SP5系统下观察AmCyan1-ZsYellow1蛋白(以下简称CFP-YFP)的表达情况。
1.6 FRET 研究
根据FRET实验要求,共需要四组对照分别是:①阴性对照组(CFP+YFP),HEK293细胞中共转染pCFP和pYFP;②阳性对照组(CFP-YFP),HEK293细胞中转染pCFP-YFP阳性对照质粒;③pCFP单转染组,HEK293细胞中仅转染pCFP质粒;④pCFP单转染组,HEK293细胞中仅转染pYFP质粒。
质粒转染方法及细胞表达方法同1.5。
图像采集由Leica SP5激光共聚焦显微镜系统完成,氩粒子激光器提供激光光源。CFP(供体)的激发波长在458 nm,探测器(PMT)检测波长设在462-510 nm之间,YFP(受体)的激发波长在514 nm,PMT检测波长设在518-580 nm之间。样品观察采用63×物镜,数值孔径(NA)为1.40,图像采集在原有放大倍数上进行电子放大3倍(Zoom=3)。
FRET图像采集及FRET效率计算由LAS AF Version1.8.2 build 1465 软件完成。
1.7 统计学分析
CFP+YFP组和CFP-YFP组为分别随机采集5个细胞图像,并在每个细胞中随机分析3个兴趣区域(ROI),每组的样本数为15,进行FRET转移效率(EFRET)计算和统计。数据以±s表示,采用t检验对阴性对照组和阳性对照组间EFRET差异进行比较,P<0.05认为差异有统计学意义。
2 结果
2.1 pAmCyan1基因插入到pZsYellow1-N1载体的多克隆位点(MCS)
如图1所示,以pAmCyan1-N1为模板,设计引物,上游引物5'端带有HindⅢ酶切位点,下游引物5'端带有SacⅡ酶切位点。通过PCR反应,扩增AmCyan1基因片段。通过双酶切体系,将AmCyan1基因插入到pZsYellow1-N1载体的多克隆位点HindⅢ和SacⅡ酶之间,下游的ZsYellow1基因序列无读码框的移位。同时AmCyan1基因序列下游引物5'端去除了终止密码子TGA,确保插入到载体中的序列能够往3'端方向继续转录和翻译,不影响ZsYellow1基因正确翻译为黄色荧光蛋白。AmCyan1基因序列位于ZsYellow1的上游,二者之间隔30个碱基,序列为CCG CGG GCC CGG GAT CCA CCG GTC GCC ACC,经过翻译,可表达为具有10个氨基酸残基一小段肽段,分别是脯氨酸(P),精氨酸(R),丙氨酸(A),精氨酸(R),天冬氨酸(D),脯氨酸(P),脯氨酸(P),缬氨酸(V),丙氨酸(A),苏氨酸(T)。因为CFP蛋白在YFP蛋白的N端,所以融合蛋白命名为CFP-YFP。
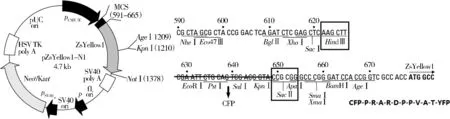
图1 pZsYellow1-N1载体图谱及多克隆位点序列Figure 1 The macrorestriction map in multiple cloning site(MCS)of pZsYellow1-N1
2.2 真核表达质粒pAmCyan1-ZsYellow1的酶切鉴定及测序结果
对pAmCyan1-ZsYellow1质粒进行HindⅢ/SacⅡ双酶切鉴定,然后1%琼脂糖凝胶电泳,在700 bp位置可以看到特异的条带(见图2)。pAmCyan1基因序列共含有687个碱基(不包含终止密码子),所以在700 bp位置看到条带说明PCR扩增的AmCyan1序列成功的插入到pZsYellow1-N1载体中。利用NCBI在线比对工具Basic Local Alignment Search Tool(Nucleotide BLAST)对pAmCyan1-ZsYellow1测序结果与已知AmCyan1进行比对,结果显示碱基序列完全一致,不存在突变和缺失(见图3),说明pAmCyan1-ZsYellow1质粒构建成功。
2.3 利用Leica SP5激光共聚焦显微镜观察CFPYFP融合蛋白
EFRET代表FRET转移效率图,图片的颜色越偏向冷色调,说明FRET转移的效率越低。图4结果显示,CFP-YFP阳性组的EFRET图偏黄绿色,而CFP+YFP阴性组偏蓝色,说明阳性组FRET转移信号较阴性组强。融合蛋白CFP-YFP在细胞中主要在细胞质中表达,极少量进入到细胞核中,这与pCFP和pYFP共转染的细胞中荧光蛋白的分布略有不同,后者在细胞胞质和细胞核中均有表达。我们认为CFP和YFP荧光蛋白的分子量大概在20 kD左右,在HEK293细胞共转染时,二者分别是独立的个体,并无紧密连接,可以自由进出细胞核,所以在细胞核内可观察到荧光。而构建成融合蛋白之后,分子量变为40 kD,空间构象发生改变,影响了其进入细胞核,所以观察到细胞核位置仅有少量的荧光。
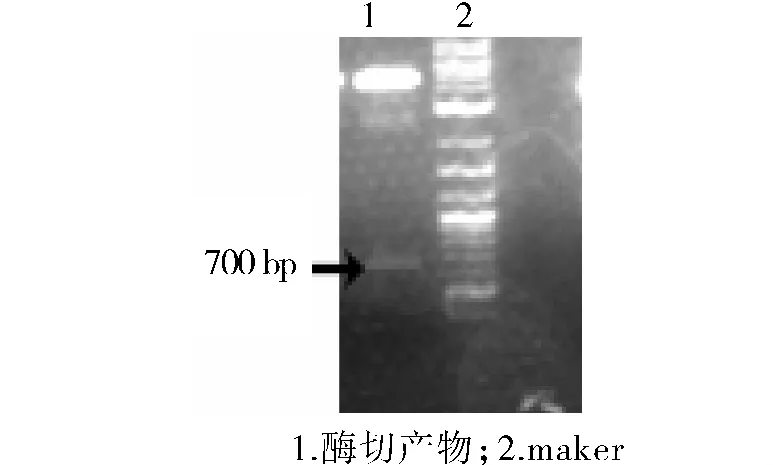
图2 真核表达质粒pZsYellow1-AmCyan1酶切鉴定结果Figure 2 Identification of pZsYellow1-AmCyan1 by restriction enzyme analysis

图3 真核表达质粒pZsYellow1-AmCyan1基因测序在NCBI网站上比对鉴定结果Figure 3 Identification of pZsYellow1-AmCyan1 by nucleotide BLAST on line
2.4 CFP-YFP融合蛋白FRET转移率的统计分析

图4 阳性对照组和阴性对照组的FRET图像Figure 4 The accumulation of FRET signal by Leica confocal system in positive control and negative control
pCFP和pYFP质粒单转染组主要用于FRET转移率计算步骤中的数据校正,所以在此未统计FRET的效率。pCFP和pYFP质粒共转染组为阴性对照组,EFRET 为(12.70±5.48)%,pCFP-YFP 阳性对照组EFRET为(57.20 ±6.66)%。阴性对照组和阳性对照组之间的EFRET差值,经过t检验,差异有统计学意义(t=19.99,P <0.05),这表明 pCFP-YFP阳性质粒可以用于FRET研究。而阴性对照组中,pCFP和pYFP虽然共转染到同一细胞中,但实际二者并无紧密连接,随着荧光分子在细胞内运动,某些分子在空间上可能发生距离足够近时,可以发生极少的FRET现象,所以测得FRET转移率很低,但不完全为0。
3 讨论
随着生命科学研究的深入,对实验技术的需求不断提高,新技术随之诞生和迅速发展。在研究蛋白质分子之间相互作用的诸多方法中,利用荧光蛋白标记的FRET具有活细胞观察的优势,能够无创、实时观察蛋白分子间的动态变化。
FRET是指能量从一种受激发的荧光基团(fluorophore)转移到另一种荧光基团的物理现象[7,8]。前者称为供体(donor),后者称为受体(acceptor),当发生FRET时,激发态的供体以非辐射的方式将部分能量转移到受体,使受体被激发发射荧光,而自身的荧光淬灭(quenching)[7]。

根据E的公式推理认为,CFP-YFP间隔的氨基酸残基数量越少FRET发生的效率越高。在国内的一项研究中,研究者利用分子生物学实验方法,分别创建了间隔为15,24和37个氨基酸残基的多种CFY-YFP融合蛋白,并进行了FRET转移效率的比较,发现间隔15个氨基酸FRET效率最高[9]。在另一项研究中,采用的是相隔15个氨基酸残基的阳性融合蛋白作为阳性参照[1]。而在本研究中,我们利用现有的质粒,并通过选择合适的酶切位点,将CFP的片段插入到YFP的真核表达载体中,首次创建了相隔10个氨基酸残基的CFY-YFP融合蛋白,使FRET的发生效率再次提高。
基于荧光强度的FRET方法,其效率的计算受很多因素影响,比如产生荧光光子的数量,荧光漂白以及分子的位置等[9],而一些外在因素如样品移动、激发光波动等也会影响FRET测定结果,所以在试验中设置合理的阴性对照和阳性对照对于评价一个实验技术是否稳定,实验方法是否合理是非常重要的。阳性对照物可以为研究者在采集图像,参数校正等方面提供非常重要的参考,从而指导研究者获得可靠的数据。不仅如此,本研究中构建的CFPYFP融合蛋白还能运用于其他研究中,如荧光寿命成像测定共振能量传递(FILM-FRET)和荧光相关光谱(FCS)中作为参照物。
本研究通过构建pYFP-CFP真核表达载体,建立了FRET技术的应用平台,从构建质粒、细胞转染到共聚焦图像采集、FERE转移率的数据分析等方面都有涉及,从而为进一步开发FRET技术提供更好的技术支持。
[1]钟田雨,唐靖,陈登宇,等.利用荧光共振能量转移技术研究活细胞TLR4与MD-2作用结构域[J].生物化学与生物物理进展,2009,36(11):1451-1457.
[2]李俊青,江建明,冯瑞强,等.蛋白激酶C激活的荧光共振能量转移分析[J].南方医科大学学报,2011,31(1):1867-1870.
[3]邓楚芸,李佳敏,马万云.DNA纳米传感器荧光成像技术[J].光谱学与光谱分析,2010,30(1):220-224.
[4]刘波,邵帅,谢飞,等.荧光共振能量转移技术在细胞离子研究中的应用[J].北京生物医学工程,2015,34(2):196-202.
[5]王进军,陈小川,邢达.FRET技术及其在蛋白质-蛋白质分子相互作用研究中的应用[J].生物化学与生物物理进展,2003,30(6):980-984.
[6]张志毅,周涛,巩伟丽,等.荧光共振能量转移技术在生命科学中的应用及研究进[J].展电子显微学报,2007,26(6):620-624.
[7]刘镭,张英杰,汪献旺.利用荧光共振能量转移技术在活细胞内研究顺铂诱导的凋亡信号通路[J].生物化学与生物物理进展,2009,36(9):1172-1179.
[8]刘春春,杭海英.生物大分子相互作用检测技术新进展:三色荧光级联荧光共振能量转移技术[J].生物化学与生物物理进展,2006,33(3):292-296.
[9]Xia Z,Liu Y.Reliable and global measurement of fluorescence resonance energy transfer using fluorescence microscopes[J].Biophys J,2001,81(4):2395-2402.
