PINK1对酪氨酸羟化酶的表达调控
2015-12-25鲁玲玲贾焕珍首都医科大学神经生物学系北京市脑重大疾病研究院北京市神经再生修复研究重点实验室神经变性病教育部重点实验室北京100069通讯作者mailhuiyangccmueducn
鲁玲玲,贾焕珍,杨 慧(首都医科大学神经生物学系,北京市脑重大疾病研究院,北京市神经再生修复研究重点实验室,神经变性病教育部重点实验室,北京 100069;通讯作者,E-mail:huiyang@ccmu.edu.cn)
帕金森病(Parkinson’s disease,PD)是中老年常见多发病,主要病理变化是中脑黑质致密部多巴胺能神经元的进行性变性缺失,纹状体多巴胺(dopamine,DA)含量的降低,进而引起运动功能障碍[1]。研究表明,PD是遗传因素和环境因素共同作用的结果。研究PD相关基因的功能有助于理解PD发病机制。至今发现的与PD相关的基因有α-syn、PINK1(PTEN-induced kinase 1,PTEN诱导的蛋白激酶1)、LRRK2、UCH-L1、parkin 以及 DJ-1 等 16 种[2-4]。其中PINK1又称PARK6,位于染色体1p35-36,其突变后可导致常染色体隐性遗传性PD。有报道指出在家族性PD中,PINK1基因存在多个突变位点[5]。在散发性PD患者的病理学检测中发现,有5%-10%的路易体为 PINK1免疫染色阳性[6-7]。说明 PINK1不仅与家族型PD发病相关,而且与散发性PD发病也有关系。
酪氨酸羟化酶(tyrosine hydroxylase,TH)是多巴胺合成过程中的限速酶。有文献报道,PINK1缺失或功能异常可引起多巴胺能神经元的数目减少,脑内DA水平下降,引发类似帕金森病的运动障碍[8-11]。并且,在脑内PINK1与 TH 存在共定位现象[9],表明PINK1与TH之间存在某种联系。因此,本研究拟在PINK1基因敲减及过表达的细胞模型中,研究PINK1对TH蛋白表达的调节作用。
1 材料方法
1.1 细胞株及主要试剂
小鼠多巴胺能神经母细胞瘤细胞株(MN9D细胞)由瑞士诺华公司Bastian Hengerer博士惠赠。引物合成(上海英骏生物技术有限公司北京测序部);Wizard Plus Midipreps DNA Purification systems(Promega公司,美国);DMEM/F12培养基、胎牛血清(FBS)和胰蛋白酶(Gibco公司,美国);RIPA裂解液(北京普利莱基因技术有限公司);TH,β-actin抗体及山羊血清(Sigma公司,美国);PINK1抗体,Lipofectamine 2000,HRP标记的二抗购于KPL公司(美国);荧光二抗购于Invitrogen公司(美国)。
1.2 细胞培养及转染
MN9D细胞采用含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的DMEM/F12培养基,置于37℃,5%CO2培养箱中培养。细胞实验共分为四组,PINK1基因敲减组(转染干扰序列PINK1shRNA1#或shRNA2#)及其对照组(转染无关对照序列)、PINK1基因过表达组(转染PINK1的真核表达质粒)与对照组(转染相应空载体)。转染前24 h向90 mm培养皿中接种生长状态良好的MN9D细胞,每皿1×106个细胞,使转染时生长至90%汇合。取375 μl OPTI-MEM加入转染管中,向内加入20 μl Lipofectamine 2000 Reagent,边加边振摇,轻混,室温静置5 min。然后取375 μl OPTI-MEM加入转染管中,向内加入12 μg携带 PINK1 shRNA及对照control载体,边加边振摇,轻混,室温静置5 min。将上述液体混合,室温静置20 min;在此期间,吸弃旧培养基,用OPTI-MEM洗涤细胞3次,以去除血清,后加入OPTI-MEM,每个培养皿7.5 ml及上述Lipofectamine 2000/质粒 DNA混合液,置于37℃、5%CO2的培养箱中孵育6 h,更换为新鲜全培养基。转染后相应时间进行后续实验。
1.3 免疫细胞化学
取正常培养的MN9D细胞,用4%多聚甲醛固定30 min。然后用PBST洗3次,每次10 min。用5%山羊血清室温孵育1 h,加入anti-Nurr1(1∶200)抗体,4℃过夜,次日用 PBS洗3次,加入相应的FITC标记的羊抗兔免疫球蛋白抗体(1∶500),37℃避光孵育1 h,PBS冲洗3次,加入DAPI于37℃避光孵育5 min复染细胞核,PBS冲洗3次,封片后用共聚焦扫描显微镜观察。
1.4 Western blot检测
选用RIPA蛋白裂解液进行细胞裂解,BCA法测蛋白浓度,SDS PAGE电泳,半湿转法将蛋白转移至PVDF膜,8%脱脂牛奶封闭1 h,分别入PINK1(1∶10 000)和 TH(1∶10 000)、Nurr1(1∶500)、β-actin(1∶5 000),4 ℃过夜。0.1%TBST 洗膜 3次,入相应辣根过氧化物酶标记的羊抗兔免疫球蛋白抗体中(1∶10 000),室温孵育1 h,洗膜同前。加入化学发光液,于暗室化学发光及显影、定影。
1.5 real-time-PCR检测基因表达水平
转染PINK1shRNA于MN9D细胞中,利用Trizol一步法提取(参照试剂盒说明书)总RNA,以oligo(dT)为引物进行反转录合成cDNA。real-time PCR反应条件:50℃ 2 min,95℃ 2 min,95℃ 15 s,退火15 s,72℃ 45 s,共40个循环;72℃ 10 min。所用的引物为:小鼠PINK1上游引物:5'-AGAAAACCAAGCGCGTGTCT-3';下游引物:5'-GGAAGCCCTGCCAGCAT-3';小鼠 TH上游引物:5'-CGAGCTGCTGGGACACGTA-3';下游引物:5'-CTGGGAGAACTGGGCAAATG-3'。
1.6 统计学分析
所有实验数据均通过SPSS12.0统计软件进行t检验,数值以±s表示。
2 结果
2.1 干扰PINK1的MN9D细胞模型的建立
MN9D细胞转染PINK1干扰序列(shRNA1#和shRNA2#)后24 h和48 h,检测正常 MN9D细胞(normal)、转染无关序列的对照组细胞(control)、转染干扰序列(PINK1 shRNA1#,shRNA2#)的干扰组细胞等各组细胞中PINK1的表达水平。在荧光显微镜下观察质粒的转染效率很高。Western blot结果显示转染后24 h、48 h,干扰组(PINK1 shRNA1#,shRNA2#)PINK1的表达水平与对照组相比均明显降低(P<0.01,P <0.001,n=3)。且 PINK1 shRNA2#的干扰效率优于shRNA1#(图1)。
2.2 敲减PINK1基因组与对照组TH蛋白的表达水平比较



图1 MN9D细胞转染干扰序列(shRNA1#和shRNA2#)后24 h和48 h PINK1的表达水平Figure 1 PINK1 expression after knocked-down by shRNA for 24 h and 48 h
在MN9D细胞中敲减PINK1基因后24 h、48 h,用Western blot方法检测p-TH及TH水平。正常MN9D细胞为normal组,转染无关序列为对照组,转染PINK1shRNA2#为干扰组。结果显示,转染PINK1干扰序列48 h后,p-TH和TH水平均明显降低,但是p-TH/TH没有明显改变(见图2),说明示p-TH的水平可能是随总TH水平的降低而降低的,提示干扰PINK1使总TH的水平降低,进而影响了p-TH的水平。恢复PINK1水平后,TH水平也明显恢复(图2),进一步证实了TH水平的降低确实是由于PINK1缺失所引起。

图2 在MN9D细胞中敲减PINK1基因24 h、48 h后p-TH及TH水平变化Figure 2 Western blot analysis of p-TH and TH protein levels at 24 h and 48 h
2.3 敲减PINK1组与对照组TH mRNA水平比较
本研究发现PINK1干扰可引起TH蛋白表达水平的降低,那么PINK1是否也影响TH的mRNA水平。为了探讨PINK1是否从转录水平就影响了TH的表达,在MN9D细胞中敲减PINK1基因24 h、48 h后,用Real-time RT-PCR方法检测TH的mRNA水平。结果显示,转染PINK1干扰序列24 h,48 h后,PINK1的mRNA水平明显降低,TH的mRNA水平随PINK1的干扰而降低,具有统计学意义(图3)。

图3 敲减PINK1后TH的mRNA水平变化(*P<0.05,**P<0.001 vs control;n=3)Figure 3 Real-time PCR analysis of PINK1 and TH mRNA levels after knocking-down PINK1 gene(*P <0.05,**P <0.001 vs control;n=3)
2.4 过表达PINK1组与对照组TH蛋白表达水平比较
本研究已经证实敲减PINK1对TH表达的影响,为了进一步验证两者之间的关系,采用过表达模型来证明PINK1对TH的调控作用。在MN9D细胞中过表达PINK1基因48 h后,TH蛋白的水平与对照组相比明显升高,具有统计学意义;转染PINK1-G309D突变组细胞,TH蛋白的水平与对照组相比没有明显变化(见图4)。
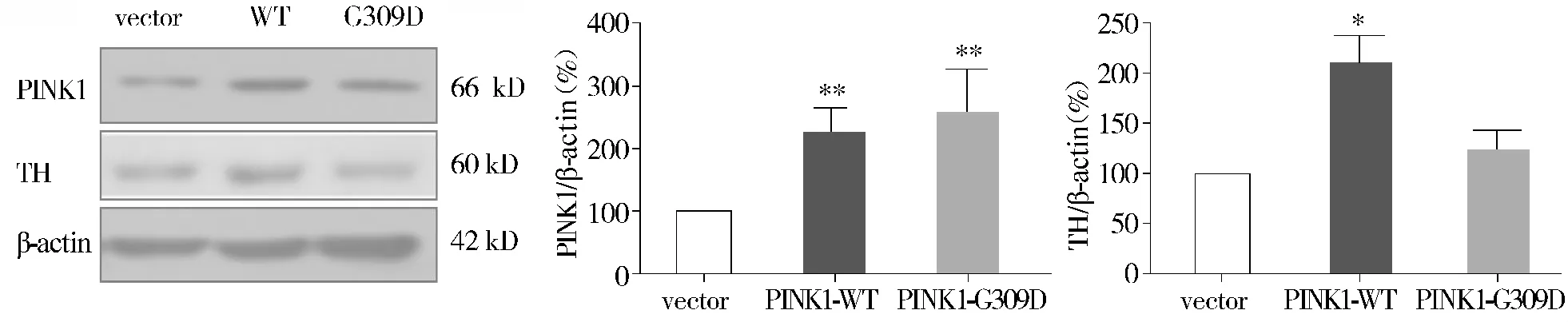
图4 过表达PINK1后TH蛋白表达水平变化Figure 4 Western blot analysis of TH protein levels in MN9D cells after PINK1 overexpression
3 讨论
PD的病理特征是黑质致密部多巴胺能神经元的进行性丢失。PINK1突变不仅可引起家族性PD,而且与散发性的PD密切相关,但PINK1突变引起多巴胺代谢异常或者多巴胺神经元功能异常的机制尚不清楚。本实验通过干扰PINK1基因的表达,成功建立 PINK1敲减的 MN9D细胞模型。在敲减PINK1的MN9D细胞模型中,发现p-TH和TH蛋白表达水平与对照组相比均明显降低,而p-TH/TH的水平虽有减少,但是不具有统计学意义,提示PINK1可能是从慢速调节(TH表达量)来影响TH的活性即p-TH的水平。为了进一步探讨PINK1如何调控TH,在敲减PINK1的细胞中,检测TH的mRNA水平,结果显示TH无论是在mRNA水平还是蛋白水平均明显降低。相反,当过表达PINK1时,TH的表达出现上调。本研究首次从敲减和过表达正反两方面证明了PINK1对于TH的调节作用。在斑马鱼模型中抑制PINK1的表达可引起TH mRNA水平下降[12]。同样,在转基因鼠中,敲减 PINK1之后,DA水平下降,但 TH阳性神经元却没有明显的降低[11],说明敲减PINK1引起的DA水平下降可能不是由于多巴胺能神经元减少造成的,而是调控了TH蛋白表达所造成的。因此,本研究所得结论与文献报道的结果是相一致。由于TH是多巴胺合成过程中的限速酶,因此是PD基因治疗中的一个重要靶基因。由于PINK1可以调节TH的表达,因此也可以作为将来PD基因治疗的候选基因。这为PD的治疗提供了一条新的思路。
[1]Braak H,Ghebremedhin E,Rub U,et al.Stages in the development of Parkinson’s disease-related pathology[J].Cell Tissue Res,2004,318(1):121-134.
[2]Crosiers D,Theuns J,Cras P,et al.Parkinson disease:Insights in clinical,genetic and pathological features of monogenic disease subtypes[J].J Chem Neuroanat,2011,42(2):131- 141.
[3]van der Merwe C,Jalali Sefid Dashti Z,Christoffels A,et al.Evidence for a common biological pathway linking three Parkinson’s disease-causing genes:parkin,PINK1 and DJ-1[J].Eur J Neurosci,2015,41(9):1113-1125.
[4]Vasconcellos LF,Pereira JS.Parkinson’s disease dementia:Diagnostic criteria and risk factor review[J].J Clin Exp Neuropsychol,2015,37(9):988- 993.
[5]Kawajiri S,Saiki S,Sato S,Hattori N,et al.Genetic mutations and functions of PINK1[J].Trends Pharmacol Sci,32(10):573-580.
[6]Koichi W,Kunikazu T,Saori O,et al.The Lewy body in Parkinson’s disease and related neurodegenerative disorders[J].Mol Neurobiol,2013,47(2):495- 508.
[7]Samaranch L,Lorenzo-Betancor O,Arbelo JM,et al.PINK1-linked parkinsonism is associated with Lewy body pathology[J].Brain,2010,133:1128-1142.
[8]Koh H,Kim H,Kim MJ,et al.Silent information regulator 2(Sir2)and Forkhead box O(FOXO)complement mitochondrial dysfunction and dopaminergic neuron loss in Drosophila PTEN-induced kinase 1(PINK1)null mutant[J].J Biol Chem,2012,287(16):12750-12758.
[9]Anichtchik O,Diekmann H,Fleming A,et al.Loss of PINK1 function affects development and results in neurodegeneration in zebrafish[J].J Neurosci,2008,28(33):8199-8207.
[10]Yang Y,Gehrke S,Imai Y,et al.Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin[J].Proc Natl Acad Sci USA,2006,103(28):10793-10798.
[11]Gispert S,Ricciardi F,Kurz A,et al.Parkinson phenotype in aged PINK1-deficient mice is accompanied by progressive mitochondrial dysfunction in absence of neurodegeneration[J].PLoS One,2009,4(6):e5777.
[12]Sallinen V,Kolehmainen J,Priyadarshini M,et al.Dopaminergic cell damage and vulnerability to MPTP in Pink1 knockdown zebrafish[J].Neurobiol Dis,2010,40(1):93-101.
