香青兰总黄酮对心肌缺血-再灌注损伤线粒体保护作用的研究
2015-12-25姚佳茗曹文疆袁勇洪叶陈卫军王新春
姚佳茗 ,曹文疆 ,袁勇 ,洪叶 ,陈卫军 ,王新春 ,
(1石河子大学药学院,石河子 832002;2石河子大学医学院第一附属医院,石河子 832008)
心血管疾病是威胁人类健康的主要疾病之一[1]。近年来,心肌缺血-再灌注损伤(myocardial ischemiareperfusion injury,MIRI)已受到广大基础和临床工作者的关注[2-4]。造成MIRI的机制有许多,其中线粒体作为氧化磷酸化产生ATP的重要细胞器与MIRI的各个环节都有密切关系[5-7]。
香青兰(Dracocephalum Moldevica L.)为唇形科青兰属一年生草本植物[8],是维吾尔民族药之一,主要用于治疗心肌缺血、冠心病等心血管疾病[9-10]。其主要化学成分有黄酮类、挥发油、萜类、氨基酸及多肽等[11],黄酮是香青兰的主要有效成分[12]。香青兰总黄酮(Dracocephalum Moldavica L.total flavonoids,TFDM)对缺血心肌有保护作用,但其作用是否与线粒体保护作用密切相关。本实验通过对TFDM抗MIRI线粒体保护作用的研究,为香青兰临床治疗心血管疾病提供理论依据。
1 材料与方法
1.1 仪器
HX-100E小动物呼吸机(成都泰盟科技有限公司);BL-420E生物机能实验系统(成都泰盟科技有限公司);TGL-16H台式高速冷冻离心机(湘仪离心机仪器有限公司);Thermo Scientific Varioskan Flash 3001酶标仪(USA);UV-2401PC紫外分光光度计(日本岛津),JEOL-JEM-1230型透射电子显微镜(日本JEOL公司);EM-UC6型超薄切片机(美国Leica公司)。
1.2 试药
香青兰总黄酮提取物(新疆自治区药物研究所提供,香青兰总黄酮纯度为57%,20100708);复方丹参滴丸(天津天士力制药股份有限公司,950411);环孢素 A(Sigma,BCBG7884V);线粒体 /胞浆制备试剂盒(普利莱基因技术有限公司 C1260);BCA法微量蛋白检测试剂盒(南京建成,W 041);ATP含量测定试剂盒(南京建成,A095);MTT(Thermo scientific);DCFH-DA(Sigma,D6883)Evans Blue(Sigma,502A043);TTC(Sigma,531D036)
1.3 动物
雄性SD大鼠,体重200-300 g,由新疆医科大学实验动物中心提供。合格证号:新医动字第2003-0001号。
1.4 实验方法
1.4.1 分组及给药
SD大鼠雄性,随机分为7组,每组10只:假手术组(Sham);心肌缺血 -再灌注组(模型组,I/R);香青兰总黄酮低剂量药物组(TFDM-L,15 mg/kg/d),香青兰总黄酮中剂量药物组(TFDM-M,30 mg/kg/d),香青兰总黄酮高剂量药物组(TFDM-H,60 mg/kg/d);环孢素 A组(CsA,再灌前 20 min经尾静脉注射10 mg/kg);复方丹参滴丸阳性药对照组(CSDP,243 mg/kg/d)。各给药组灌胃给药 7 d,对照组和模型组同时用生理盐水灌胃,并于第8天给药后10 min行手术。
1.4.2 大鼠冠脉结扎(LAD结扎)致心肌缺血-再灌注模型的建立[13-14]
大鼠腹腔注射25%的乌拉坦(0.5 mL/100 g)麻醉。仰卧位固定,连接BL-420E生物机能实验系统,监测正常状态下大鼠肢体II导联心电图。行气管插管,切开皮肤,钝性分离胸肌至肋骨,从第四五肋间隙把胸腔撑开,接呼吸机,切除第五肋。撕开心包膜,暴露心脏,轻轻取出心脏结扎左冠状动脉前降支(LAD),观测心电图,以心电图 S-T段抬高、T波高耸或弓背向上抬高为心肌缺血模型复制成功的标志。缺血30 min后,掏出心脏,剪开结扎线,将其放回胸腔。此时以ST段抬高下降,T波逐渐恢复测定表示再灌注成功,120 min后进行取材和相应指标的测定。
1.4.3 心肌梗死面积的测定
采用Evans Blue-TTC双重染色法计算法分析梗死面积。再灌注120 min后,再次阻断LAD,从主动脉逆行注射1%伊文氏蓝,冲洗心脏,左心室切片,1%TTC磷酸缓冲液中避光,37℃恒温孵育30 min。计算缺血面积百分比(AAR/LV)=(缺血面积/左心室面积)×100%。梗死面积百分比(IS/AAR)=(梗死面积/缺血面积)×100%。
1.4.4 心肌组织ATP含量检测
按试剂盒说明书配置工作液并严格操作。工作液及待测样品加完后室温静置5 min,在636 nm处测吸光度值。
1.4.5 线粒体的制备
100-200mg心肌新鲜组织,剪碎加入预冷的Mito Solution研磨。将匀浆液800×g离心5 min 4℃。收集上清液,重复上一步骤。上清液10,000×g离心10 min 4℃,沉淀加入0.2 mL Mito Solution,12,000×g离心10 min 4℃。线粒体沉淀在管底并立即使用。
1.4.6 电镜标本制备
样品于2%的戊二醛液固定24 h以上,经0.1%磷酸缓冲液漂洗,1%锇酸固定,再用磷酸缓冲液冲洗。用 50%、60%、70%、90%丙酮脱水各 15 min,100%丙酮脱水10 min,两次。用环氧树脂812包埋剂进行常规包埋,在37℃温箱中过夜,于45℃温箱中放置12 h,60℃放置24 h。超薄切片,硝酸铅-醋酸双氧铀电子染色,JEOL-1230透射电镜下观察。
1.4.7 BCA法测定蛋白浓度
心肌线粒体蛋白含量的测定采用BCA蛋白定量检测法。按试剂盒说明书配置工作液。将蛋白标准液稀释成不同浓度,按说明书要求加入试剂,旋涡混合。37℃孵育30 min,用酶标仪在562 nm波长处读取吸光度,绘制标准曲线,根据标准曲线计算出蛋白浓度。调节样本蛋白浓度至0.5 mg/mL。
1.4.8 线粒体活力检测
取新鲜制备的线粒体悬液50μL,加入酶标板微孔中,加入5 g/L甲氮甲唑蓝20μL,30℃继续孵育30 min,再加入50μL异丙醇20 min后于酶联免疫检测仪570 nm比色。线粒体活力以加入MTT后OD570表示。
1.4.9 统计学方法
采用SPSS 17.0统计软件处理试验数据。所有数据都用均数±标准差(X±S)的形式表达,组间比较采用单因素方差分析(ANOVA)及t检验,P<0.01、P<0.05表示具有统计学意义。
2 结果与分析
2.1 TFDM对心肌梗死面积的影响
除假手术组,各缺血-再灌注组心肌AAR/LV无统计学意义(P>0.05),且比值均>30%,证明模型建立成功。与假手术组比较,模型组IS/AAR明显升高(P<0.01)。与模型组比较,香青兰高、中剂量组均可以显著降低心肌梗塞面积(P<0.01)。丹参滴丸组及mPTP抑制剂环孢素A组心肌梗死面积亦有所下调(表1)。
表1 香青兰总黄酮预处理对大鼠MIRI后心肌及线粒体的保护作用 ±S,n=10Tab.1 Protection of TFDM on myocardia in MIRI rats ±S,n=10
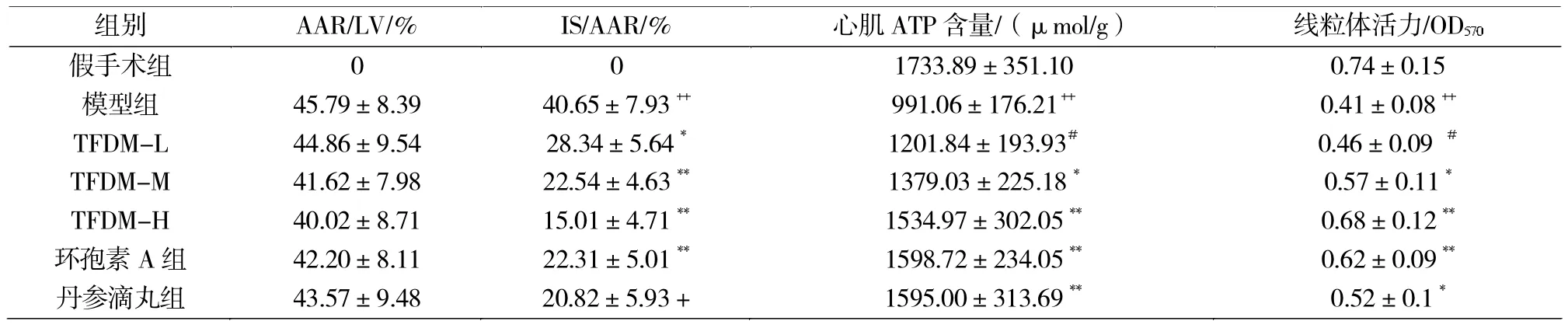
表1 香青兰总黄酮预处理对大鼠MIRI后心肌及线粒体的保护作用 ±S,n=10Tab.1 Protection of TFDM on myocardia in MIRI rats ±S,n=10
注:与假手术组比较,++表示P<0.01;与模型组比较,*表示P<0.05,**表示P<0.01;与环孢素A组相比较,#表示P<0.05。
假手术组 0 01733.89±351.10 0.74±0.15
2.2 TFDM对心肌组织ATP含量的影响
结果见表1,与假手术组相比,模型组心肌组织ATP含量明显下降(P<0.01),说明缺血再灌后线粒体受损,ATP含量降低。与模型组相比,香青兰总黄酮高剂量组、环孢素A组和丹参滴丸组能够明显提高心肌组织ATP含量(P<0.01);与环孢素A组比较,香青兰总黄酮低剂量组具有显著性差异(P<0.05),其保护作用低于环孢素A组,中、高剂量组以及复方丹参滴丸组与环孢素A组比较没有显著性差异,说明三者对心肌组织ATP含量的影响与环孢素A相似。
2.3 TFDM对线粒体微观结构的改变
如图1所示,假手术组(图1a)线粒体外膜光滑,内膜褶皱呈嵴,嵴形状规则,线粒体光密度居中。模型组(图1b)线粒体明显肿胀,嵴突紊乱、断裂或消失,空泡样变甚至溶解至无正常结构。香青兰总黄酮高剂量组(图1e)、环孢素A组(图1f)以及复方丹参滴丸组(图1g)线粒体轻度肿胀,基质基本完整,颗粒部分消失,少部分断裂,较I/R组比线粒体损伤程度明显减轻。香青兰总黄酮低剂组(图1c)超微结构改变与I/R组相似,病变稍轻,中剂量组(图1d)较之低剂量组线粒体形态有所好转(图1 a-g)。
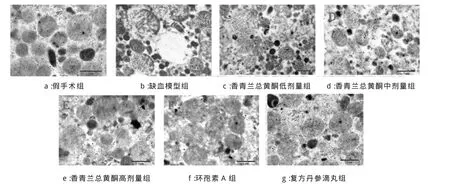
图 1 透射电镜下观察心肌线粒体的结构改变(×20000)Fig.1 Effect of TFDM on ultrastructure of mitochondria(×20000)
2.4 TFDM对线粒体活力的影响
结果见表1、图2,与假手术组相比,模型组线粒体活力明显下降(P<0.01),说明缺血再灌后线粒体受损,活力减低。与模型组相比,香青兰总黄酮中剂量组与丹参滴丸组线粒体活力下降幅度较小(P<0.05),香青兰总黄酮高剂量组和环孢素A组能够明显抑制线粒体活力的降低(P<0.01),起到保护线粒体的作用。各给药组除香青兰总黄酮低剂量组外,与环孢素A组相比没有明显差异。
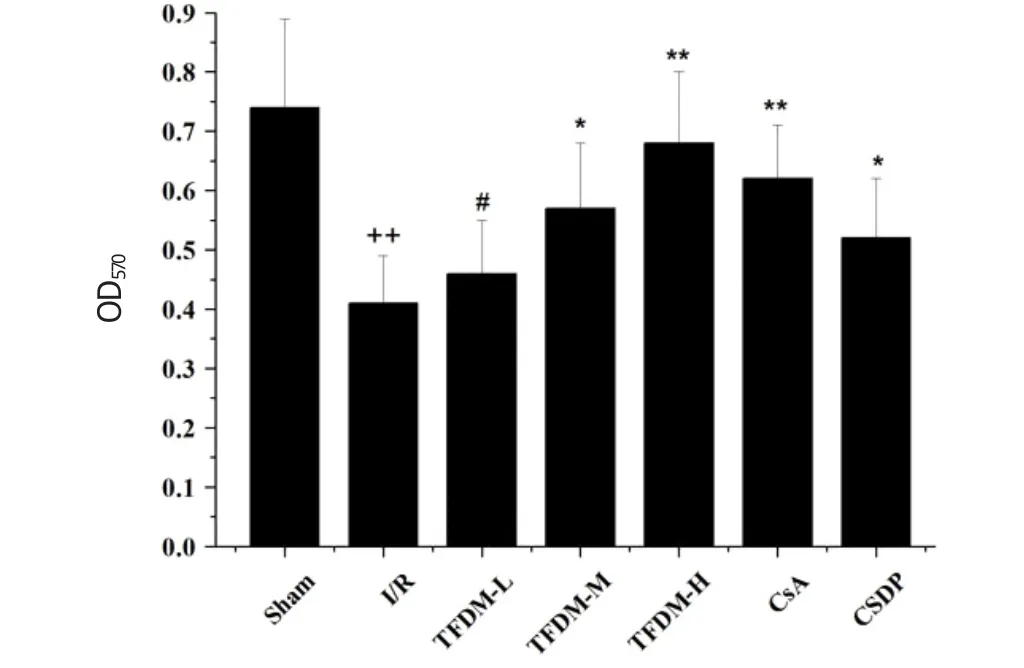
图2 香青兰总黄酮预处理对大鼠线粒体活力的影响(±s,n=10)Fig.2 Effect of TFDM on Activity of mitochondria(±s,n=10)
3 讨论
能量是心肌缺血-再灌注过程中保持心肌细胞结构完整,维持正常功能的重要保障。线粒体功能障碍在心肌缺血-再灌注损伤(MIRI)中占有重要地位。缺血-再灌注时线粒体极易受到损伤,并在整个病理过程中起着中心枢纽作用。环孢素A(CsA)是一种特异性线粒体通透性转换孔(mPTP)的开放抑制剂,大量实验证明[15],再灌注时给予CsA,对缺血再灌过程中的心肌,尤其是线粒体,具有保护作用。故本实验选择了CsA、复方丹参滴丸为阳性药物:通过复方丹参滴丸与香青兰总黄酮和CsA的实验结果对比,证明香青兰总黄酮和CsA对缺血心肌有保护作用;通过线粒体通透性转换孔的抑制剂CsA预处理组,和香青兰总黄酮预处理组的实验结果作对比,证明香青兰总黄酮对缺血心肌的保护作用可能与保护线粒体功能有关,来评价TFDM在线粒体方面对MIRI的保护作用。
再灌注在改善心肌供血的同时又加重了单纯心肌缺血所造成的损伤,可致心肌梗死的出现。本实验结果表明,与模型组比较,TFDM组能显著降低梗死面积百分比,有效的保障心脏功能的恢复。CsA预处理组与复方丹参滴丸组对缺血心肌的保护作用相当,验证了CsA的心肌保护作用。众所周知,线粒体是产生ATP的主要场所[16],但在缺氧缺血等病理状态下线粒体氧化磷酸化受损,ATP合成不足,能量代谢发生障碍,导致心肌组织损害。为了评估线粒体产生ATP的能力,本研究检测了各组大鼠在缺血/再灌注后心肌组织中ATP的含量。实验结果显示,香青兰总黄酮各剂量组能在一定程度上抑制心肌组织ATP含量的降低,说明香青兰总黄酮可以缓解急性心肌缺血/再灌注损伤所造成的能量供应障碍。CsA预处理可以提高心肌组织中的ATP含量,香青兰总黄酮中、高剂量组与环孢素A组作用相当,提示香青兰黄酮对心肌缺血/再灌注损伤的保护作用与线粒体保护相关。
我们利用超薄切片技术,对香青兰总黄酮预处理后的MIRI大鼠线粒体的超微结构进行深入的研究。与假手术组比较,模型组线粒体的结构发生了明显的病变,表明心肌缺血再灌注后线粒体受损,其正常的生理功能严重退化。与模型组比较,复方丹参滴丸组以及CsA组线粒体的形态结构改变不大,可以维持正常的生理功能,其中CsA组对线粒体的保护作用优于复方丹参滴丸组,证实了CsA的线粒体保护作用。香青兰总黄酮高、中剂量对线粒体有明显的保护作用。与CsA组比较,香青兰总黄酮高剂量组、复方丹参滴丸组对线粒体的保护作用与其大致相似。表明TFDM在MIRI过程中对线粒体有一定的保护作用。
目前常用 MTT法检测细胞的活性,代表线粒体中琥珀酸脱氢酶活性,反应细胞线粒体活力。由实验结果可知,缺血再灌后线粒体受损,经TFDM预处理的组别线粒体受损程度均有所改善,表明TFDM对线粒体起到了一定的保护作用。与环孢素A组相比,香青兰黄酮中、高剂量组和复方丹参滴丸组没有显著性差异,提示香青兰黄酮可以很好的提高线粒体的活性,维持线粒体正常的生理功能。
综上所述,TFDM不仅能够明显减轻大鼠心肌梗死程度,提高心肌ATP含量,还能有效保护线粒体活性以及结构的完整性。TFDM各剂量组与CsA组和复方丹参滴丸组相比,除低剂量组外,没有统计学差异,说明TFDM对MIRI具有线粒体保护作用,这可能是TFDM防治MIRI的作用机制之一。
[1]Benito Morentin,Covadonga Audicana.Population-Based Study of outofhospital sudden cardio vascular death:incidence and causes of death in middle-aged Adults[J].Revista Espa ola de Cardiología(English Edition),2011,64(1):28-34.
[2]Robert Wagner,Pavel Piler,Zufar Gabbasov,et al.Adjuvant cardioprotection in cardiac surgery:update[J].BioMed Research International,2014,30(2):7-12.
[3]Mohammad Badavi,Najmeh Sadeghi,Mahin Dianat,et al.Effects of gallic acid and cyclosporine on antioxidant capacity and cardiac markers of at isolated heart after ischemia/reperfusion[J].Iran Red Crescent Med J,2014,16(6):16424.
[4]Vivek Sivaraman,Derek M.Yellon.Pharmacologic therapy that simulates conditioning for cardiac ischemic/reperfusion injury[J].Journal of Cardiovascular Pharmacology and Therapeutics,2014,19(1):83-96.
[5]Charles Steenbergen,Samarjit Das,Jason Su,et al.Cardioprotection and altered mitochondrial transport[J].Basic Res Cardiol,2009,104(2):149-156.
[6]Veres G,Radovits T,Szabo G,et al.Effects of inosine on reperfusion injury after cardio-pulmonary by pass[J].J Cardiothorac Surg,2010,7(5):106.
[7]Ong S B,Subrayan S,Lim S Y,et al.Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury[J].Circulation,2010,121(18):12-22.
[8] 袁勇,邢建国,张永军.高效液相色谱法测定香青兰提取物中田蓟苷的含量[J].中国实验方剂学杂志,2010,16(13):68-69.Yuan Y,Xing J G,Zhang Y J.Determination of tilianin from extract of dracocephalum moldavica L.leaves by HPLC[J].Chinese Journal of Experimental Treditional Medical Formulae,2010,16(13):68-69.
[9] 王盛,姚佳茗,郭新红,等.香青兰总黄酮抗心肌细胞缺氧/复氧损伤作用的研究[J].石河子大学学报:自然科学版,2014,32(5):568-572.Wang S,Yao J M,Guo X H,et al.Protective effects of dracocephalum moldavica L.flavones on cultured cardiomyocytes in Vitro Hypoxi/Reoxygenation[J].Journal of Shihezi University:Natural Science,2014,32(5):568-572.
[10]曹文疆,邢建国,王新春,等.香青兰总黄酮对TNF-α诱导的大鼠血管平滑肌细胞增殖的影响[J].中国实验方剂学杂志,2011,17(21):159-161.Cao W J,Xing J G,Wang X C,et al.Inhibitory effects of dracocephalum total flavones on proliferation of rat vascular smooth muscle cells induced by TNF-α[J].Chinese Journal of Experimental Treditional Medical Formulae,2011,17(21):159-161.
[11]宋睿,金传山,周亚伟.维药香青兰的研究进展[J].安徽医药,2010,14(3):344-346.Song R,Jin C S,Zhou Y W.Reaserch progress of uighur medicine of dracocephalum moldovia L.[J].Anhui Meddical and Pharmaceutical Journal,2010,14(3):344-346.
[12]袁勇,邢建国,王立萍,等.香青兰总黄酮在大鼠体内的药代动力学研究[J].石河子大学学报:自然科学版,2014,32(1):69-72.Yuan Y,Xing J G,Wang L P,et al.Study on the pharmacokinetic behavior of dracocephalum moldavica L.flavonoids in rat[J].Journal of Shihezi University:Natural Science,2014,32(1):69-72.
[13]樊鑫梅,曹文疆,邢建国,等.香青兰总黄酮对大鼠心肌缺血再灌注损伤保护作用的研究[J].中成药,2013,35(8):1625-1630.Fan X M,Cao W J,Xing JG,et al.Protective effect of total flavones from dracocephalum moldavica against myocardial ischemia-reperfusion injury in rats[J].Chinese Traditional Patent Medicine,2013,35(8):1625-1630.
[14]范礼理,滕健,张润东,等.羟苯氨酮保护大鼠心脏对抗心肌缺血-再灌注损伤[J].药学学报,2005,40(6):507-512.Fan L L,Teng J,Zhang R D,et al.Protection of oxyphenamone onmyocardium against ischem iareperfusion injury in rat heart ischem ia-reperfusion injury in rat heart[J].Acta Pharmaceutica Sinica,2005,40(6):507-512.
[15]Xie J R,Xu L N.Cardioprotective effects of cyclosporine in an in vivo model of myocardial ischemia and reperfusion[J].Acta Anaesthesiol Scand,2007,51:909-913.
[16]钟丽华,曹雪,张翔,等.心肌能量调控在缺血性心脏病治疗中的前景[J].黑龙江医学,2015,39(1):101-102.Zhong L H,Cao X,Zhang X,et al.Modulation of cardiac energetic in the treatment of ischemic heart disease[J].Heilongjiang Medical Journai,2015,39(1):101-102.
