骨髓基质细胞HS-5对HL-60细胞凋亡的影响
2015-12-25杨红霞孟腾腾管东方吴广胜农卫霞魏虹
杨红霞 ,孟腾腾 ,管东方 ,吴广胜 ,农卫霞 ,魏虹
(1石河子大学医学院组织胚胎学教研室,石河子 832002;2石河子大学医学院第一附属医院血液风湿科,石河子 832002)
白血病是起源于造血系统的恶性肿瘤,不仅有造血细胞的恶变,骨髓造血微环境也出现了异常。骨髓基质细胞 (bone marrow stromal cells,BMSCs)是造血微环境的主要成分,通过分泌细胞因子和直接粘附,对正常造血具有调控作用,它也是支持和调节造血干细胞定居、增殖、分化、发育和成熟的内环境[1]。近年来随着对白血病研究的不断深入,发现骨髓基质细胞在白血病细胞恶性克隆的选择、增殖、分化、迁移和凋亡中起重要作用[2]。目前对白血病的体外研究多来模拟体内微环境,本研究以人骨髓基质细胞系HS-5(Human stranal Cell-5)与急性髓系白血病(acute myeloid leukemia,AML)(M3)细胞系 HL-60共培养来模拟体内造血微环境,初步探讨基质细胞对白血病细胞凋亡的影响,为进一步研究奠定基础。
1 材料与方法
1.1 材料与主要试剂
HS-5购买于上海拜力生物科技有限公司;HL-60购买于上海科柏生物科技有限公司;高糖DMEM培养液、胎牛血清购买于Hyclone公司;PBS平衡缓冲液购买于上海生工公司;二甲基亚酚(DMSO)购买于美国Sigma公司;胰酶、双抗购买于Solarbio公司;AnnexinV-FITC/PI购买于上海贝博公司;RNA提取试剂(Trizol)、逆转录体系、PCR体系购买于美国 Invitrogen公司;Bcl-2、Bcl-xl引物由上海生物工程股份有限公司合成。
1.2 方法
1.2.1 HS-5、HL-60细胞培养
HS-5细胞采用高糖DMEM培养液加10%的胎牛血清,置于37℃ 5%CO2饱和湿度的培养箱中进行培养,2 d换液一次,当细胞生长密度>80%时(4-5 d)用胰酶消化传代。HL-60细胞采用RPMI-1640培养液加10%的胎牛血清,置于37℃5%CO2饱和湿度的培养箱中进行培养,每2 d用新的完全培养液稀释培养,7 d全量换液。
1.2.2 共培养体系的建立
当HS-5细胞达80%-90%融合时用PBS冲洗以去除死细胞,用0.25%的胰蛋白酶(含0.02%EDTA)消化,计数后按1×105/mL的密度,每孔 2 mL接种于6孔板,培养24 h,大多数基质细胞贴壁、舒展形成单层。此时去除悬浮未贴壁细胞,按1×106/mL密度2 mL接种对数生长期的HL-60细胞于HS-5细胞层上,共培养 24、48、72 h,同时设单独悬浮培养的HL-60细胞为对照组。本实验每个时间点实验组与对照组各设三孔。
1.2.3 AnnexinV-FITC/PI双染流式细胞术检测实验组与对照组HL-60细胞的早期凋亡率
把培养板孔中HL-60细胞轻吹后转入10 mL离心管中(共培养组中粘附的 HL-60细胞每视野大于10个时,用 PBS冲洗轻微吹打后细胞悬液转入离心管)离心,1000 r/min,5 min,倾去上清,用预冷的PBS 5 mL洗涤细胞,1000 r/min,5 min两次,吸弃上清,按试剂盒说明,用1×AnnexinV结合缓冲液400μL重悬细胞,加入AnnexinV-FITC 5μL染色液轻轻混匀后于4℃避光条件下孵育15 min;加入10μL PI染液轻轻混匀后于4℃避光条件下孵育 10 min,2 h内用流式细胞仪进行检测。Annexin V+PI-判断为早期凋亡细胞。
1.2.4 瑞氏染色HL-60细胞
收集实验组与对照组的 HL-60细胞转入10 mL离心管(共培养组中粘附的 HL-60细胞每视野大于10个时,用 PBS冲洗轻微吹打后细胞悬液转入离心管)离心,1000 r/min,5 min,用枪吸去上清。加 PBS 5 mL混悬后离心1000 r/min,5 min,吸弃上清,用1 mL PBS稀释细胞沉淀,吹匀,吸10μL的细胞悬液滴在已擦拭干净的载玻片上,用另一载玻片将细胞液滴推片为薄薄的一层,静置,干燥后再滴加1 mL的瑞氏染液,摇晃使其全部覆盖细胞涂层,染色5 min,加1 mL的 PBS稀释染液,再染5 min,见细胞涂片干燥后用自来水细流缓慢漂洗,去除多余的染料,而后等待涂片干燥后镜下观察细胞形态变化。
1.2.5 RT-PCR检测实验组与对照组HL-60细胞Bcl-2和Bcl-xl的表达
RT-PCR法检测实验组与对照组48 h的HL-60细胞 Bcl-2、Bcl-xl和 GAPDH的表达。按照 Trizol试剂盒说明书提取总RNA,将mRNA逆转录为cDNA,逆转录产物进行Bcl-2、Bcl-xl及内参GAPDH基因扩增,扩增条件见(表1)。扩增产物经2%琼脂糖凝胶电泳后凝胶成像系统拍照,照片用Image J进行 mRNA表达分析和灰度扫描。

表1 RT-PCR基因信息汇总Tab.1 Summary of gene inform ation for RT-PCR
1.2.6 统计学处理
所有数据用 SPSS17.0统计软件包进行分析,实验数据以均数±标准差(X±S)表示,两组间均数采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 HS-5细胞与HL-60细胞共培养
HS-5细胞接种24 h后接种HL-60细胞,刚接种时 HS-5贴壁,HL-60细胞悬浮(图 1a),经过 48 h的共培养,见一个HS-5细胞上有一个或数个HL-60细胞粘附,主要集中在HS-5细胞的胞体部位,同时也有HL-60细胞嵌入了HS-5细胞之间,HS-5细胞也变得残缺(图1b)。

图1 HL-60细胞与HS-5细胞共培养Fig.1 Co-culture of HS-5 cells and HL-60 cells
2.2 AnnexinV-FITC/PI双染流式细胞术检测实验组与对照组HL-60细胞的早期凋亡率
AnnexinV-FITC/PI双染流式细胞术检测HL-60细胞的早期凋亡率,在24、48、72 h实验组与对照组各三管的检测结果如图2所示。
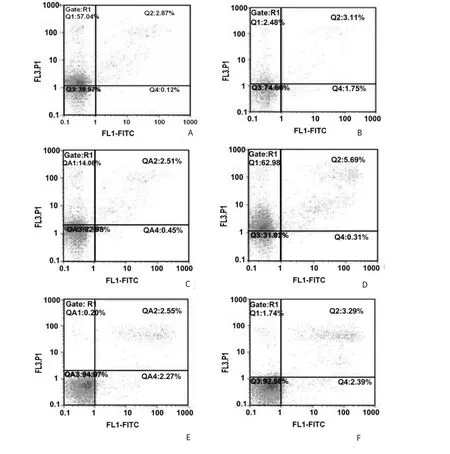
图2 流式细胞术检测实验组与对照组HL-60细胞的早期凋亡率Fig.2 Detect the early apoptosis rates of experiment and control groups of HL-60 cells by flow cytometry
增殖减少,认为基质细胞保护白血病细胞存活仅由抑制凋亡实现,归因于MS-5(mouse stromal cell-5)不分泌 IL-6[14],而 HS-5分泌 IL-6,IL-6可促进造血细胞的增殖,也可增强HS-5的增殖。这与本实验中HS-5对HL-60有抑制凋亡的作用结果一致。
原代AML细胞在体外有很高的自发凋亡率,似乎是通过PI3K/AKT信号通路介导并导致抗凋亡基因bcl-2表达的上调[15]。bcl-2基因的表达在共培养3d后比对照组凋亡减少,基质细胞可抑制白血病细胞的自发凋亡[16]。Van Stijn A等[17]的研究显示CD34+AML较CD34-AML对凋亡更耐受,此时耐受细胞bcl-2、bcl-xl表达增高、bax表达降低,与本实验结果一致,即基质细胞保护白血病细胞凋亡的同时有bcl-2、bcl-xl基因的表达上调。
既往体外研究基质细胞对白血病细胞的作用都涉及接触与非接触培养及细胞因子的作用,接触培养较单独培养的白血病细胞凋亡减少,但共培养时培养瓶内细胞比例、细胞生长快慢及培养环境随时间的变化都与人体内存在着差异,白血病细胞是否会在体内与基质细胞接触更紧密从而使白血病细胞凋亡更少,接触后基质细胞与白血病细胞分泌的细胞因子可能都会有一定变化,最终导致白血病细胞凋亡减少的确切机制还有待进一步研究。
[1]Gordon M Y,Lewis J L,Marley S B,et a1.Stromal cells negatively regulate primitive hematopoietic progenitor cell activation via a phosphatidylinositol-anchored cell adhesion signaling mechanism[J].Br J Haematol,1997,96(3):647-653.
[2]Cernáková M,Kostálová D.Anti-microbial activity of berberine-a constituent of mahonia aquifolium[J].Folia Microbiol(Praha),2002,47(4):375-378.
[3]Asosingh K,Günthert U,Bakkus M H,et al.In vivo induction of insulinlike growth factor-1 receptor and CD44v6 confers homing and adhesion to murine multiple myeloma cells[J].Cancer Res,2000,60(11):3096-3014.
[4]Shimakura Y,Kawada H,Ando K,et al.Murine stromal cell line HESS-5 maintains reconstituting ability of exvivo generated hematopoietic stem cells from human bone marrow and cytokinemobilized peripheral blood[J].Stem Cell,2000,18(3):183-189.
[5]Gibson L F.Survival of B lineage leukemic cells:signals from the bone marrow microenvironment[J].Leuk Lymphoma,2002,43(2):19-27.
[6]Granziero L,Circosta P,Scielzo C,et al.CD100/plexin BI interactions sustain proliferation and survival of normal and leukemiaCD5+B lymphocyte[J].Blood,2003,101(5):1962-1969.
[7]Matsunaga T,Takemoto N,Sato T,et al.Interaction between leukemic cell VLA-4 and stromal fibronectin is a decisive factor for minimal residual disease of acute myelogenous leukemia[J].Nat Med,2003,9(9):1158-1165.
[8]ParaguassúBraga F H,Borojevic R,Bouzas L F,et al.Bone marrow stroma inhibit proliferation and apoptosis in leukemic cells through gap junction mediated cell communication[J].Cell Death Differ,2003,10(9):1101-1108.
[9]Ramasamy R,Lam E W,Soeiro I,et al.Mesenchymal stem cell inhibits proliferation and apoptosis of tumor cells:impact on in vivo tumor growth[J].Leukemia,2007,21(2):304-310.
[10]Lin Y M,Bu L M,Yang S J,et al.Influence of human Mesenchymal stem cells on cell proliferation and chemosensitivity of K562 cells[J].J Exp Haematol,2006,14(2):308-312.
[11]邓均,蒲晓允,张春雷,等,K562细胞影响BMSCs生长及MIP21a表达的实验研究[J].第三军医大学学报,2004,26(19):17202-17722.Deng J,Pu X Y,Zheng C L,et al.The research of the effect of K562 to BMSC s and the expression of MIP21a[J].Acta Academia Medicine Militaries Tertian,2004,26(19):17202-17722.
[12]Bijan Moshaver,Marjolein A,Van Der Pol,et al Chemotherapeutic treatment of bone marrow stromal cells strongly affects their protective effect on acute myeloid leukemia cell survival[J].Leukemia Lymphoma,2008,49(1):134-148.
[13]Konopleva M,Konoplev S,Hu W,et al.Stromal cells prevent apoptosis of AML cells by upregulation of antiapoptotic proteins[J].Leukemia,2002,16(9):1713-1724.
[14]Keller U,Gotze K S,Duyster J,et al.Murine stromal cells producing hyper-interleukin-6 and Flt3 ligand support expansion of early human hematopoietic progenitor cells without need of exogenous growth factors[J].Leukemia,2002,16(10):2122-2128.
[15]Hunter A E,Rogers S Y,Roberts I A,et al.Autonomous growth of blast cells is associated with reduced survival in acute myeloblastic leukemia[J].Blood,1993,82(3):899-903.
[16]Ryningen A,Wergeland L,Glenjen N,et al.In vitro crosstalk between fibroblasts and native human acute myelogenous leukemia(AML)blasts via local cytokine networks results in increased proliferation and decreased apoptosis of AML cells as well as increased levels of proangiogenic interleukin 8[J].Leuk Res,2005,29(2):185-196.
[17]Van Stijn A,Van der Pol M A,Kok A,et al.Differences between the CD34+and CD34-blast compartments in apoptosis resistance in acute myeloid leukemia[J].Haematologica,2003,88(5):497-508.
