miR-18a在老年胃癌患者血清中的表达及意义
2015-12-25汤光华,张英志
miR-18a在老年胃癌患者血清中的表达及意义
汤光华张英志
(嘉兴市第一医院消化科,浙江嘉兴314000)
摘要〔〕目的探讨胃癌患者血清microRNA-18a表达变化及其临床诊断意义。方法采用实时荧光定量PCR检测52例老年胃癌患者和33例健康体检者血清miR-18a表达水平。通过分析受试者工作特征曲线(ROC)判断miR-18a表达水平在胃癌诊断中的灵敏度和特异度。酶联免疫吸附实验(ELISA)检测患者血清肿瘤标记物水平。结果胃癌患者血清miR-18a较健康对照组高(P<0.05)。血清miR-18a水平与患者年龄、性别无关(P>0.05),与分化程度、临床分期、浸润深度和淋巴结转移明显相关(P<0.05或P<0.01)。ROC分析结果显示最佳的miR-18a相对表达量的临界值为2.77,诊断灵敏度77.2%,特异度82.8%,ROC曲线下面积为0.791。血清miR-18a 水平与胃癌相关抗原MG7-Ag明显正相关,与糖抗原(CA)-72-4、CA-50和甲胎蛋白(AFP)正相关,与癌胚抗原(CEA)无明显相关性。结论miR-18a在胃癌患者血清中水平升高,作为新的血清学指标在胃癌筛查诊断中有重要参考价值。
关键词〔〕胃癌;miR-18a;实时荧光定量PCR;诊断
中图分类号〔〕R735〔文献标识码〕A〔
第一作者:汤光华(1975-),男,主治医师,主要从事老年性疾病血清标志物检测及辅助诊断研究。
微小RNA(miRNA)参与了人类基因组中约1/3基因的表达调控,广泛参与细胞的生物学过程,包括细胞生长、分化、凋亡甚至肿瘤的发生、发展及转移过程,特异性的miRNA发挥着重要的作用〔1〕。在血液中检出肿瘤特异性miRNA并将其作为肿瘤生物学标志对于肿瘤早期诊断及预后判断具有重要意义〔2〕。在胃癌(GC)组织中具有特异性的miRNA表达谱〔3〕,其中miR-18a特异性高表达〔4〕。本研究通过检测GC患者血清miR-18a水平变化,探讨其临床诊断意义。
1资料与方法
1.1研究对象选择2010年1月至2013年12月本院经手术病理证实的老年GC患者52例,收集患者确诊时采集的血清样本,其中男33例,女19例,年龄62~79〔平均(68±8.2)〕岁。采用2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分期标准分期,Ⅰ期12例,Ⅱ期26例,Ⅲ期8例,Ⅳ期6例。所有患者排除其他肿瘤或病毒感染疾病,入组患者在采集血液标本前均未经手术、放疗以及化疗。同期33例健康体检者作为正常对照组。两组年龄、性别比较无统计学差异,具有可比性(P>0.05)。在采集样本前均获得患者或家属的知情同意。
1.2主要试剂和仪器RNA提取试剂盒TRIZOL Reagent,美国Invitrogen公司;反转录试剂盒iScriptcDNA synthesis kit以及实时荧光定量PCR试剂盒iQTMSYBR®Green Supermix,美国Bio-Rad公司;运用Primer Premier 5.0软件设计miRNA-18a和U6的特异性引物,miRNA-18a正义引物:5′TGTCGGGTAGCTTATCAGAC3′,反义引物:5′TTCAGACAGCCCATCGACTG3′;U6正义引物:5′CTCGCTTCGGCAGCACATATACT 3′,反义引物:5′ ACGCTTCACGAATTTGCGTGTC 3′,均由上海生工生物工程有限公司合成。在Bio-Rad iQ5定量PCR仪器上进行反应。紫外分光光度计NanoDrop ND-1000(NanoDrop,Wilmington,美国)。
1.3方法
1.3.1血清标本采集及总RNA提取收集清晨空腹外周血5 ml,室温静置30 min后取1.0 ml上清液,4℃、820 r/min离心10 min;取上层血清至新的离心管中,4℃、16 000 r/min离心10 min,取上清液到新的离心管中,置于-80℃冰箱中保存备用。样本血清总RNA提取方法完全按照RNA提取试剂盒TRIZOL Reagent的操作说明进行。总RNA浓度和纯度利用紫外分光光度计NanoDrop ND-1000进行测定。总RNA提取的质量利用1%变性琼脂糖凝胶电泳进行分析。获得的符合浓度和质量要求的RNA溶液保存于-80℃备用。
1.3.2miRNA逆转录和荧光定量PCR检测血清miR-18a表达量按照反转录试剂盒说明书将1 μg 总RNA反转录为cDNA,主要反应条件:25℃ 5 min,42℃ 30 min,85℃ 5 min。以合成的cDNA为模板,按照荧光定量PCR试剂盒说明书进行实时荧光定量PCR。第1步,95℃预热3 min;第2步,95℃ 30 s、56℃ 30 s、72℃ 30 s,共40个循环。熔解曲线分析0.5℃/0.5 min:55℃~95℃。同时以U6小核RNA(snRNA)管家基因作为内参照。结果在Bio-Rad荧光定量PCR-iQ5软件进行分析。每个miRNA的相对表达量用2-△△Ct表示,ΔΔCt=(CtHCC-miR18a-CtHCC-U6)-(CtNC-miR18a-CtNC-U6)。每个样本重复3次试验。
1.3.3肿瘤标记物的检测采用酶联免疫吸附实验(ELISA)检测患者血清GC抗原(MG7-Ag),糖抗原(CA)-72-4、CA-50、癌胚抗原(CEA)、甲胎蛋白(AFP)的水平。
1.4统计学方法应用SPSS16.0软件进行t检验。通过受试者工作特征曲线(ROC)判断miRNA-18a表达水平在GC诊断中的灵敏度和特异度。
2结果
2.1血清miR-18a在GC患者及正常组织中的表达miR-18a在GC患者血清内的相对水平是健康对照组的(2.57±0.46)倍(P<0.05)。
2.2血清miR-18a水平与临床病理参数的关系血清miR-18a水平与患者年龄、性别无关(P>0.05),与分化程度、临床分期、浸润深度和淋巴结转移明显相关(P<0.05或P<0.01)。见表1。
2.3血清miR-18a 水平对GC的诊断价值ROC曲线下面积(AUC)为0.791(95%CI0.715~0.901)。见图1。根据ROC分析,最佳的miR-18a相对表达量的临界值为2.77,诊断灵敏度76.9%,特异度82.6%。
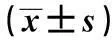
表1 血清miR-18a水平与临床病理参数的关系

图1 血清miR-18a诊断胃癌的ROC
2.4血清miR-18a 水平与肿瘤标记物在GC中相关性分析血清miR-18a 水平与GC相关抗原MG7-Ag明显正相关(r=0.787,P=0.008),与CA-72-4、CA-50和AFP正相关(分别r为0.335、0.216、0.431,均P<0.05),与CEA无明显相关性(r=0.052,P=0.134)。
3讨论
miRNA通过与mRNA 3′端非翻译区互补结合,诱导mRNA断裂,抑制翻译过程,或者通过miRNA脱腺苷作用介导mRNA降解,在转录后水平调节基因表达〔5〕。由于miRNA序列、结构、丰度和表达方式的多样性,决定了其在人类肿瘤信号通路中所起到的重要作用,参与肿瘤的发生、发展以及预后〔6〕。
目前多项研究发现,不同肿瘤组织中有其特异性的miRNA表达谱〔7~9〕;但组织中miRNA检测的取材需要经过手术或者穿刺,对筛查、监测和诊断有一定的不便之处,对老年患者尤其不便。目前有研究表明〔2〕,miRNA在血清和血浆中也可能有稳定的表达,血清或血浆放置在常温或在强酸强碱环境中以及反复冰冻及融解样本不影响miRNA的稳定性;血浆中miRNA耐核糖核酸酶,非常稳定,并且血浆和血清中的样本检测有很好的相关性,都很适合作为血液基础的标记物。肿瘤患者某些外周血miRNA升高的原因可能是在肿瘤组织中超表达的miRNA以一定的方式释放入外周血中,具有肿瘤特异性,有可能作为一种新型的特异性肿瘤标志物〔10,11〕。
本研究结果提示血清miR-18a可能是GC的一个重要血清指标,对早期无症状GC的诊断有一定指示作用。并且miR-18a可能在GC的进展中起到重要作用,其水平变化可以作为肿瘤进展的观测指标,对GC的筛查和早期诊断有一定的参考意义。通过分析ROC及血清miR-18a 水平与肿瘤标记物在GC中的相关性进一步证明,血清miR-18a可能是GC的一个重要血清指标,对早期无症状GC的诊断有一定指示作用。
4参考文献
1Lin Y,Zeng Y,Zhang F,etal.Characterization of microRNA expression profiles and the discovery of novel microRNAs involved in cancer during human embryonic development〔J〕.PLoS One,2013;8(8):e69230.
2Chen X,Ba Y,Ma L,etal.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases〔J〕.Cell Res,2008;18(10):997-1006.
3Wang JL,Hu Y,Kong X,etal.Candidate microRNA biomarkers in human gastric cancer:a systematic review and validation study〔J〕.PLoS One.2013;8(9):e73683.
4Tsujiura M,Komatsu S,Ichikawa D,etal.Circulating miR-18a in plasma contributes to cancer detection and monitoring in patients with gastric cancer〔J〕.GastricCancer,2014.〔Epub ahead of print〕
5俞焙秦,刘炳亚.miRNA的生物学特性和功能〔J〕.上海交通大学学报:医学版,2007;27(5):621-3.
6Ishiguro H,Kimura M,Takeyama H.Role of microRNAs in gastric cancer〔J〕.World J Gastroenterol,2014;20(19):5694-9.
7Ma SY1,Bai Y,Han N,etal.Recent research progress of biogenesis and functions of miRNA〔J〕.Yi Chuan,2012;34(4):383-8.
8Tong F,Cao P,Yin Y,etal.MicroRNAs in gastric cancer:from bench top to bedside〔J〕.Dig Dis Sci,2014;59(1):24-30.
9Lu J,Getz G,Miska EA,etal.MicroRNA expression profiles classify human cancers〔J〕.Nature,2005;435(7043):834-8.
10Wang J,Zhang KY,Liu SM,etal.Tumor-associated circulating microRNAs as biomarkers of cancer〔J〕.Molecules,2014;19(2):1912-38.
11Zheng Y,Li S,Ding Y,etal.The role of miR-18a in gastric cancer angiogenesis〔J〕.Hepatogastroenterology,2013;60(127):1809-13.
〔2014-05-16修回〕
(编辑袁左鸣)
