东海岛北寮高位虾池养殖过程细菌数量变化及其对抗生素的耐药性
2015-12-24贺艳艳张瑜斌
李 琴,贺艳艳,张瑜斌
(广东海洋大学海洋资源与环境监测中心,广东湛江524088)
东海岛北寮高位虾池养殖过程细菌数量变化及其对抗生素的耐药性
李 琴,贺艳艳,张瑜斌
(广东海洋大学海洋资源与环境监测中心,广东湛江524088)
采用平板计数法研究了湛江东海岛北寮村3个高位虾池养殖过程水体和沉积物的可培养细菌与弧菌(Vibrio)的数量变化,并利用纸片扩散法测定了分离自虾场环境细菌对12种抗生素的耐药性.结果表明,调查的养殖过程中,2个虾池水体细菌与弧菌数量变化呈单峰趋势,9月份达到峰值;虾池沉积物以及水源地中细菌与弧菌数量变化无明显的规律.BL1样池沉积物细菌和弧菌数均与氨氮呈显著正相关(p<0.05),水中的弧菌数与硝酸盐氮呈显著正相关(p<0.05);虾池细菌、弧菌数与多数调查的生态因子之间相关性不显著(p>0.05).虾场环境细菌的抗生素耐药性测定结果显示,分离菌株对12种抗生素的耐药性差异显著(p<0.05),细菌对氨苄青霉素耐药性最高,在对照水源地沉积物中高达80.65%,其次为先锋Ⅴ和甲氧苄胺嘧啶,而对左氟沙星、环丙沙星、多黏菌素B均敏感;样地水体和沉积物细菌对抗生素表现出相似的耐药性谱,两者的细菌耐药性呈显著正相关(p<0.05);养殖虾池与对照水源地的细菌耐药性差异不显著(p>0.05);对照水源地BL4沉积物中细菌耐药性显著高于水体(p<0.05);3个样地细菌对抗生素均表现出较高的多重耐药性(MAR).
虾池;细菌;丰度;抗生素;耐药性
细菌在虾池的物质循环和能量流动中有着重要的作用,一方面有益细菌分解有机质降低虾池有机物负荷,同时为浮游植物提供大量的无机营养;另一方面病源性细菌会引起对虾病害发生.当前,抗菌药物的使用是预防和治疗虾场细菌病害的主要途径之一[1],但抗生素的长期使用会导致环境菌群耐药性的增强[2],反过来又增加了病害的防治难度.对虾高位池养殖是一种高效益和高风险并存的养殖模式[3],为保证该模式的正常运转,一些学者研究了高位虾池养殖过程细菌种群数量的变化及其与环境因子的关系[4-5],细菌群落动态[6]和功能特征[7],为其高效运转提供了相关的理论基础.尽管环境中抗生素耐性基因可通过水平扩散传递给病原细菌,由此增加抗生素防治养殖过程细菌疾病的难度已愈来愈为多数研究者认同[8],但迄今有关虾池细菌对抗生素的耐药性研究多见于养殖病原细菌[9-11],对虾养殖水域和沉积物环境细菌(包括弧菌和气单胞菌)耐药性在国外已有学者开展了研究[12-14],而国内在此方面的研究鲜有报道.本实验利用经典的微生物学方法,研究了湛江东海岛北寮村3个高位虾池和水源地从放苗到收虾的养殖过程水体和沉积物中的细菌数量变化及其环境细菌对常见抗生素的耐药性,结合主要生态因子的调查,以期为对虾高位池养殖生产管理及合理使用抗菌药物防治虾池细菌病害提供科学依据.
1 材料与方法
1.1 研究虾场概况
本研究的虾场位于湛江东海岛北寮村(20° 56.923′N,110°31.527′E)(图1).在该村的养殖虾场中选取3个高位虾池作为研究样池,分别标记为BL1、BL2、BL3,其中BL3为养殖过程发病虾池,3个样池池龄均为5年,池深1.6 m左右,养殖的对虾均为南美白对虾又名凡纳滨对虾(Penaeus vannamei).其中BL1和BL2样池用于调查细菌和弧菌数量及其相关生态因子变化,而BL1和BL3样池用于环境细菌的抗生素耐药性研究.放苗前虾池均按高位虾池养殖要求作消毒、清洗处理[3],养殖期间根据虾池养殖情况适量添加排毒养水宝和漂白粉(含氯≥30%)等药物进行池体消毒.其中BL4为对照研究的虾场水源地(20°56.968′N;110°31.739′E),距离养殖样池大约100 m,即为沙质海滩,也是虾池废水的排放地.
1.2 样品的采集
根据《海洋监测规范》采集水样和沉积物样品[15].水样用HQM-1简易采水器多点采集虾池和水源地表层0.5 m处的水样,分别混匀后装入棕色磨口无菌玻璃瓶贮存;沉积物样用小铲刮擦收集虾池表层1~2 cm处的样品混匀后放入无菌玻璃瓶中贮存,采样器具均作无菌处理.采集好的样品装入放有冰块的泡沫冷藏箱中,立即送回实验室分析.从放苗到收虾共5次采样,采样日期依次为2012年8月8日、8月22日、9月3日、9月16日和9月29日.
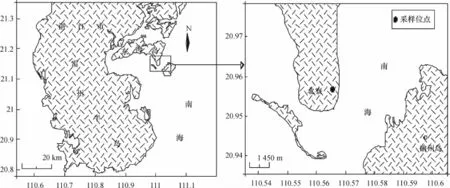
图1 湛江东海岛北寮村的虾场位置Fig.1 Location of shrimp farming at Beiliao village on Donghai island of Zhanjiang
1.3 样品的分析
(1)细菌和弧菌数量的分析 细菌和弧菌数量的测定用10倍稀释涂布平板法[16],每个样品分别选取合适的梯度涂布平板,每个梯度重复3个平板.细菌采用2216E培养基[16],弧菌采用TCBS培养基[16](北京陆桥技术有限责任公司),保持培养基的盐度近似于虾池水体盐度.接种后的平板28℃恒温培养,36 h后计数[16].另外称取20 g左右的沉积物样品105℃烘干,计算含水量和水分系数.细菌和弧菌数量最终结果沉积物以每克干质量的菌落数表示(cfu/g· dw),而水样则以每毫升的菌落数(cfu/mL)表示.
(2)细菌的药敏性分析 从2216E平板中挑取不同形态和颜色的单个细菌菌落转入2216E斜面培养基中纯化培养[16],将纯化后的单菌株冷藏保存,以备药敏实验使用.
本项研究使用的细菌药敏试验方法为美国临床实验室标准化委员会(NCCLS)推荐的纸片扩散法(K-B法)[14],所选用的12种药敏纸片直径均为6 mm,各种纸片的名称与药物含量如下:氨苄青霉素10 μg/片、庆大霉素10 μg/片、红霉素15 μg/片、甲氧苄胺嘧啶(TMP)5 μg/片、左氟沙星5 μg/片、四环素30 μg/片、氯霉素30 μg/片、环丙沙星5 μg/片、复方新诺明1.25/23.75 μg/片,甲氧苄胺嘧啶5 μg/片(复方新诺明为两种物质的复合物)、头孢唑啉(先锋V)30 μg/片、多黏菌素B 30 μg/片、萘啶酸30 μg/片,均在有效期内使用[17].以大肠杆菌(Escherichia coli)ATCC 25922和金黄色葡萄球菌(Staphylococcus aureus)ATCC 29213两个标准菌株进行质量控制.根据NCCLS的药敏实验标准分析细菌对抗生素的敏感性,判定并记录菌株对抗生素的耐药状况,即敏感(S)、中介(I)或耐药(R),细菌的耐药性标记为耐药菌株占所测试菌株的百分率.其中,多重耐药性(multiple antibiotic resistance,MAR)[18]界定为测试的菌株对3种或者3种以上的抗生素同时具有耐药性,n重耐药性表示为MAR(n)(n为自然数且n≥3).药敏实验共随机测试了224株细菌菌株,其中31株分离自BL1水样,37株分离自BL1沉积物样,38株分离自BL3水样,31株分离自BL3沉积物样,33株分离自对照的BL4水样,54株分离自BL4沉积物样.
1.4 主要生态因子测定
为探讨细菌数量变化与主要生态因子的关系,在分析细菌数量变化的同时,也调查了主要的生态因子.根据《海洋监测规范》[15],虾池水样的pH值、温度和盐度分别使用数显pH计、温度计和盐度计现场测定,其他因子在实验室内按照规范方法测定,其中,亚硝酸盐氮测定采用盐酸萘乙二胺比色法,硝酸盐氮测定采用锌镉还原比色法,氨氮测定采用靛酚蓝分光光度法,磷酸盐测定采用磷钼蓝分光光度法,化学需氧量(COD)测定采用碱性高锰酸钾法,叶绿素a(Chl-a)测定采用丙酮萃取分光光度法,溶解性有机碳(DOC)测定采用TOC仪法,溶解氧(DO)采用碘量法,活性硅酸盐采用硅钼蓝法.
1.5 数据统计分析
虾场细菌和弧菌的数量变化与主要生态因子的关系、以及同一样地中水体与沉积物细菌耐药的相关性采用Pearson相关分析,养殖虾池与对照水源地间细菌和弧菌数量差异性、样地中水体和沉积物细菌耐药差异性及环境细菌对抗生素耐药性差异均采用单因子方差分析(ANOVA,Games-Howell),细菌对不同种抗生素的耐药性差异采用多个独立样本非参数检验(K Independent Samples Test),统计过程使用SPSS 16.0软件完成.
2 结果与分析
2.1 虾场细菌和弧菌的数量分布
不同采样时期的养殖虾池及对照水源地水体和沉积物中细菌数量变化结果显示(图2),水中细菌数量波动范围为3.00×103~61.50×103cfu/mL,沉积物中细菌数量波动范围为3.20×104~6 002.30×104cfu/g·dw.其中,养殖虾池BL1和BL2细菌数量变化趋势大体一致,养殖初期细菌数量较少,随着养殖时间延长,出现一个峰值(9月3日),之后细菌数量逐渐减少,但收虾期细菌数量仍多于放养初期细菌数量.水源地(BL4)水中细菌数量相对较小,数量峰值出现于9月29日.沉积物中细菌数量在养殖虾池(BL1、BL2)无明显变化规律,而对照水源地BL4细菌数量波动幅度大,并于9月3日出现一个异常峰值,与同期其他数据相差很大,之后又急剧回落;在第一次采样数据显示虾池中细菌、弧菌数量与水源地水中均差异不显著(ANOVA,p>0.05),最后一次采样中养殖虾池沉积物细菌数量比水源地沉积物数量高2个数量级.
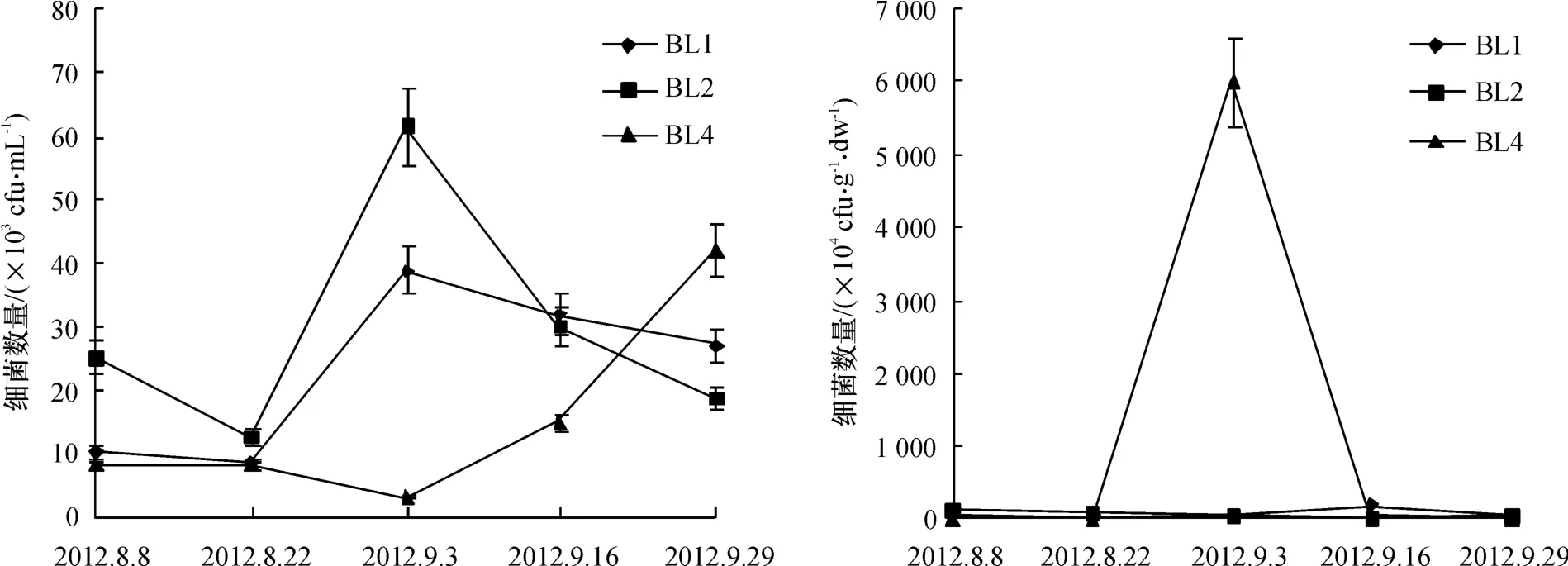
图2 养殖虾场中水(左)和沉积物(右)的细菌数量变化Fig.2 Variations in densities of bacteria in the water(left)and sediment(right)of shrimp farms
从放苗到收虾的整个养殖过程中沉积物和水体弧菌数量动态变化分析结果表明(图3),水中弧菌数量波动范围在0.03×103~16.60×103cfu/mL,沉积物的弧菌数量在0.15×104~78.50×104cfu/g ·dw.养殖初期(8月初),虾池(BL1和BL2)水中弧菌数相对较少,8月中旬,弧菌数量缓慢上升(BL1)或者下降(BL2),随着养殖时间延长,BL1虾池水中的弧菌数量急剧增加,达到峰值,之后迅速回落;而BL2和BL4虾池水中的弧菌数量波动幅度较小.总体看来,收虾时弧菌数量比放苗时弧菌数量多.养殖虾池沉积物中弧菌数量相对稳定,而水源地沉积物中弧菌数量波动幅度大,在9月初出现峰值.与细菌数量动态变化情况相似,同一个虾池沉积物中所含的弧菌数量比水中的弧菌数量高1~2个数量级.
调查结果显示,同一环境基质中的细菌数比弧菌数高1~2个数量级,并且,细菌和弧菌的数量呈现规律性的同步增多或减少.统计分析表明,两个虾池的细菌和弧菌数量与对照水源地水平差异不显著(ANOVA,p>0.05).
2.2 细菌、弧菌数量与主要生态因子的关系
细菌和弧菌与主要生态因子相关分析结果(表1、表2)显示,BL1沉积物细菌和弧菌数均与氨氮呈显著正相关(p<0.05);BL1水中弧菌数与硝酸盐氮呈显著正相关(p<0.05).虾池细菌、弧菌数与多数调查的生态因子之间相关性不显著(p>0.05).
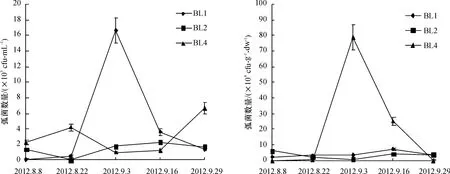
图3 养殖虾场中水(左)和沉积物(右)的弧菌数量变化Fig.3 Variations in densities of vibrio in the water(left)and sediment(right)of shrimp farms

表1 细菌数量与主要生态因子的相关性Table 1 Correlation coefficient between the bacterial densities and selected ecological factors
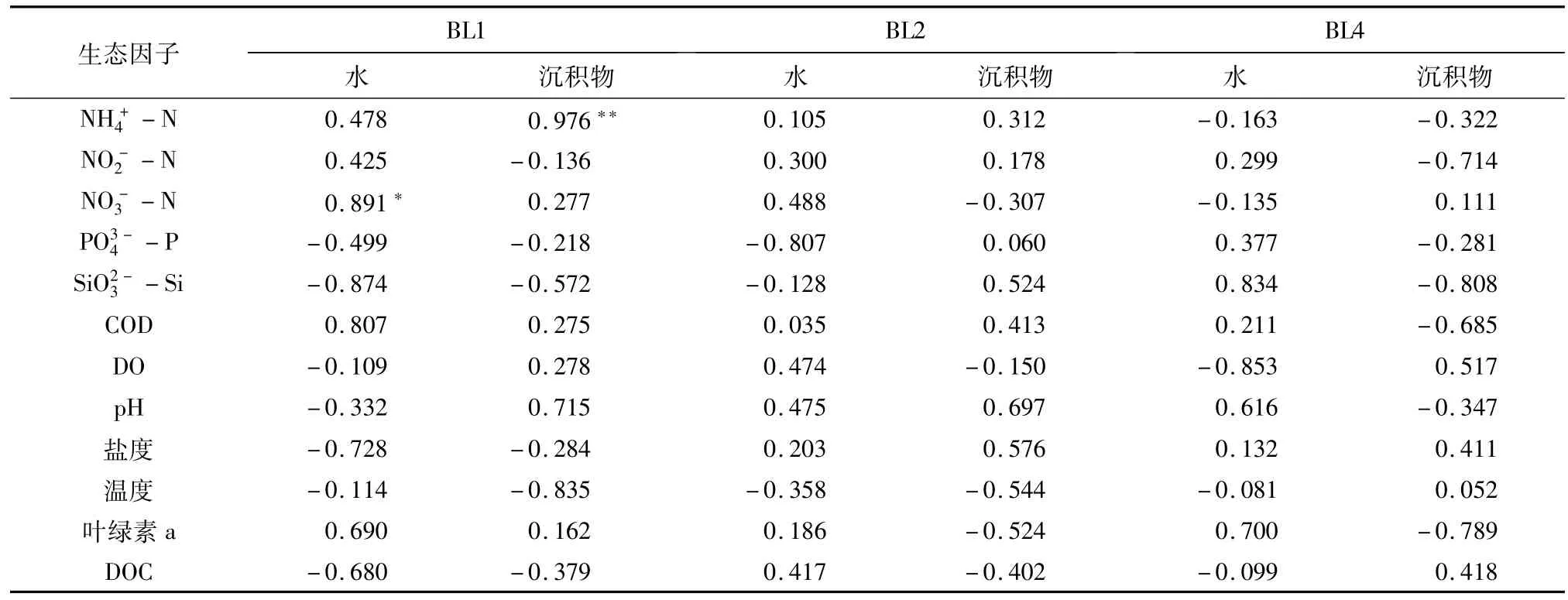
表2 弧菌数量变化与主要生态因子的相关性Table 2 Correlation coefficient between the vibrio densities and selected ecological factors
2.3 细菌的耐药性
虾池水体细菌的药敏实验结果显示(图4),BL1细菌对环丙沙星、多黏菌素B和左氟沙星敏感,对先锋V表现出最大的耐药性(35.48%),其次是甲氧苄胺嘧啶(22.58%),对其他抗生素则表现出不同程度的耐药性.BL3细菌对红霉素、环丙沙星、多黏菌素B、氯霉素、萘啶酸、庆大霉素和左氟沙星7种抗生素敏感,对甲氧苄胺嘧啶、复方新诺明与氨苄青霉素3种抗生素的耐药性均超过30%,对四环素的耐药性近于30%,其中对氨苄青霉素的耐药性最大为48.48%;先锋V的耐药率为9.09%.BL4细菌对红霉素、环丙沙星、多黏菌素B、萘啶酸、庆大霉素、左氟沙星6种抗生素敏感;对氨苄青霉素的耐药性最大,为68.42%,其次是耐性百分率为31.58%的先锋V,而对其余抗生素呈现不同程度的耐药性.
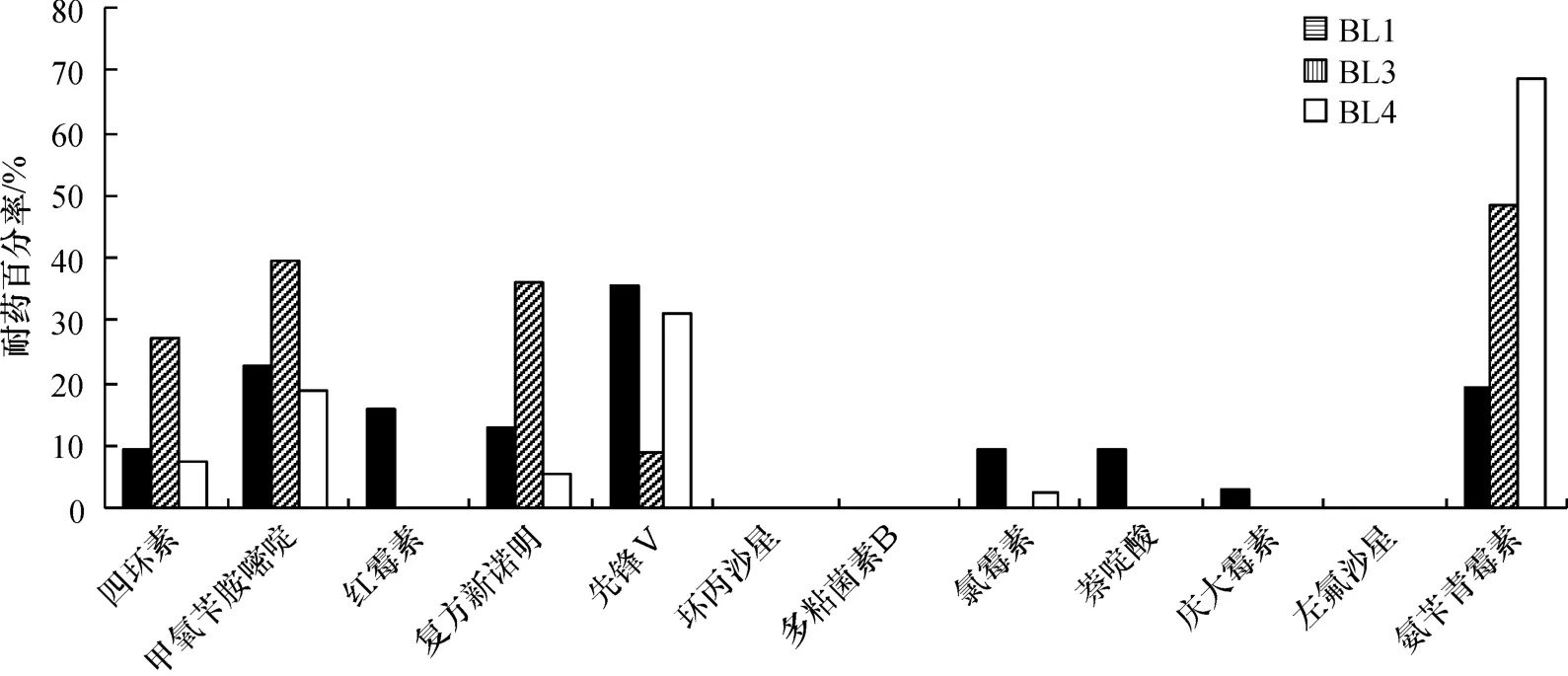
图4 虾场水体细菌对抗生素的耐药性(%)Fig.4 Antibiotic resistance of bacteria isolated from water samples in shrimp farm(%)
虾场沉积物细菌的药敏实验结果显示(图5),BL1细菌耐药性最高的是甲氧苄胺嘧啶(37.84%),随后依次是氨苄青霉素(32.43%)和复方新诺明(27.03%),对红霉素、环丙沙星、多黏菌素B、庆大霉素和左氟沙星敏感,而对四环素、先锋V、氯霉素和萘啶酸则表现出10%左右的耐药性.BL3细菌耐药性最高的同是氨苄青霉素(38.89%),对红霉素、环丙沙星、多黏菌素B、萘啶酸和左氟沙星敏感,对其余6种抗生素的耐药率均不超过20%.和水中细菌的耐药情况相似,细菌对氨苄青霉素的耐药性最高,对红霉素、环丙沙星、多黏菌素B、萘啶酸、庆大霉素、左氟沙星的耐药率最低.对照水源地BL4细菌对氨苄青霉素的耐药性最高,为80.65%,其次分别是先锋V(54.84%)和甲氧苄胺嘧啶(48.39%),对四环素、复方新诺明、氯霉素与萘啶酸表现出不同程度的耐药性,而对红霉素、环丙沙星、多黏菌素B、庆大霉素和左氟沙星则敏感.

图5 虾场沉积物细菌对抗生素的耐药性(%)Fig.5 Antibiotic resistance of bacteria isolated from sediment samples in shrimp farm(%)
样地水体和沉积物细菌对抗生素表现出相似的耐药性谱,但分离的环境细菌对12种抗生素的耐药性差异显著(K Independent Samples Test,p<0.05),细菌对氨苄青霉素、甲氧苄胺嘧啶、先锋V、复方新诺明和四环素的耐药性显著高于其他7种抗生素(p<0.05).在同一虾池中,Pearson相关系分析显示水体细菌耐药性和沉积物间呈显著正相关性(r=0.932,p<0.05).对照水源地BL4沉积物中细菌耐药性显著高于水体(ANOVA,p<0.05).而在不同采样位点中,对照水源地耐药性与养殖虾池中细菌耐药性差异不显著(ANOVA,p>0.05).
细菌对抗生素的多重耐药性分析结果显示(表3),未呈现对8种或8种以上抗生素同时耐药的菌株,耐药种类最多的是BL1沉积物细菌,MAR达到7种,最少的是BL3和BL4水体细菌,MAR为4种.所有测试样品的细菌都存在MAR(3),MAR(4)在大部分样品分离菌株中存在(BL1水例外);MAR(5)同时存在于在BL1水和沉积物细菌中,BL3和BL4沉积物细菌也存在MAR(5);最严重的MAR(7)出现在BL1沉积物细菌中.

表3 养殖虾场中细菌对抗生素的多重耐药性谱(%)Table 3 Profile of percentage of multiple-antibiotic-resistance among bacteria isolated from shrimp farm(%)
3 讨论
放苗初期,调查结果显示虾池与水源地之间的细菌和弧菌数量差异小且弧菌数量偏低.在整个养殖过程中虾池水弧菌数保持在103cfu/mL左右,这与整个养殖过程中未发生虾病的情况相符[19].本项研究虾池水细菌数与弧菌数呈现单峰变化趋势,养殖初期,细菌和弧菌的数量较低,尤其在第一次采样时,池水和水源地中弧菌和细菌数量均差异不显著,这可能是因为与放苗前虾池经过消毒,再引入水源地水有关[19].在养殖期间,由于饵料和虾体排泄物的积累,导致水体中有机质和营养盐的增加[20],使虾池更利于细菌的繁殖生长[21],以致出现了细菌和弧菌数量的高峰期.随后,会有偶尔的急剧下降,这可能与使用排毒养水宝和漂白粉(含氯≥30%)等药物进行消毒有关[19],但总体数量高于养殖初期.调查样池沉积物中的细菌数与水体有相似的变化规律且高于同期水中细菌数量1~2个数量级,这与李秋芬[22]研究结果相似,缘于虾池中细菌数量主要决定于有机物的浓度[23],而在养殖池塘系统中,大量残饵、生物代谢物、生物残体等有机物不断沉积在池底,使得底泥环境更有利于细菌繁殖生长[24],从而导致上述结果的产生.
一些研究发现[4-5],虾池细菌及弧菌的数量与部分理化因子呈显著正相关或负相关性.而本研究结果表明细菌及弧菌数量与多数生态因子之间不存在显著的相关性,这一情况可能与虾池养殖生态系受较大的人为因素影响有关,林克冰等[19]和章洁香等[25]报道了类似的现象.本项研究中,两个虾池的细菌和弧菌数量与对照水源地间的水平差异不显著,与养殖过程中虾池废水直接排放至水源地有关,水源地基质条件的改善直接刺激了细菌和弧菌种群数量的增加,从而可造成其间的水平差异不显著[20-21].
在养殖生产中,抗生素作为生长促进和疾病防治药剂得以广泛使用,致使抗生素在环境中残留,进而诱导细菌耐药性的产生[26],遗传基因控制和生物化学表达是细菌耐药性产生的主要原因[27].本项研究结果显示,样地分离的细菌对12种抗生素的耐药性呈现显著性差异,这与抗生素使用历史和频率、使用剂量和化学结构[2]以及细菌耐药性产生机理[27]有关.各样地环境细菌均对氨苄青霉素表现出较高的耐药性,张瑜斌等[11]和Chelossi等[28]报道了类似的结果,BL1池水体细菌对先锋V的耐药性最高,原因之一可能缘于早期(上世纪80年代至90年代中期)的海水养殖中广泛使用了β-内酰胺类抗生素(包括氨苄青霉素和先锋V),在长期选择压力作用下使细菌产生β-内酰胺酶,使该类抗生素中β-内酰胺环的酰胺键断裂而失去杀菌活性[27];其次,β-内酰胺类抗生素作用的靶位位于细菌细胞壁上,而海水环境中多为革兰氏阴性菌,该类菌细胞壁存在一层外膜,影响β-内酰胺类抗生素的作用效果,进而导致细菌耐受性提高[29].BL1沉积物细菌对甲氧苄胺嘧啶耐药性最高,甲氧苄胺嘧啶属于磺胺类抗生素,磺胺类是合成的抑菌药,通过竞争性抑制叶酸代谢循环中的对氨基苯甲酸而抑制细菌性增殖[2],本研究调查的养殖虾场所位于东海岛,实地调查表明甲氧苄胺嘧啶在岛区的对虾海水养殖中使用频繁,存在着选择性产生细菌耐药性可能性,Kümmerer认为,水生环境一些抗生素的长期使用极易导致相应环境耐药细菌的发生[30].本项研究中,细菌对环丙沙星、左氟沙星、多黏菌素B均高度敏感,在毗邻水产养殖地的高桥红树林区,分离的水体和沉积物细菌也呈现类似的现象[31].环丙沙星和左氟沙星同为氟喹诺酮类抗生素,对革兰阳性菌和革兰阴性菌均有抗菌作用,对大部分细菌呈现抗菌活性,尤其是对耐药性强的阴性杆菌对此类药物仍呈现敏感性,不易导致细菌耐药性的产生[32].多黏菌素B是多肽类抗生素,对很多革兰阴性均有抗菌作用,除了多黏菌素E外,与其他抗菌药物间没有交叉耐药且不易产生耐药性[33],故此本项研究中的环境细菌对多黏菌素B表现敏感.
BL3是发病虾池,从图6可以看出,此池中分离出来的细菌对红霉素、环丙沙星、多黏菌素B、庆大霉素和左氟沙星、氯霉素和萘啶酸这7种抗生素敏感;但对四环素、甲氧苄胺嘧啶、复方新诺明和氨苄青霉素这4种抗生素的耐药性则明显高于BL1和对照水源地.据了解,虾池发病时虾场主向虾池投放了较多的漂白粉进行消毒,消毒过程将杀灭大量的敏感细菌,而耐性高的细菌幸存,并可对四环素、甲氧苄胺嘧啶、复方新诺明和氨苄青霉素产生耐药性,先前的研究表明,消毒剂等污染物的环境胁迫也可能会诱导细菌对抗生素产生耐药性[26,34].对照水源地BL4沉积物中细菌耐药性显著高于水体,由于沉积物环境更适合细菌生长繁殖,可作为耐药细菌和药物残留长期的储存库[35],在较强的选择压力作用下,加速了抗生素耐性基因在同种属以及不同种属细菌之间的传播和扩散[8],增加了耐药性获得的机率,从而导致样地水体和沉积物细菌对抗生素产生相似的耐药性谱.
本研究结果显示,同一采样虾池水体和沉积物中的细菌耐药性呈显著正相关性,在周围毗邻众多养殖池塘的高桥红树林区的研究结果也呈现了类似的状况[31],养殖过程含抗生素及其耐药细菌的养殖废水排放后进入滨海湿地区域[36],细菌的耐药基因可通过种间水平扩散和种内垂直传递[26],从而导致水体和沉积物的细菌耐药性呈现了显著的相关性.而在不同采样位点中,对照水源地的细菌耐药性与养殖虾池中的细菌耐药性差异不显著,缘于样地间细菌对暴露在环境中的不同种抗生素产生了交叉污染[14]、以及虾池与水源地水体交换顺畅,有利于细菌耐药基因水平扩散[30],如此,水产养殖场地抗生素药物的滥用无疑会导致细菌耐药性的选择性发生,其耐药性的垂直传播和水平扩散无疑增加了养殖过程细菌病害防治的难度.
受各种因素的影响,养殖区环境细菌出现多重耐药性(MAR)[14,30].本项研究中(表3),产生的多重耐药细菌大部分对2~5种抗生素表现耐药性,但很少出现对6种或7种抗生素同时耐药情况,仅在BL1沉积物中出现了细菌的7重耐药性.细菌多重耐药性的产生主要由于质粒编码、染色体突变、甚至是更小的且可移动基因元件—转座子的作用[37-38].抗生素种类和使用历史也与多重耐药性的形成密切相关[8].如果经常使用某种抗生素,由于选择压力导致耐药基因的表达,且随着环境中抗生素残留增加,可促进了细菌耐药基因垂直传播和水平扩散,耐药基因一旦形成,会因扩散引起局部区域细菌耐药性的增高[39].研究虾场的虾池年龄均为5年,在养殖的过程中通常要往虾池中投喂大量饲料,饵料生产商可能会在饲料中添加少量未知类型的抗生素[40],为了预防和治疗虾病又经常往水中施加抗菌类药物和漂白粉等消毒剂,如此长期以往无疑会导致虾场细菌的多重耐药性增多,故此,海水养殖生产过程当谨慎使用抗菌药物.
4 结论
本实验研究了湛江东海岛北寮村的高位虾池及其水源地从放苗到收虾的养殖过程水体和沉积物中的细菌数量变化及其与主要生态因子关系,并分析了该虾场环境细菌对常见抗生素的耐药性.结果表明:(1)在养殖过程中,虾池水体中的细菌与弧菌数量变化呈单峰趋势,虾池沉积物以及水源地中细菌与弧菌数量变化无明显的规律;(2)虾场细菌、弧菌数与多数生态因子之间相关性不显著(p>0.05),与较大的人为扰动因素有关;(3)样地水体和沉积物细菌对12种抗生素的耐药性差异显著,其中对氨苄青霉素耐药性最高,对左氟沙星、环丙沙星和多黏菌素B敏感,水体和沉积物细菌对抗生素表现出相似的耐药性谱且两者间呈显著正相关(r=0.932,p<0.05);(4)对照水源地耐药性与养殖虾池中细菌耐药性差异不显著(ANOVA,p>0.05),与细菌耐药性的水平扩散和细菌对不同种抗生素产生交叉污染有关;(5)调查样地的环境细菌表现出了较高的多重耐药性,增加了细菌病害防治的难度.本研究结果为高位虾池养殖尤其是抗菌药物的合理使用提供了科学依据.
[1]胡梦红.抗生素在水产养殖中的应用,存在的问题及对策[J].水产科技情报,2006,33(5):217-221.
[2]SARMAH A K,MEYER M T,BOXALL A.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere,2006,65(5):725-759.
[3]刘兴旺,程成荣.南美白对虾高位池养殖技术[J].广东饲料,2010,19(8):27-28.
[4]申玉春,熊邦喜,叶富良,等.凡纳滨对虾高位池细菌数量变化及其与水环境因子的关系[J].海洋科学,2006,30(7):33-37.
[5]高尚德,陈旭仁,吴以平.中国对虾养成期间虾池水体和底质中细菌含量的变化[J].水产学报,1994,18(2):138-142.
[6]查广方,周昌清,麦雄伟.凡纳滨对虾低盐度高产虾池环境微生物生态研究[J].生态科学,2006,25(3):231-235.
[7]罗 亮,李卓佳,张家松,等.对虾精养池塘碳,氮和异养细菌含量的变化及其相关性研究[J].南方水产科学,2011,7(5):24-29.
[8]杨凤霞,毛大庆,罗 义,等.环境中抗生素抗性基因的水平传播扩散[J].应用生态学报,2013,24(10):2993-3002.
[9]陈健舜,孔 蕾,丁雪燕,等.凡纳滨对虾细菌性红体病病原的分子特征与耐药性[J].水产学报,2012,36(12):1891-1900.
[10]HELENA R R,VIANA D S O,SOUSA L A,et al.Antimicrobial resistance profile of Vibrio species isolated from marine shrimp farming environments(Litopenaeus vannamei)at Ceará,Brazil[J].Environmental Research,2011,111(1):21-24.
[11]张瑜斌,章 虹,柯 盛,等.不同养殖模式虾池弧菌对抗菌药物的耐药性与虾池水质评价[J].广东海洋大学学报,2007,27(1):42-47.
[12]VASEEHARAN B,RAMASAMY P,MURUGAN T,et al.In vitro susceptibility of antibiotics against Vibrio spp.and Aeromonas spp.isolated from Penaeus monodon hatcheries and ponds[J].International Journal of Antimicrobial Agents,2005,26(4):285-291.
[13]LE T X,MUNEKAGE Y,KATO S.Antibiotic resistance in bacteria from shrimp farming in mangrove areas[J].Science of the Total Environment,2005,349(1-3):95-105.
[14]TENDENCIA E A,de la PEÑA L D.Antibiotic resistance of bacteria from shrimp ponds[J].Aquaculture,2001,195(1):193-204.
[15]GB17378.4-2007海洋监测规范(第4部分):海水分析[S].中国标准出版社,2007.
[16]陈绍铭,郑福寿.水生微生物学实验法[M].北京:海洋出版社,1990.
[17]张 昕,蔡俊鹏.四种海洋致病弧菌对抗生素敏感性的测定[J].华南理工大学学报:自然科学版,2003,31(9):66-69.
[18]WEBSTER L F,THOMPHON B C,FULTON M H,et al.Identification of sources of Escherichia coli in South Carolina estuaries using antibiotic resistance analysis[J].Journal of Experimental Marine Biology and Ecology,2004,298(2):179-195.
[19]林克冰,周 宸,蔡清海,等.斑节对虾双季养成期间虾池水质和底泥细菌含量的变化[J].福建水产,1998,79(4):7-12.
[20]刘少英.滩涂土池半集约化养殖凡纳滨对虾和斑节对虾的生长特性研究[D].广东海洋大学,2010.
[21]申玉春,熊邦喜,叶富良,等.凡纳滨对虾高位池养殖系统的水质理化状况[J].湛江海洋大学学报,2006,26(1):16-21.
[22]李秋芬,陈碧鹃.鱼虾混养生态系中细菌动态变化的研究[J].应用生态学报,2002,13(6):731-734.
[23]刘国才,李德尚.对虾综合养殖生态系底泥细菌的数量动态[J].应用生态学报,2000,11(1):138-140.
[24]李烁寒,李卓佳,杨莺莺,等.秋冬季凡纳滨对虾养殖池塘细菌的数量动态[J].暨南大学学报:自然科学版,2009,30(3):343-348.
[25]章洁香,张瑜斌,张才学,等.高位虾池水体细菌和弧菌的数量变化及影响因素[J].集美大学学报:自然科学版,2010,15(5):327-332.
[26]ALONSO A,SANCHEZ P,MARTINEZ J L.Environmental selection of antibiotic resistance genes[J].Environmental Microbiology,2001,3(1):1-9.
[27]刘兴旺.细菌耐药性产生机理的研究进展[J].中国畜禽种业,2014,1(1):28-29.
[28]CHELOSSI E,VEZZULLI L,MILANO A,et al.Antibiotic resistance of benthic bacteria in fish-farm and control sediments of the Western Mediterranean[J].Aquaculture,2003,219(1):83-97.
[29]高玉龙.南海网箱养殖区细菌耐药性调查[D].上海海洋大学,2013.
[30]KÜMMERER K.Antibiotics in the aquatic environment-a review-part II[J].Chemosphere,2009,75(4):435-441.
[31]李 媛.高桥红树林区常用抗生素残留及细菌耐药性研究[D].广东海洋大学,2013.
[32]吴干斌,周建华,张 军.5种喹诺酮类药物体外抗菌活性的研究[J].中国临床药理学杂志,2014,30(2):129-130.
[33]刘锡均.实用药物指南[M].北京:人民军医出版社,2001.
[34]WRIGHT G D.Antibiotic resistance in the environment:a link to the clinic?[J].Current Opinion in Microbiology,2010,13(5):589-594.
[35]MUDRYK Z J,KOSIOREK A,Perliński P.In vitro antibiotic resistance of Vibrio-like organisms isolated from seawater and sand of marine recreation beach in the southern Baltic Sea[J].Hydrobiologia,2012,702(1):141-150.
[36]KÜMMERER K.Antibiotics in the aquatic environment-a review-part I[J].Chemosphere,2009,75(4):417-434.
[37]RUBAN P,GUNASEELAN C.Antibiotic resistance of bacteria from Krishna Godavari Basin,Bay of Bengal,India[J].Environmental and Experimental Biology,2011,9(10):133-136.
[38]肖增璜,石 磊,邱春婵,等.多重PCR筛选临床细菌耐药整合子基因[J].暨南大学学报:自然科学与医学版,2005,26(4):480-485.
[39]TELLO A,AUSTIN B,TELFER T C.Selective pressure of antibiotic pollution on bacteria of importance to public health[J].Environmental Health Perspectives,2012,120(8):1100-1106.
[40]张正丈,韩 宏.几种替代抗生素的新型水产饲料添加剂[J].科学养鱼,2012,2(11):71-72.
[责任编辑:刘蔚绥]
Variations in bacterial densities during culture and bacterial resistances to antibiotics in the exalted shrimp ponds at Beiliao village,on Donghai island,Zhanjiang
LI Qin,HE Yanyan,ZHANG Yubin
(Monitoring Center for Marine Resources and Environments,Zhanjiang 524088,China)
The variations in densities of bacteria and vibrio were surveyed in water and sediment samples by dilution-plate method in the exalted shrimp ponds at village Beiliao,on Donghai Island,Zhangjiang,and the bacterial resistances to 12 antibiotics were investigated simultaneously using the standard disc diffusion method.The results showed that mono-peaks were present in changes of bacteria and vibrio densities in both exalted shrimp ponds,with a top in September over sampling respectively.At the same time,no definitive patterns were found in the variations of bacterial and vibrio abundances insediment in the shrimp ponds and corresponding water source site.At BL1,the bacteria and vibrio densities showed a significantly positive correlation with the concentration of NH+4-N in sediment(p<0.05),while the vibrio densities were significantly positive correlated to the concentration of NO3-N in water(p<0.05).No significant correlation was discovered between the densities of bacteria and vibrio and other selected ecological factors(p>0.05)in the shrimp ponds.The significant differences in bacterial resistances were found among the 12 different antibiotics(p<0.05),with the highest resistance to ampicillin(reaching 80.65%in sediment at corresponding water source site BL4),followed by cefazolin and trimethoprim in turn,while the bacterial strains were highly sensitive to the levofloxacin,ciprofloxacin and polymyxin B.The similar profile of percentage of antibiotic-resistance were observed between bacteria isolated from water samples and those from sediment ones,and a significantly positive correlation of antibiotic-resistance of bacteria was present between them(p<0.05).No significant difference in bacterial resistance was found between the exalted shrimp ponds and corresponding water source site(p>0.05),although antibiotic resistance of bacteria was significantly higher in sediment than in water at the BL4(corresponding water source site)(p<0.05).All bacteria isolated from three sampling sites revealed the high percentages of multiple antibiotic resistance(MAR).
shrimp ponds;bacteria;density;antibiotics;resistance
S917.1;X55
A
1000-9965(2015)01-0011-10
10.11778/j.jdxb.2015.01.003
2014-07-14
国家海洋公益性行业科研专项(201305021);广东省教育厅科技创新项目(2013KJCX0095);广东省科技计划项目(2013B020309011)
李 琴(1991-),女,研究方向:海洋微生物学与海洋生态学
张瑜斌(1970-),男,教授,博士,研究方向:海洋生态学.Tel:0759-2383378,E-mail:microyubin@163.com.
