家族性和三阴性乳腺癌血清中miR-21的表达
2015-12-24周桃玉温旺荣
陈 崇,周桃玉,温旺荣
(暨南大学附属第一医院临床医学检验中心,广东广州510630)
家族性和三阴性乳腺癌血清中miR-21的表达
陈 崇,周桃玉,温旺荣
(暨南大学附属第一医院临床医学检验中心,广东广州510630)
目的:检测血清miR-21在乳腺癌中的表达差异,为进一步阐明miR-21在家族性和三阴性乳腺癌发病机制中的作用.方法:收集健康女性体检者、具有患乳腺癌高风险者、不同种类乳腺癌患者的血清.以线虫miR-39为外参,通过实时荧光定量PCR检测77份血清中miR-21的表达水平.结果:家族性乳腺癌组、三阴性乳腺癌组和乳腺癌高风险组血清miR-21水平显著高于正常对照组、其他乳腺癌组(P<0.01).血清miR-21的表达水平与淋巴结转移、Ki67高表达有关(P<0.01).结果显示血清miR-21表达量在家族性和三阴性乳腺癌中升高,且与淋巴结转移和Ki67表达有关.结论:血清miR-21与三阴性、家族性乳腺癌的发生有紧密联系,其表达增高与乳腺癌的遗传性、恶性程度及预后判断有关.
miR-21;家族性乳腺癌;三阴性乳腺癌;血清;荧光定量PCR
乳腺癌的发病率位居全球女性恶性肿瘤首位.中国乳腺癌的发病率以每年3%~4%的速度增长,现在已成为女性癌症死亡的主要原因.乳腺癌是一种具有明显遗传特征的恶性疾病,是环境、遗传等因素共同作用的结果[1].中国家族性乳腺癌占所有乳腺癌的20%~25%.而三阴性乳腺癌(雌激素、孕激素受体与人表皮生长因子受体-2均为阴性者)占所有乳腺癌的约15%~20%,且拥有比其他类型的乳腺癌更高的复发率和更差的预后.近年来,越来越多的研究证据表明microRNA可以作为检测癌症存在和判断预后的生物标志物.其中miR-21在癌症患者中的表达量的改变最为常见[2].2005年Iorio等[3]首次发现miR-21在乳腺癌组织的表达量明显高于正常乳腺组织,Wang F等[4]发现miR-21在乳腺癌患者组织和血清中表达均有增高.因此,本研究选择乳腺癌高危者和不同类型的乳腺癌,特别是家族性和三阴性乳腺癌患者血清中miR-21表达水平进行检测,并分析其在家族性和三阴性乳腺癌中的发病作用.
1 材料和方法
1.1 研究对象
研究对象来自暨南大学附属第一医院2013年1月至2014年5月门诊、住院就诊者.分为以下4组:A组为三阴性乳腺癌病人,共20例,平均年龄(53±1.33)岁;B组为家族性乳腺癌病人,共8例(已剔除三阴性的病例),平均年龄(49±1.98)岁;B2组为家族性乳腺癌病人的健康一级亲属(具有患乳腺癌高风险),共9例,平均年龄(37±4.12)岁;C组为其他乳腺癌病人(除三阴性及家族性乳腺癌),共20例,平均年龄(56±2.43)岁;D组为对照组,收集同期体检者血清(入选标准是无肿瘤病史和临床体征的健康女性),共20例,平均年龄(45±3.24)岁.收集血清后放置-80℃冰箱保存.
1.2 所用仪器和器材
Light Cycler1.5 Instrument罗氏实时荧光定量仪(德国Roche);ABI Prism 7000荧光定量PCR仪(美国ABI公司);高速冷冻离心机(中国科技大学中佳公司);Ⅱ级B2型生物安全柜(新加坡ESCO);Biophotomet加样枪(德国Eppendorf);Biophotometer生物分光光度计(德国Eppendorf).
1.3 主要试剂
Trizol试剂(美国Invitrogen);异丙醇、氯仿、无水乙醇(广州达晖公司);HmiR-21 Hairpin-itTMReal-Time PCR Kit和Cel-miR-39 Hairpin-itTMReal-Time PCR Kit(上海吉玛公司);线虫Cel-miR-39的双链mimics(上海吉玛公司);RNA酶抑制剂(加拿大Thermo Fermentas).
1.4 方法
(1)样本准备 用含促凝胶的真空采血管抽取研究对象4 mL外周静脉血,待血液凝固后3 000 r/min离心10 min,取上层血清至1.5 mL EP管放-80℃冰箱保存.
(2)总RNA提取 血清样本置冰上融化后,吸取250 μL加入1 mL Trizol中混匀,室温放置5 min后,加入mimics 4 μL.加入200 μL氯仿,在漩涡混合器中剧烈振荡15 s,置入离心机中4℃12 000 r/min离心15 min.将上层液相(约600 μL)吸出,加入500 μL异丙醇中颠倒混匀,室温静置10 min.4℃12 000 r/min离心10 min后,弃去上清液.用1 mL配好预冷的体积分数为75%乙醇(750 μL无水乙醇加250 μL DEPC处理水)反复洗涤RNA沉淀.4℃7 500 r/min离心5 min,弃去上清.开盖室温干燥RNA沉淀25 min.加入30 μL DEPC处理水反复多次吹打混匀RNA沉淀,使其溶解.测定总RNA浓度,得到的总RNA纯度范围在1.8~2.0,浓度为25~50 ng/L.
(3)逆转录反应 反应体系总体积为20 μL,包括5×buffer 4 μL,dNTP(10 mmol/L)0.75 μL,miR-21逆转录引物(1 μmol/L)1.2 μL,RNA酶抑制剂(40 U/μL)0.25 μL,MMLV逆转录酶(200 U/μL)0.2 μL,总RNA样本5 μL,DEPC处理水8.6 μL.反应设1个复孔.反应条件为25℃30 min,42℃30 min,85℃5 min.外参Cel-miR-39逆转录反应体系同上.阴性对照以生理盐水代替提取的总RNA产物.
(4)实时荧光定量PCR 反应体系总体积为20 μL,包括2×Master Mix 10 μL(包含MgCl2,dNTPs、SYBR Green荧光染料)10 μL,逆转录引物套装(5 mol/μL)0.32 μL,Taq DNA聚合酶(5×106U/L)0.2 μL,逆转录产物2 μL,DEPC处理水8.6 μL.反应设1个复孔.反应条件为95℃预变性3 min,95℃12 s、62℃40 s,40个循环.外参Cel-miR-39反应体系同上.设置熔解曲线判断是否有非特异性的扩增和引物二聚体的出现.空白对照以生理盐水代替逆转录产物.
(5)血清中miR-21表达量 PCR扩增结果用Ct值来表示,Ct值的含义是PCR反应中荧光信号达到所设定的阈值时的循环数.目的基因的相对表达量(relative expression,RQ)用2-ΔΔCt表示[5].ΔΔCt=(标本CtmiR-21-标本CtCel-miR-39)-(对照CtmiR-21-对照CtCel-miR-39),健康体检者标本血清的miR-21作为对照.
1.5 统计学分析
数据均采用SPSS 17.0统计软件处理,相对表达量2-ΔΔCt成偏态分布且方差不齐,将2-ΔΔCt进行对数转换后,经单样本K-S检验,符合正态分布(Z=0.643,P=0.803>0.05),经Levene检验结果方差不齐(P=0.007<0.05).采用单因素ANOVA分析多个样本均数间比较,两两样本间采用Tamhane's T2法检验.在不同的乳腺癌临床病理参数组之间的血清miR-21表达水平比较,用Wilcoxon秩和检验,以P<0.05为有统计学差异.
2 结果
2.1 miR-21和Cel-miR-39的熔解曲线
miR-21熔解曲线在79℃左右呈现单峰;CelmiR-39熔解曲线在81℃左右呈现单峰,且均无引物二聚体与杂峰存在,表明PCR反应参数合适,扩增目标产物特异性较好(图1).
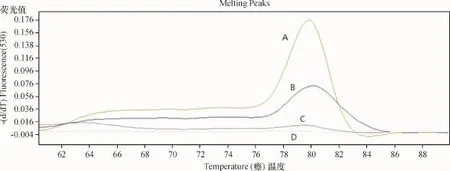
A:miR-21;B:miR-39;C:miR-21阴性质控;D:miR-39阴性质控.图1 miR-21和Cel-miR-39的熔解曲线A:miR-21;B:miR-39;C:miR-21 negative control;D:miR-39 negative control.Fig.1 Melting curves for miR-21 and miR-39
2.2 各组血清miR-21的表达差异
(1)实时荧光定量PCR检测结果 各组研究对象血清miR-21及Cel-miR-39的呈标准S型反应曲线,阴性对照曲线呈不规则型,空白对照无扩增曲线(图2、图3).
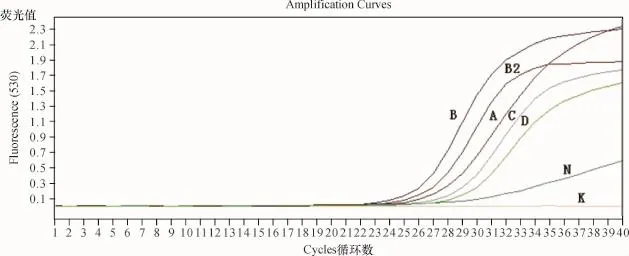
A:三阴性乳腺癌;B:家族性乳腺癌;B2:乳腺癌高危者;C:其他乳腺癌;D:正常对照;N:阴性对照;K:空白对照.图2 各组血清中miR-21实时荧光定量PCR扩增曲线A:triple negative breast cancer;B:familial breast cancer;B2:high risk for breast cancer C:other breast cancer;D:healthy control;N:negative control;K:blank control.Fig.2 The amplification curves of fluorescence quantitative PCR for serum miR-21 in different groups
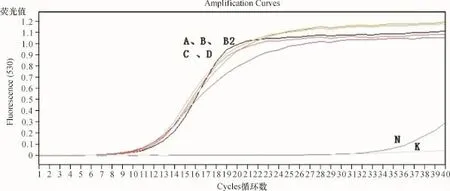
A:三阴性乳腺癌;B:家族性乳腺癌;B2:乳腺癌高危者;C:其他乳腺癌;D:正常对照;N:阴性对照K:空白对照.图3 各组血清中Cel-miR-39的实时荧光定量PCR扩增曲线A:triple negative breast cancer;B:familial breast cancer;B2:high risk for breast cancer C:other breast cancer;D:healthy control;N:negative control;K:blank control.Fig.3 The amplification curves of fluorescence quantitative PCR for exogenous internal reference miR-39 in different groups
(2)正常对照、乳腺癌A、B、B2、C组的血清miR-21表达水平比较 以ΔCt表示标本miR-21的表达量.当ΔCt值越低,说明miR-21在研究对象体内表达量越高,检测结果显示了血清miR-21的表达量.所有研究对象血清样本中的miR-21、miR-39检测结果见表1.
表1 血清miR-21在正常对照与不同乳腺癌分组中表达差异1)Table 1 Differential expression of serum miR-21 in healthy control group and various of breast cancer groups(±s)
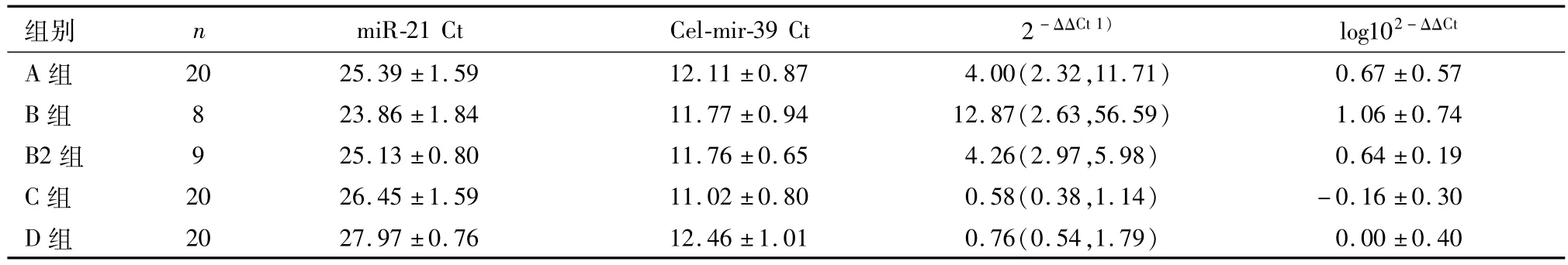
表1 血清miR-21在正常对照与不同乳腺癌分组中表达差异1)Table 1 Differential expression of serum miR-21 in healthy control group and various of breast cancer groups(±s)
1)数据不成正态分布采用M(P25,P75)表示.
组别nmiR-21 CtCel-mir-39 Ct2-ΔΔCt1)log102-ΔΔCtA组2025.39±1.5912.11±0.874.00(2.32,11.71)0.67±0.57 B组823.86±1.8411.77±0.9412.87(2.63,56.59)1.06±0.74B2组925.13±0.8011.76±0.654.26(2.97,5.98)0.64±0.19 C组2026.45±1.5911.02±0.800.58(0.38,1.14)-0.16±0.30 D组2027.97±0.7612.46±1.010.76(0.54,1.79)0.00±0.40
经单因素ANOVA方差分析,比较5组间的相对表达量有统计学差异(F=17.11,P=0.00<0.01),进一步使用Tamhane's T2法检验做各个分组间的比较,三阴性乳腺癌组、家族性乳腺癌组血清miR-21水平显著高于正常对照组和其他乳腺癌组(P<0.01);乳腺癌高危组血清miR-21水平显著高于正常对照组和其他乳腺癌组(P<0.01);三阴性乳腺癌组、家族性乳腺癌组和乳腺癌高危组间差异无统计学意义(P>0.05);正常对照组与其他乳腺癌组间差异无统计学意义(P>0.05)(图4).
2.3 血清miR-21的表达与乳腺癌临床病理参数的关系
乳腺癌血清中miR-21相对表达量与肿瘤单侧或双侧发生(P=0.679)、年龄(P=0.245)、CA153(P=0.893)、月经状况(P=0.717)无明显关系,各分组间差异无统计学意义(均P>0.05).乳腺癌血清中miR-21相对表达量与淋巴结转移(P=0.000)、Ki67(P=0.006)呈正相关(表2),P<0.05有统计学意义(图5、6).
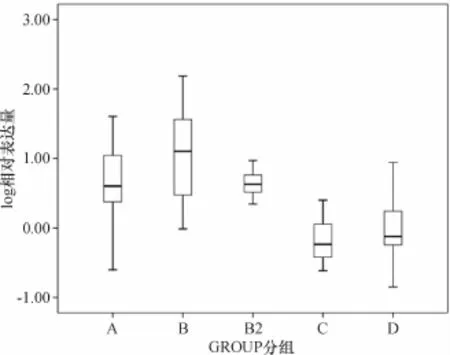
A:三阴性乳腺癌;B:家族性乳腺癌;B2:乳腺癌高危者;C:其他乳腺癌;D:正常对照.图4 各组血清中miR-21表达量(n=77)比较A:triple negative breast cancer;B:familial breast cancer;B2:high risk for breast cancer C:other breast cancer;D:healthy control.Fig.4 The serum miR-21 expression levels in different groups
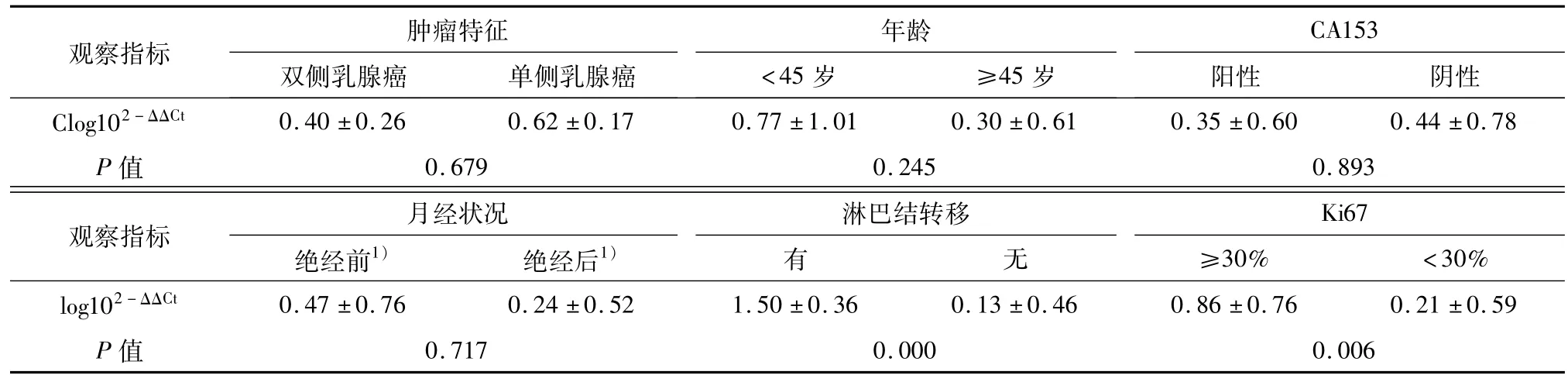
表2 血清miR-21表达与临床病理参数间的关系Table 2 Assocation of miR-21 expression with clinical and pathological features
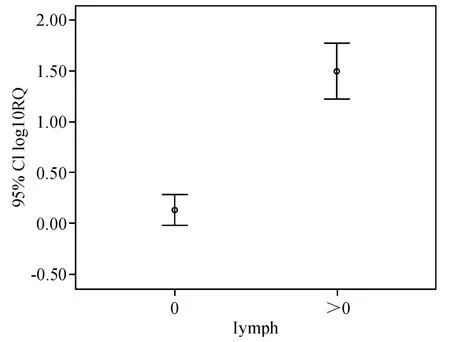
图5 淋巴结转移情况与血清miR-21表达统计图Fig.5 Assocation of miR-21 expression with lymph nod metastasis
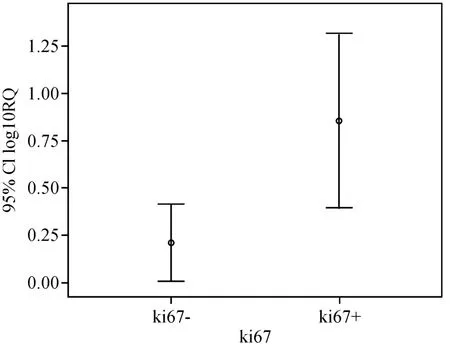
图6 Ki67与血清miR-21表达统计图Fig.6 Assocation of miR-21 expression with ki67
3 讨论
微小RNA(miRNA)是内源性非编码的小型核糖核酸,广泛存在于动物、植物和病毒中,能够与特定的目标mRNA中序列互补配对,并在转录后调控靶基因的表达或翻译,参与生物体的生理、病理过程.研究表明循环中miRNA与肿瘤的临床病理特征密切相关,其表达情况可以用于恶性肿瘤的诊断、预后判断和治疗.
通过实时荧光定量PCR检测人体血清中miRNA的表达量,消除在RNA提取过程中样品间的差异十分关键,之前大多数研究都选择内参如U6来达到这一作用,但是内参在人体疾病状态下是否影响表达量也暂不可知,并且在血清中来源与表达目前为止仍然存在许多不清楚的因素.本实验引入人工合成的线虫miR-39作为外源性的内参,由于人体血清中不含有此序列且影响因素少,并且这一做法已得到验证[6].
已有研究证明,miR-21编码基因位于17q23.2[7].在结肠癌[8]、肺癌[9]、胃癌[10]、乳腺癌[11]等多种肿瘤中表达异常.miR-21在乳腺癌组织高于正常乳腺组织中的表达水平,其表达水平与一些临床和病理特征相关[12-14].而且国内外学者已研究关注人体血液循环中miR-21,并认为血清中miR-21表达升高对恶性肿瘤的早期诊断[2]、早期治疗[15]、肿瘤转移[11]、肿瘤恶化[16]和预后[2]等方面具有预测价值.因此,本组对乳腺癌患者血清miR-21进行临床研究.
本研究主要对正常人、乳腺癌高风险人群、乳腺癌患者血清miR-21的表达水平进行检测,并分析比较之间差异.检测结果表明,家族性乳腺癌组的血清miR-21表达水平在所有分组中最高;且家族性乳腺癌组、三阴性乳腺癌组和乳腺癌高危组血清miR-21的表达量均高于其他乳腺癌组和正常对照组(P<0.05).王责年等的研究也显示[17]血清miR-21在乳腺癌患者血清呈高表达;Wang B等[13]使用SYBR green实时荧光定量PCR检测正常对照和乳腺癌病人血清中miR-21的表达量,发现miR-21在癌症患者血清中显著增高(P<0.001).上述两个研究结论与本文结果一致,但存在一定差异,差异在于上述两个研究中家族性乳腺癌和三阴性乳腺癌都归入乳腺癌组,但本研究将家族性乳腺癌和三阴性乳腺癌患者区分出来研究分析,所以本文的结论为正常对照组与其他乳腺癌组的差异不存在统计学意义,而家族性乳腺癌和三阴性乳腺癌组均升高.正如Radojicic J[18]等研究中,miR-21在原发性三阴性乳腺癌患者中高表达,与本研究相一致.
本研究还发现9例家族性乳腺癌患者的一级健康亲属血清中miR-21表达量增高,与正常对照组差异有统计学意义(P<0.05).miR-21在乳腺癌高危者血清中高表达结合乳腺癌家族史可望用于预测患乳腺癌高风险,当然这一结论还需增加样本量进一步的实验验证.
48例乳腺癌组患者血清miR-21的检测结果与乳腺癌临床病理参数结果显示,血清miR-21的表达水平与淋巴结转移(P=0.000)、Ki67(P=0.006)经统计学分析差异有统计学意义.乳腺癌患者血清miR-21高表达不仅与乳腺癌的发生有关,而且与淋巴结转移和Ki67表达有关.说明miR-21与乳腺癌的转移具有相关性.Ki67抗原是一种在增殖细胞中表达的核抗原,能反映肿瘤的增殖活性[19].Ki67抗原的过量表达与乳腺癌的恶性生物学行为和预后有密切联系,并可以作为确定癌前人群中高危个体的生物学标志物.Ki67与miR-21表达的正相关,预测miR-21在判断乳腺癌恶性程度、肿瘤的增殖能力、预测高危风险也存在一定价值.
血清miR-21与家族性和三阴性乳腺癌的发生密切相关,其表达增高对乳腺癌的遗传性、恶性程度及其预后相关,具体机制有待探讨.至于血清miR-21能否作为该种乳腺癌诊断指标、预测指标和与BRCA1基因突变的关系有待进一步的研究.
[1]WRIGHT J A,RICHER J K,GOODALL G J.microRNAs and EM Tin mammary cells and breast cancer[J].J Mammar y Gland Biol Neoplasia,2010,45(2):213-223.
[2]CHEN J,WANG X.MicroRNA-21 in breast cancer:diagnostic and prognostic potential[J].Clinical and Translational Oncology,2014,16(3):225-233.
[3]IORIO M V,FERRACIN M,LIU C G,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer research,2005,65(16):7065-7070.
[4]WANG F,ZHENG Z,GUO J,et al.Correlation and quantitation of microRNA aberrant expression in tissues and sera from patients with breast tumor[J].Gynecologic oncology,2010,119(3):586-593.
[5]吴瑞珊,苏运钦,余广超,等.Taqman探针实时荧光定量PCR检测肝脏疾病患者血清中miR-122的表达水平及其临床意义[J].中国病理生理杂志,2013,29(2):348-353.
[6]朱柄铭,陈文璟,苏运钦,等.血清miR-21在糖尿病肾病中的诊断价值[J].中国病理生理杂志,2013,29(12):2160-2166.
[7]FUJITA S,ITO T,MIZUTANI T,et al.miR-21 Gene Expression Triggered by AP-1 Is Sustained through a Double-Negative Feedback Mechanism[J].Journal of molecular biology,2008,378(3):492-504.
[8]SCHETTER A J,LEUNG S Y,SOHN J J,et al.MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J].Jama,2008,299(4):425-436.
[9]MARKOU A,TSAROUCHA E G,KAKLAMANIS L,et al.Prognostic value of mature microRNA-21 and microRNA-205 overexpression in non-small cell lung cancer by quantitative real-time RT-PCR[J].Clinical chemistry,2008,54(10):1696-1704.
[10]VOLINIA S,CALIN G A,LIU C G,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(7):2257-2261.
[11]闫雍容,周序珑,夏明汗,等.TGF-β1与乳腺癌中microRNA-21表达的关系[J].暨南大学学报:自然科学与医学版,2011,32(2):176-180.
[12]QIAN B,KATSAROS D,LU L,et al.High miR-21 expression in breast cancer associated with poor disease-free survival in early stage disease and high TGF-β1[J].Breast cancer research and treatment,2009,117(1):131-140.
[13]WANG B,ZHANG Q.The expression and clinical significance of circulating microRNA-21 in serum of five solid tumors[J].Journal of cancer research and clinical oncology,2012,138(10):1659-1666.
[14]KUMAR S,KEERTHANA R,PAZHANIMUTHU A,et al.Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J].Indian journal of biochemistry&biophysics,2013,50(3):210-214.[15]MULLER V,GADE S,STEINBACH B,et al.Changes in serum levels of miR-21,miR-210,and miR-373 in HER2-positive breast cancer patients undergoing neoadjuvant therapy:a translational research project within the Geparquinto trial[J].Breast cancer research and treatment,2014,147(1):61-68.
[16]YAN L X,HUANG X F,SHAO Q,et al.MicroRNA miR-21 overexpression in human breast cancer is associated with advanced clinical stage,lymph node metastasis and patient poor prognosis[J].Rna,2008,14(11):2348-2360.
[17]王责年,吴 娟.miR-21在乳腺癌患者血清中的表达及意义[J].医学研究杂志,2014,43(3):126-128.
[18]RADOJICIC J,ZARAVINOS A,VREKOUSSIS T,et al.MicroRNA expression analysis in triple-negative(ER,PR and Her2/neu)breast cancer[J].Cell Cycle,2011,10(3):507-517.
[19]GONG P,WANG Y,LIU G,et al.New insight into Ki67 expression at the invasive front in breast cancer[J].PloS one,2012,8(1):e54912-e54912.
[责任编辑:陈咏梅]
The expression of serum miR-21 in the patients with familial breast cancer and triple negative breast cancer
CHEN Chong,ZHOU Taoyu,WEN Wangrong
(Center of Clinical Laboratory Medicine,the First Affiliated Hospital,Jinan University,Guangzhou 510630,China)
Aim:To detect differences of serum miR-21 expression in breast cancer patients in order to further clarify the role of miR-21 in the pathogenesis of familial and triple negative breast cancers.Methods:The serum of healthy female volunteers,other types of breast cancer patients and high risk volunteers for breast cancer were collected.The expression levels of miR-21 in sera from 77 patients or volunteers were determined by fluorescence quantitative PCR.And Cel-miR-39 was used as exogenous internal reference.Results:The relative expression level of serum miR-21 was significantly higher in familial breast cancer groups、triple negative breast cancer group and high risk group than that in healthy control group or other breast cancer group(P<0.01).The expression of serum miR-21 was associated with lymph nod metastasis and Ki67 expression level(P<0.01).The results showed that serum miR-21 of patients with familial and triple-negative breast cancer,and was revelant with lymph node metastasis and Ki67 expression.Conclusion:Serum miR-21 of patients with breast cancer may be associated with hereditary,the degree of malignancy and determination of prognosis.
miR-21;familial breast cancer;triple negative breast cancer;serum;FQ-PCR
R737.9
A
1000-9965(2015)01-0050-07
10.11778/j.jdxb.2015.01.009
2014-11-12
广东省科技计划项目(2011B031800315)
陈 崇(1989-),女,技师,研究方向:临床分子生物学检验
温旺荣,教授,博士生导师,Tel:020-38688430,E-mail:wenwangrong@yeah.net
