固定化假单胞菌脂肪酶催化(R,S)-3-羟基丁酸乙酯转酯化拆分
2015-12-24谷耀华薛屏李鹏夏维涛
谷耀华,薛屏,李鹏,夏维涛
(宁夏大学 省部共建天然气转化国家重点实验室培育基地 化学化工学院,宁夏 银川 750021)
光学活性的手性醇与酯是精细有机化学品合成的重要原料,在医药、农药和化工等领域有着广泛的应用[1-4]。(R,S)-3-羟基丁酸乙酯的两种对映异构体均是重要手性药物合成的中间体,R-型异构体用于治疗青光眼药物的合成,S-型异构体用于合成昆虫信息素、碳青霉素烯类抗生素等手性药物,因此3-羟基丁酸乙酯单一对映体的制备备受学术和企业界的关注[5-6]。
物理拆分法以手性色谱柱作为分离柱,用高效液相色谱拆分能够获得3-羟基丁酸乙酯单一对映体[7],但处理样品的量极少,难以满足化学合成中的需求。Lee 等[8]利用化学方法以盐酸为催化剂,用乙醇醇解聚3-羟基丁酸乙酯,再用二氯甲烷萃取,制备了光学纯(R)-3-羟基丁酸乙酯,但反应条件苛刻,操作步骤繁琐。生物催化技术合成手性化合物具有反应条件温和、环境友好的优势[9-11]。于明安等[12]利用透性化处理的啤酒酵母细胞,借助于辅助底物乙醇和葡萄糖对3-羰基丁酸乙酯不对称还原合成(S)-3-羟基丁酸乙酯进行了研究,在30 ℃中性溶液中,细胞浓度≥90 mg/mL 条件下反应6 h,得到(S)-3-羟基丁酸乙酯的对映体过量值高于98%,产率94%。由于使用未固定化细胞作催化剂,反应结束时催化剂难以分离回收,且无法实现连续化反应。Fishman 等[13]利用固定化南极假丝酵母脂肪酶(CALB)催化(R,S)-3-羟基丁酸乙酯发生酯化反应,得到(S)-3-羟基丁酸乙酯对映体过量值为96%,再用固定化CALB 在乙醇中对(R)-3-乙酸基丁酸乙酯进行醇解,得到了对映体过量值为96%的(R)-3-羟基丁酸乙酯,但固定化南极假丝酵母脂肪酶CALB 价格昂贵,使用量大、成本高。
氧化硅基介孔材料的出现为酶的固定化开辟了新的发展空间。氧化硅基介孔材料具有较大的比表面积和孔体积、易修饰的表面、良好的生物兼容性及稳定性等优点,是固定化酶的理想载体[14]。本文利用醛基功能化介孔材料制备固定化假单胞菌脂肪酶,并用于有机层中催化拆分(R,S)-3-羟基丁酸乙酯,研究了时间、溶剂和酰化剂等反应条件对固定化酶催化转酯化拆分反应活性和对映选择性的影响规律。
1 实验部分
1.1 试剂与仪器
假单胞菌脂肪酶(Pseudomonas sp Lipase,PSL,30 U/mg);(R,S)-3-羟基丁酸乙酯、1,3,5-三甲苯、乙酸乙烯酯均为化学纯;正硅酸乙酯、乙酸酐、戊二醛、柱层析硅胶等均为分析纯;正十二烷,色谱纯;聚氧乙烯醚-聚氧丙烯醚-聚氧乙烯醚(EO20PO70EO20,P123)、3-氨丙基三乙氧基硅烷均为优级纯;乙酸异丙烯酯(99%)。
Micromeritics ASAP 2010 型物理吸附仪;Diamond TG/DTA 热重-差热综合分析仪;GC-2010 型气相色谱仪;WXG24 型圆盘旋光仪。
1.2 实验方法
1.2.1 介孔氧化硅泡沫MCF 的合成及其氨基化称取2.0 g P123溶于75 mL 1.6 moL/L HCl 中,室温下磁力搅拌至完全溶解。加入9.26 mL 三甲苯,搅拌均匀。加热至38 ℃,加入4.7 mL 正硅酸乙酯,搅拌24 h,形成溶胶。溶胶转入晶化釜中,于100 ℃晶化24 h。冷却至室温,滤出固体。干燥后用质量分数68%浓硫酸于95 ℃处理24 h。抽滤,固体用去离子水洗涤至中性,再用无水乙醇进行索氏提取,得到介孔MCF。
取0.8 g MCF 于50 mL 的圆底烧瓶中,加入1.1 mL 3-氨丙基三乙氧基硅烷和20 mL 甲苯,磁力搅拌均匀。于110 ℃油浴加热,氮气气氛下反应10 h。过滤,固体用10 mL 甲苯洗涤3 次,再用乙醇索氏抽提24 h,即得到氨基功能化样品NH2-MCF。
1.2.2 NH2-MCF 戊二醛交联 0.5 g NH2-MCF 加入到20 mL 含2.5%(体积分数)戊二醛的磷酸缓冲溶液(pH 8.0)中,室温下搅拌1.5 h。过滤,固体用去离子水洗涤3 次。70 ℃真空干燥5 h,得GNH2-MCF。
1.2.3 固定化酶的制备 0.1 g G-NH2-MCF 分散在10 mL 异辛烷中,加入100 μL 0.1 moL/L pH 6.5的磷酸盐缓冲溶液,混合均匀。加入10 mg 假单胞菌脂肪酶,于30 ℃恒温水浴摇床振荡4 h。用砂心漏斗抽滤,滤出固定化酶,并在真空干燥箱中室温干燥后冷冻储藏,用PSL/G-NH2-MCF 表示。
1.2.4 PSL/G-NH2-MCF 对3-羟基丁酸乙酯的催化转酯化反应 取1 mmol 3-羟基丁酸乙酯,2 mmol乙酸乙烯酯溶解在10 mL 甲苯中,加入100 mg固定化酶PSL/G-NH2-MCF 或10 mg PSL,40 ℃下反应48 h。分离出固定化酶,结束反应。
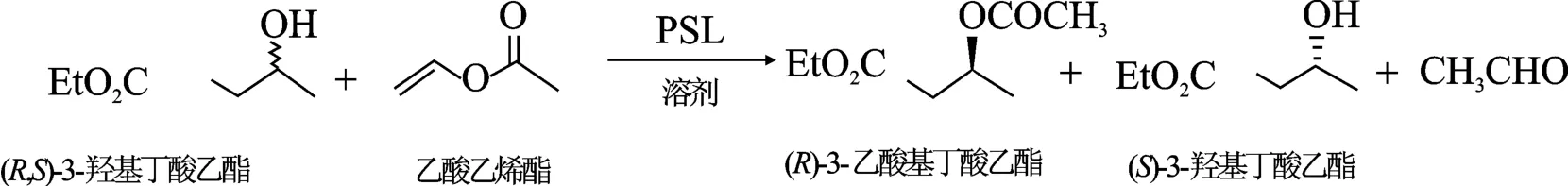
图1 (R,S)-3-羟基丁酸乙酯的酶催化转酯化拆分Fig.1 Transesterification resolution of (R,S)-ethyl-3-hydroxybutyrate catalyzed by lipase
反应液用气相色谱仪进行定量分析,气化室温度250 ℃,柱温100 ℃,检测器温度250 ℃,氮载气流速1.04 mL/min,分流比30∶1,柱前压0.06 MPa,氢火焰检测器。(R,S)-3-羟基丁酸乙酯的转化率C、(S)-3-羟基丁酸乙酯的对映体过量值eeS、(R)-3-乙酸基丁酸乙酯的对映体过量值eeP和对映选择性参数E 的计算如下[15]:
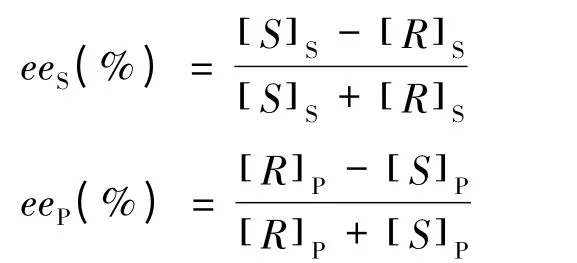
式中 [S]S——(S)-3-羟基丁酸乙酯的摩尔浓度;
由于本课题研究具有一定的前瞻性,在理论上借鉴、参考有限,因此,课题研究的运作上缺少相关学科专家及课题专家的引领。课题组成员虽然在课题实施中学习了大量的理论,做了许多学习笔记,但是在理论基础上还是比较欠缺的,研究的根基还很不扎实。在实施微课教学的实践过程中,对教学中出现的问题难以在理论上得到很好的总结与提高。简单地说,就是对课题研究如何行之有效地开展进行,还有待进一步探索研究,有时没有达到预期的效果,理论与实践还存在着较大的差距。这就需要我们在今后的教学实践中不断地反思、总结,进一步完善和提高。
[R]S——(R)-3-羟基丁酸乙酯的摩尔浓度;
[R]P——(R)-3-乙酸基丁酸乙酯的摩尔浓度;
[S]P——(S)-3-乙酸基丁酸乙酯的摩尔浓度;
1.2.5 产物的分离和比旋光度的测定 反应后的滤液用硅胶柱层析分离,柱径比1 ∶10。用V(乙酸乙酯)∶V(石油醚)= 1∶9 的洗脱液淋洗,用薄层色谱进行检测全部过程。当3-乙酸基丁酸乙酯全部洗脱后,改用V(乙酸乙酯)∶V(石油醚)= 1∶5 的洗脱液淋洗,直至3-羟基丁酸乙酯洗脱完毕,将3-乙酸基丁酸乙酯和3-羟基丁酸乙酯的洗脱液分别进行减压蒸馏,馏余液用甲苯稀释至10 mL,装入旋光管20 ℃测定其旋光度,比旋光度用[ ]α20D表示。
2 结果与讨论
2.1 G-NH2-MCF 的表征
2.1. 1 FTIR 分析 G-NH2-MCF 的红 外光谱 见图2。
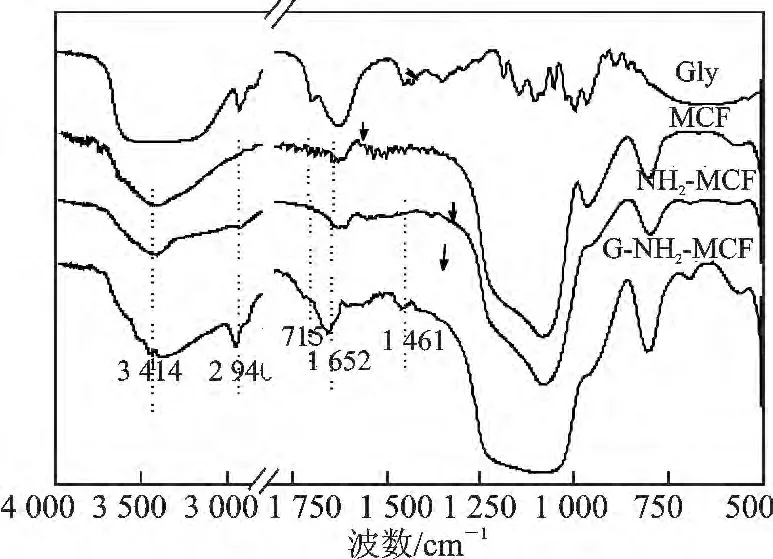
图2 G-NH2-MCF 的FTIR 谱图Fig.2 FTIR spectra of G-NH2-MCF
由图2 可知,1 715 cm-1的吸收峰归于羰基 C O 的吸收峰,2 940 cm-1处较强吸收峰为戊二醛中—CH2— 的特征吸收峰[16],1 652 cm-1吸收峰和1 690 ~1 630 cm-1吸收带归于氨基与醛基作用形成Schiff base 的特征吸收峰[17],表明介孔氧化硅泡沫MCF 经表面氨基化后戊二醛活化形成了富含醛基的G-NH2-MCF 载体。
2.1.2 N2吸附-脱附分析 G-NH2-MCF 的N2吸/脱附等温线见图3。
由图3 可知,G-NH2-MCF 与MCF 和NH2-MCF三者的N2吸/脱附等温线均居于IV 型。在P/P0=0 ~0.8 分压段,吸附量随着P/P0缓慢增加,在P/P0=0.8 ~0.9,吸附量陡增,产生突跃,这是N2在介孔内产生的毛细管凝聚所致,吸附量的急剧增加表明它们均具有大孔结构且孔径比较均匀。之后N2分子吸附于外表面,曲线变化不大,较为平坦。MCF 经氨基基团功能化及戊二醛活化后,G-NH2-MCF 仍保持了良好的大孔结构,其最可几孔径为17.9 nm。
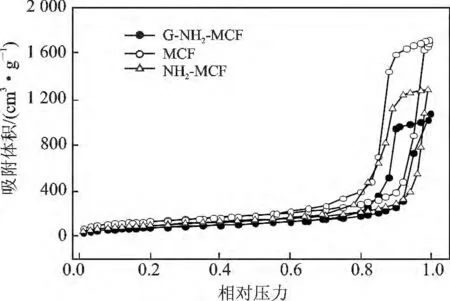
图3 G-NH2-MCF 的N2吸附-脱附曲线Fig.3 N2 desorption-adsorption curves of G-NH2-MCF
G-NH2-MCF、NH2-MCF 和MCF 的比表面积、平均孔径及孔体积列于表1。
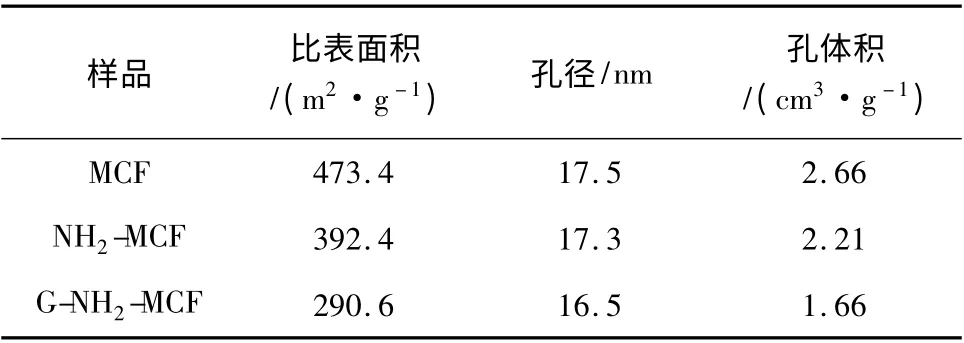
表1 样品的结构性质Table1 Structrual properties of samples
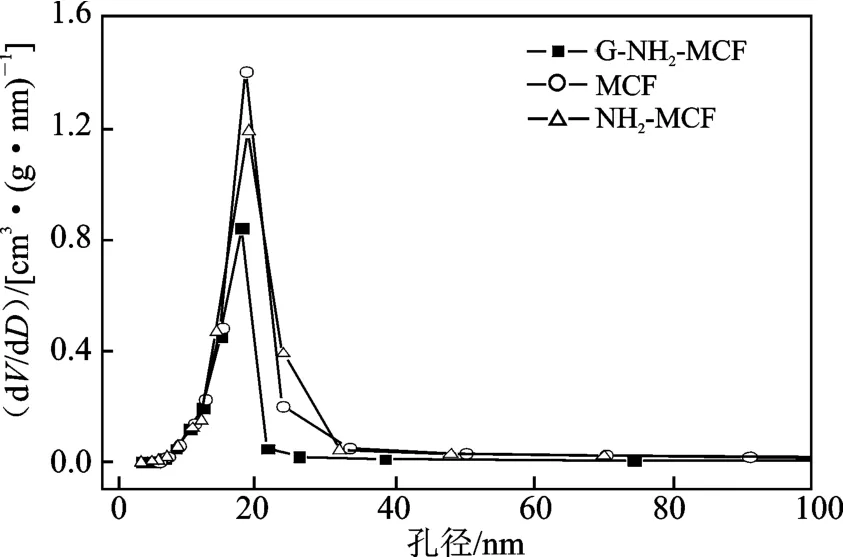
图4 G-NH2-MCF 的孔径分布Fig.4 Pore size distributions of G-NH2-MCF
由表1 可知,MCF 经3-氨丙基三乙氧基硅烷表面修饰,再与戊二醛反应形成的醛基介孔载体GNH2-MCF 比表面积为290.6 m2/g,平均孔径和孔体积为16.5 nm 和1.66 cm3/g,G-NH2-MCF 借助自身的醛基和酶分子的氨基发生化学作用,从而使酶分子以共价键偶联于G-NH2-MCF 载体(图5)。脂肪酶的线尺寸在7 ~9 nm,G-NH2-MCF 的孔径远大于酶分子尺寸,这对于固定化过程酶的传输和固定化酶催化反应的传质均十分有利。

图5 G-NH2-MCF 的制备和固定化酶示意图Fig.5 Preparation of G-NH2-MCF and lipase immobilization
2.1. 3 TG-DTA 分析 G-NH2-MCF、NH2-MCF 和MCF 的TG-DTA 见图6。
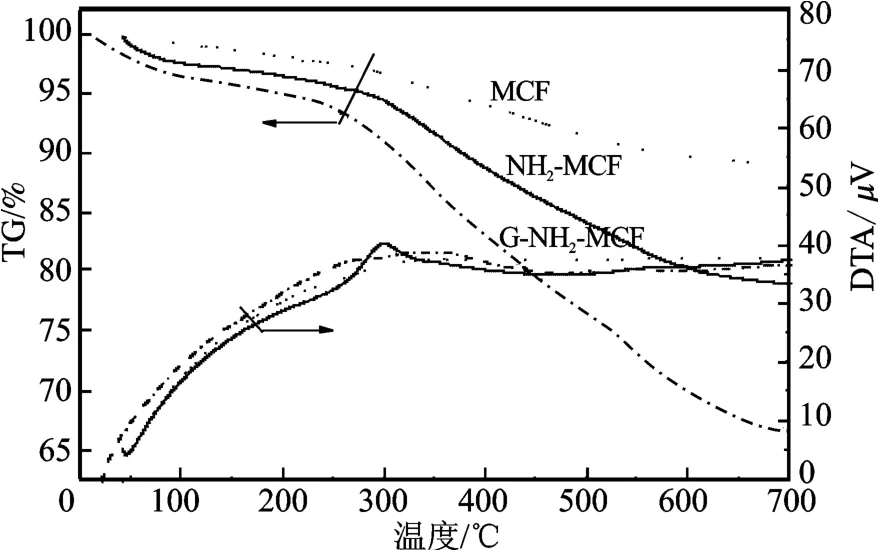
图6 样品的TG-DTA 曲线Fig.6 TG-DTA curves of the samples
由TG 曲线可见,在室温~200 ℃,三者的失重率较小均在3%左右,主要为样品表面吸附水和孔道吸附水的脱吸附。在300 ~550 ℃,NH2-MCF 失重率为12.3%,这是存在于其表面的氨基基团发生氧化反应放热引起的;G-NH2-MCF 热重损失为18.4%,高于NH2-MCF,其原因是G-NH2-MCF 表面存在大量的醛基等有机基团。由DTA 曲线可知,GNH2-MCF 在250 ~400 ℃出现了较宽的放热峰,归为G-NH2-MCF 含有的有机基团燃烧放出大量热所致,表明G-NH2-MCF 载体经3-氨丙基三乙氧基硅烷和戊二醛功能化修饰存在大量醛基等有机基团。
2.2 PSL/G-NH2-MCF 催化(R,S)-3-羟基丁酸乙酯转酯化拆分
分别取10 mg PSL 和0.1 g PSL/G-NH2-MCF 为催化剂,反应结束滤出酶,反应液经气相色谱进行定量分析,结果见表2。
由表2 可知,游离酶PSL 在40 ℃下催化反应48 h,(S)-3-羟基丁酸乙酯的对映体过量值eeS为1.95%,(R)-3-乙酸基丁酸乙酯的对映体过量值eeP为88.2%,这说明PSL 能够将不同构型的底物进行转酯化拆分,主要是优先选择性地催化(R)-3-羟基丁酸乙酯发生转酯化反应。PSL 经G-NH2-MCF 固定化后,其催化活性和对映选择性有大幅提高,在相同条件下,PSL/G-NH2-MCF 催化(R,S)-3-羟基丁酸乙酯发生转酯化拆分反应,(S)-3-羟基丁酸乙酯和(R)-3-乙酸基丁酸乙酯的eeS和eeP分别为19.6%和87.6%,底物总转化率为18.6%,E 值为18。
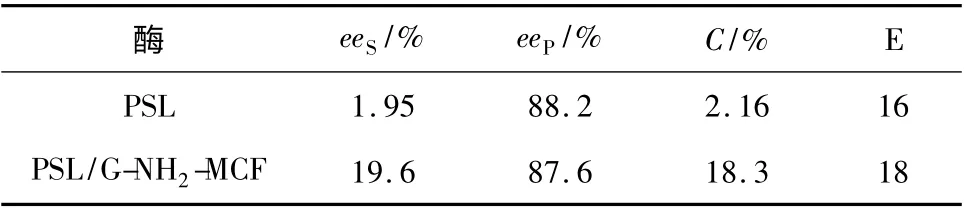
表2 PSL/G-NH2-MCF 与游离酶PSL 催化作用比较Table 2 Compared catalytic performance of PSL/G-NH2-MCF and free PSL
2.3 反应时间对PSL/G-NH2-MCF 催化性能的影响
由表3 可知,随着时间的延长,底物转化率和eeS逐渐增加,但是eeP逐渐降低。主要是由于脂肪族消旋醇的两个对映体生成相应酯之间的自由能差别太小,快慢反应催化速率差别不大,导致对映选择性偏低,因此反应时间的控制非常重要。反应36 h时,eeS、eeP和 转 化 率C 分 别 为9. 8%、95. 3% 和9.3%;反应48 h 时,eeS、eeP和转化率C 分别为19.6%,87.6%和18.3%,eeS和转化率C 均有很大提高;若继续延长反应12 h,导致eeP下降至79.9%,反而不利于(R)-3-乙酸基丁酸乙酯纯度的提高。综合考虑化学产率和光学产率,选择反应时间为48 h较为适宜。
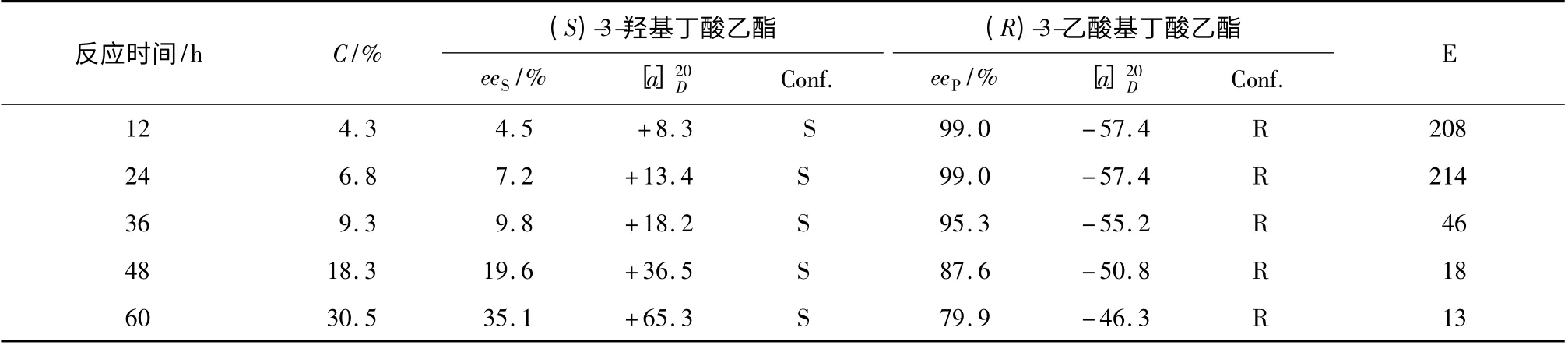
表3 反应时间对PSL/G-NH2-MCF 催化(R,S)-3-羟基丁酸乙酯拆分的影响Table 3 Effects of reaction time on the resolution of(R,S)-ethyl-3-hydroxybutyrate catalyzed by PSL/G-NH2-MCF
2.4 酰化剂对PSL/G-NH2-MCF 催化性能的影响
利用不同酰化剂进行转酯化拆分,结果见表4。由表4 可知,酰化剂对酶的催化活性和对映选择性的影响非常显著。用乙酸乙烯酯作为酰化剂,反应48 h 时,eeS、eeP和转化率分别为19. 6%,87.6%和18.3%;相同反应条件下,乙酸异丙烯酯为酰化剂,eeS、eeP和转化率分别为14.1%,82.6%和14.6%,相对乙酸乙烯酯较低;乙酸酐作为酰化剂得到的对映体过量值和转化率最低。因此,选择乙酸乙烯酯较适宜。
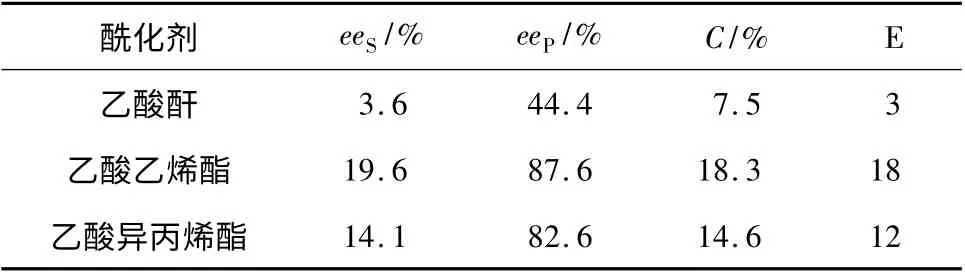
表4 酰化剂对(R,S)-3-羟基丁酸乙酯拆分的影响Table 4 Effects of acylation reagent on the resolution of (R,S)-ethyl-3-hydroxybutyrate
2.5 反应溶剂对PSL/G-NH2-MCF 催化性能的影响
由于体系中的水会在溶剂、酶、底物及产物之间进行分配,因而体系中溶剂的性质对结合于酶分子的水量有直接影响。疏水性强的溶剂是较好的酶反应介质,由于疏水作用,使其所需较低水量即可满足酶对水分的需求,有利于保持酶分子的必需水,使酶维持天然构象。
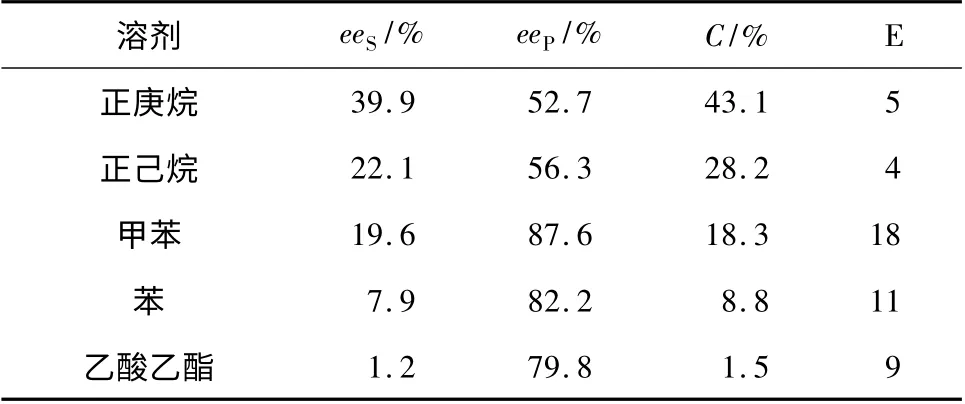
表5 溶剂对PSL/G-NH2-MCF 对映选择性的影响Table 5 Effects of solvent on the enantioselectivity of PSL/G-NH2-MCF
由表5 可知,固定化酶在不同极性的溶剂中有不同的催化活性,在极性较小的正庚烷中,eeP值为52.7%,随溶剂极性的增大,在甲苯中eeP值达到87.6%,反应的选择性也相对较好;溶剂极性继续增大,eeP值开始下降,在乙酸乙酯中下降至79.8%。可见选择甲苯溶剂较适宜。
2.6 底物摩尔比对PSL/G-NH2-MCF 催化性能的影响
由表6 可知,随着酰化剂乙酸乙烯酯物质量的增大,(S)-3-羟基丁酸乙酯的eeS和转化率C 逐渐增大,当摩尔比n(3-羟基丁酸乙酯)∶n(乙酸乙烯酯)=1 ∶1. 5 时,eeS、C 和对映选择性参数E 分别为17.8%,15.6%和61,(R)-3-乙酸基丁酸乙酯的eeP达到96.2%,继续增大乙酸乙烯酯的用量,导致eeP和E 持续降低,PSL/G-NH2-MCF 的对映选择性下降,不利于反应进行。
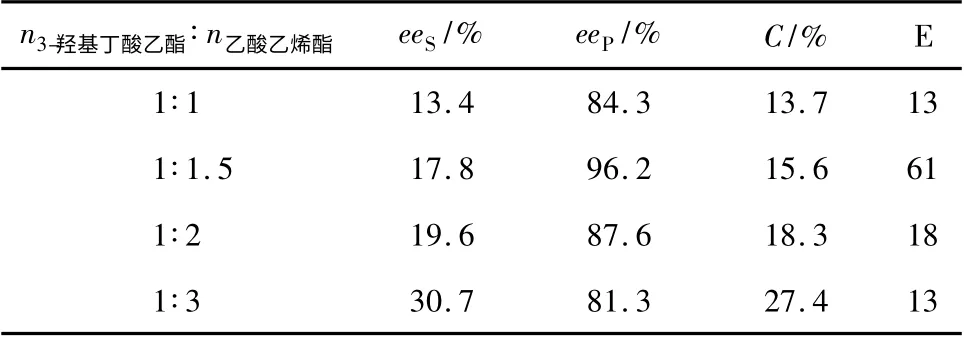
表6 底物摩尔比对PSL/G-NH2-MCF 对映选择性的影响Table 6 The effects of molar ratio of substrates on the enantioselectivity of PSL/G-NH2-MCF
3 结论
(1)PSL 催化(R,S)-3-羟基丁酸乙酯转酯化拆分反应时,优先催化底物中的(R)-3-羟基丁酸乙酯发生转酯化反应;PSL 经G-NH2-MCF 固定化后,其活性和对映选择性均得到大幅提高。
(2)PSL/G-NH2-MCF 催化(R,S)-3-羟基丁酸乙酯转酯化拆分反应,是一种环境友好的制备单一构型的3-羟基丁酸乙酯的新方法,在甲苯溶剂中,乙酸乙烯酯作酰化剂,反应48 h,(S)-3-羟基丁酸乙酯对映体过量值eeS和(R)-3-乙酸基丁酸乙酯的对映体过量值eeP分别为17.8%和96.2%,底物的转化率达15.6%。利用固定化酶进行二次拆分,以进一步提高单一对映体光学纯度的研究,尚在进行中。
[1] Alfaro Blasco M,Grger H. Enzymatic resolution of racemates with a‘remote’stereogenic center as an efficient tool in drug,flavor and vitamin synthesis[J]. Bioorganic& Medicinal Chemistry,2014,22(20):5539-5546.
[2] 张丹丹,闫翠勤,乔红梅.高效液相色谱法分离2-羟基-3-甲氧基-3,3-二苯基丙酸对映体[J].应用化工,2013(8):1544-1547.
[3] 卢定强,夏芙洁,王琦,等. 手性1-(1-萘基)乙胺的制备及其药物应用最新进展[J]. 现代化工,2014(5):30-34.
[4] 郁惠蕾,黄磊,倪燕,等. 羰基生物还原法合成手性醇的研究进展[J].生物加工过程,2013(3):71-82.
[5] Wang X,Yue D,Zong M,et al.Use of ionic liquid to significantly improve asymmetric reduction of ethyl acetoacetate catalyzed by acetobacter sp. CCTCC M209061 cells[J].Industrial & Engineering Chemistry Research,2013,52(35):12550-12558.
[6] 施介华,程向炜,周亮,等. 柱前衍生化法分离3-羟基丁酸乙酯光学异构体[J]. 分析化学,2007(5):714-718.
[7] 向忠权,韦志明,陈小鹏,等. 高效液相色谱法手性色谱柱分离3-羟基丁酸乙酯对映体[J].理化检验:化学分册,2014(2):214-216.
[8] Lee Y,Park S H,Lim I T,et al.Preparation of alkyl (R)-(- )-3-hydroxybutyrate by acidic alcoholysis of poly-(R)-(-)-3-hydroxybutyrate[J].Enzyme Microb Technol,2000,27(1/2):33-36.
[9] Wolfson A,Dlugy C,Tavor D,et al. Baker’s yeast catalyzed asymmetric reduction in glycerol[J]. Tetrahedron:Asymmetry,2006,17(14):2043-2045.
[10] Albuquerque P M,Witt M A,Stambuk B U,et al. Influence of sugars on enantioselective reduction using Saccharomyces cerevisiae in organic solvent[J]. Process Biochemistry,2007,42(2):141-147.
[11]王普,周丽敏,何军邀,等. 离子液体中酵母细胞不对称还原合成(R)-3-羟基丁酸乙酯[J]. 高校化学工程学报,2008(5):833-838.
[12]于明安,朱晓冰,祁巍,等.CTAB 透性化酵母细胞生物催化合成(S)-(+)-3-羟基丁酸乙酯[J]. 催化学报,2005(7):609-613.
[13]Fishman A,Eroshov M,Dee-Noor S S,et al. A two-step enzymatic resolution process for large-scale production of(S)-and (R)-ethyl-3-hydroxybutyrate[J].Bioorganic &Medicinal Chemistry,2014,20(22):5539-5546.
[14]Hanefeld U,Gardossi L,Magner E. Understanding enzyme immobilisation[J].Chem Soc Rev,2009,38(2):453-468.
[15]Chen C,Fujimoto Y,Girdaukas G,et al.Quantitative analyses of biochemical kinetic resolutions of enantiomers[J].Journal of the American Chemical Society,1982,25(104):7294-7299.
[16]汪海萍,魏荣卿,沈斌,等. 双醛淀粉柔性固定木瓜蛋白酶研究[J].生物加工过程,2004(1):25-29.
[17]冯长根,白林山,任启生.胺基化合物修饰戊二醛交联壳聚糖树脂的合成及其红外光谱研究[J]. 光谱学与光谱分析,2004(11):1315-1318.
