高血压脑出血患者炎性因子水平与预后的相关性分析
2015-12-24陈果,董伟
高血压脑出血患者炎性因子水平与预后的相关性分析
陈果董伟
重庆市第五人民医院神经外科重庆400062
【摘要】目的探讨高血压脑出血患者炎性因子水平与疾病预后的相关性。方法选取2010-06—2013-05间我院收治的86例高血压脑出血患者为研究对象,设为病例组;同时以匹配的方式选择同期于医院体检的健康者86例为健康对照组,采用酶联免疫吸附(ELISA)法和化学发光法检测血清肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白细胞介素-1 (interleukin-1,IL-1)、-6(interleukin-6, IL-6)及高敏C-反应蛋白(high-sensitivity c-reactive protein, hs-CRP)的含量,利用日常生活活动(activity of daily living scale,ADL)量表评价对患者预后状况。结果急性期治疗第1天病例组患者的TNF-α、IL-1、IL-6和hs-CRP水平均明显高于健康组(P<0.05);与治疗第1天相比,第7天健康组和病例组IL-1、IL-6和hs-CRP水平均无明显变化(P>0.05),而病例组仅TNF-α水平明显下降;恢复期治疗第14天,病例组的TNF-α、IL-1、IL-6和hs-CRP水平仍明显高于健康组(P<0.05),而与第14天相比,第28天健康组的各项指标均无明显变化(P>0.05),而病例组TNF-α、IL-1、IL-6和hs-CRP水平均明显降低(P<0.05)。Pearson相关分析结果显示,急性期IL-1、IL-6和TNF-α分别与白细胞数量呈现正相关关系,而与GCS评分和ADL评分呈负相关关系;hs-CRP则与白细胞数量、甘油三酯和低密度脂蛋白呈现正相关,与高密度脂蛋白和GCS评分和ADL评分呈负相关;而恢复期IL-1、IL-6、hs-CRP和TNF-α均与ADL评分呈现负相关关系,而其余指标则无明显相关。结论IL-1、IL-6、hs-CRP和TNF-α的水平高低可作为反映高血压脑出血患者疾病预后的潜在生物标志。
【关键词】高血压脑出血;炎性因子;疾病预后;相关性
【中图分类号】R743.34
近年来随着人口老年化的发展,脑血管疾病的发病率呈现逐年攀升的趋势。高血压脑出血是高血压病最严重的并发之一,也是临床上较为常见的脑血管急重症,具有高病死率和致残率的特点,主要表现为颅内血肿急性占位或颅内动脉血管的玻璃样、纤维样变性引发的局部出血或坏死[1]。众多学者认为[2],炎性因子水平的高低是影响高血压脑出血发病及预后的关键因素。流行病学研究也显示,高敏C反应蛋白(high-sensitivity c-reactive protein, hs-CRP)水平增高者发生急性脑血管疾病的发病风险值高于健康人高达2倍,如白细胞介素-1、-6(Interleukin-1,6,IL-1,-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量与脑血管疾病病情的严重程度亦密切相关[3-4]。然而,hs-CRP、IL-1、IL-6和TNF-α是否与高血压脑出血的预后相关尚不明确。本研究以我院诊治的86例高血压脑出血患者为研究对象,探讨四项炎性因子水平与疾病预后的相关性,以期为临床治疗方案制定和预后判定提供依据。
1资料与方法
1.1临床资料选取2010-06—2013-05我院收治的86例高血压脑出血患者为研究对象,男44例,女42例,年龄47~68岁,平均(56.69±7.12)岁。所有病例均符合1995年全国第4届脑血管病会议修订的诊断标准[5],经头颅影像学(CT或磁共振)检查确诊。高血压患者的纳入均依据世界卫生组织(WHO)制定的诊断标准[6],即收缩压>140 mmHg(1 mmHg=0.133 kPa),舒张压>90 mmHg。纳入标准:(1)首次发病,脑出血发生后24 h内入院治疗;(2)均接受手术治疗,幕上出血量>30 mL,幕下小脑出血量>于10 mL。排除标准:(1)出现脑疝等征象;(2)罹患恶性肿瘤、慢性感染性疾病、结缔组织疾病、甲状腺功能亢进或低下、严重营养不良者;(3)脑外伤、脑干出血或功能衰竭、周围血管疾病;(4)罹患其他出血性疾病或接受抗凝治疗;(5)肝肾功能严重异常者、有服用激素类药物史或治疗中出现明显并发症需要抗炎症治疗者。另外,以匹配的方式选取同期于医院体检的健康者86例为对照组,男女各43例,年龄45~66岁,平均(55.94±8.05)岁,2组患者在年龄、性别方面差异均无统计学意义(P>0.05),具有可比性。
1.2预后评定采用日常生活活动(activity of daily living scale,ADL)量表评价对患者预后状况。评价项目指标包括大小便、修饰、用厕、进食、转移、活动、穿衣、上下楼梯和洗澡等,总分100分,其中Ⅳ级:<20分为极严重的功能缺陷、生活无法自理;Ⅲ级:20~40分为生活需要较大帮助;Ⅱ级:40~60分为生活需要帮助;Ⅰ级:>60分为生活基本能够自理。对所有入选的高血压脑出血患者均在治疗过程中的采用格拉斯哥昏迷评分(glasgow coma scale,GCS)量表评定意识状态。
1.3炎性因子和血液生化指标检测所有入选研究对象均在治疗第1、7、14和28天时分别采集空腹静脉血液,采用酶联免疫吸附(ELISA)法测定血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1(interleukin-1, IL-1)和6(interleukin-6, IL-6)的浓度;利用化学发光法检测高敏C反应蛋白(high-sensitivity c-reactive protein, hs-CRP)的含量。检测试剂盒均购于上海瑞齐生物科技有限公司,操作过程严格按照说明书要求由专业技术人员执行完成。同时,利用全自动生化分析仪检测总胆固醇、甘油三脂、高密度脂蛋白、低密度脂蛋白、血小板和白细胞的水平。
1.4统计学分析数据的整理和分析均采用SPSS 17.0软件。计量资料均利用均数±标准差的形式表示,2组间的比较采用独立样本的Student-t检验,多时间点之间的比较则应用重复测量的方差分析,两两比较采用LSD-t检验,对于符合双变量正态分布的资料利用Pearson相关分析,不符合的则采取Spearman相关分析,P<0.05为差异有统计学意义。
2结果
2.1一般资料86例患者中,高血压病程2~15 a,平均(10.85±2.14)a,平均出血量为(49.18±10.27)mL,GCS评分(7.02±1.21)分,出血部位:基底节区64例,额叶14例,颞叶6例,小脑2例,高血压临床分级:Ⅰ级10例,Ⅱ级22例,Ⅲ级36例,Ⅳ级18例。
2.22组患者急性期炎性因子指标比较如表1所示,急性期治疗第1天病例组患者的TNF-α、IL-1、IL-6和hs-CRP水平均明显高于健康组,差异均具有统计学意义(P<0.05);与治疗第1天相比,第7天健康组和病例组IL-1、IL-6和hs-CRP水平均无明显变化(P>0.05),而病例组仅TNF-α水平明显下降,差异有统计学意义(P<0.05)。
表1 2组患者急性期炎性因子指标比较 ( ± s)
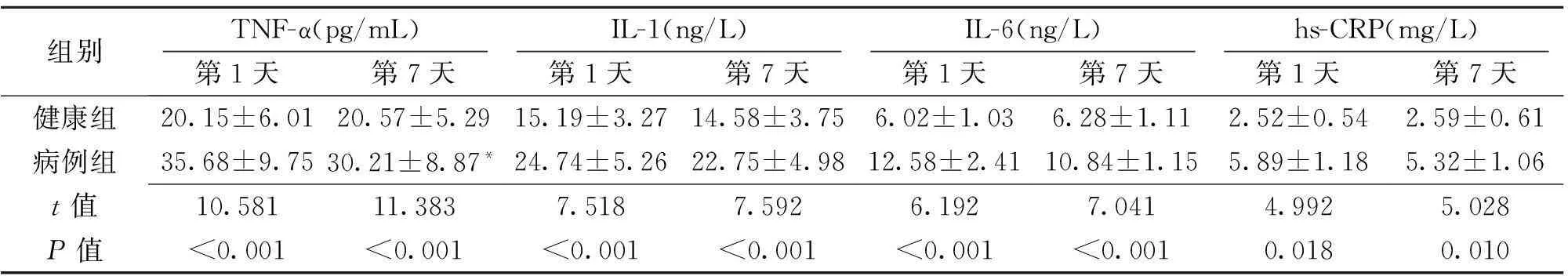
表1 2组患者急性期炎性因子指标比较 ( ± s)
组别TNF-α(pg/mL)IL-1(ng/L)IL-6(ng/L)hs-CRP(mg/L)第1天第7天第1天第7天第1天第7天第1天第7天健康组20.15±6.0120.57±5.2915.19±3.2714.58±3.756.02±1.036.28±1.112.52±0.542.59±0.61病例组35.68±9.7530.21±8.87*24.74±5.2622.75±4.9812.58±2.4110.84±1.155.89±1.185.32±1.06t值10.58111.3837.5187.5926.1927.0414.9925.028P值<0.001<0.001<0.001<0.001<0.001<0.0010.0180.010
注:与第1天比较,*P<0.05
2.32组患者恢复期炎性因子指标比较如表2所示,恢复期治疗第14天,病例组的TNF-α、IL-1、IL-6和hs-CRP水平仍明显高于健康组(P<0.05),而与第14天相比,第28天健康组的各项指标均无明显变化(P>0.05),而病例组TNF-α、IL-1、IL-6和hs-CRP水平均明显降低(P<0.05)。
表2 2组患者急性期炎性因子指标比较 ( ± s)
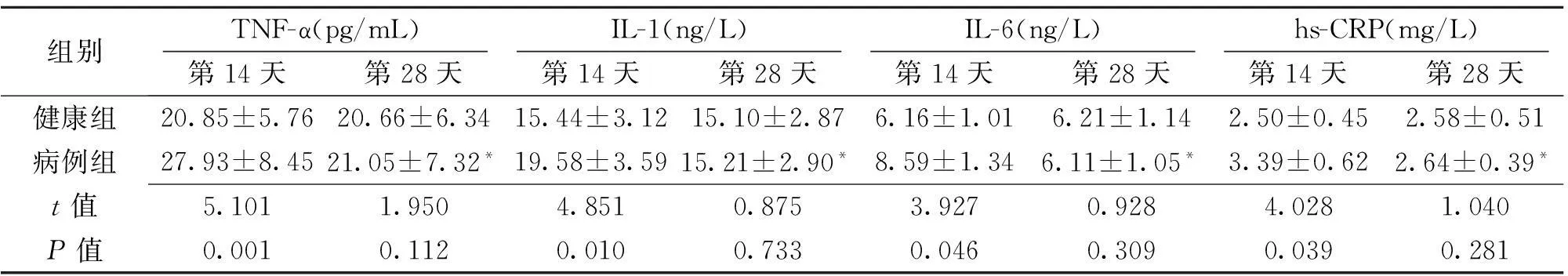
表2 2组患者急性期炎性因子指标比较 ( ± s)
组别TNF-α(pg/mL)IL-1(ng/L)IL-6(ng/L)hs-CRP(mg/L)第14天第28天第14天第28天第14天第28天第14天第28天健康组20.85±5.7620.66±6.3415.44±3.1215.10±2.876.16±1.016.21±1.142.50±0.452.58±0.51病例组27.93±8.4521.05±7.32*19.58±3.5915.21±2.90*8.59±1.346.11±1.05*3.39±0.622.64±0.39*t值5.1011.9504.8510.8753.9270.9284.0281.040P值0.0010.1120.0100.7330.0460.3090.0390.281
注:与第14天比较,*P<0.05
2.4炎性因子水平与其他指标的相关性
2.4.1急性期炎性因子水平与其他指标的相关性:如表3所示,Pearson相关分析结果显示,IL-1和IL-6分别与白细胞数量呈现正相关关系,而与GCS评分和ADL评分呈负相关关系;TNF-α亦与白细胞数量呈现正相关关系,而与GCS评分和ADL评分呈负相关关系;hs-CRP则与白细胞数量、甘油三酯和低密度脂蛋白呈现正相关,与高密度脂蛋白和GCS评分和ADL评分呈负相关。
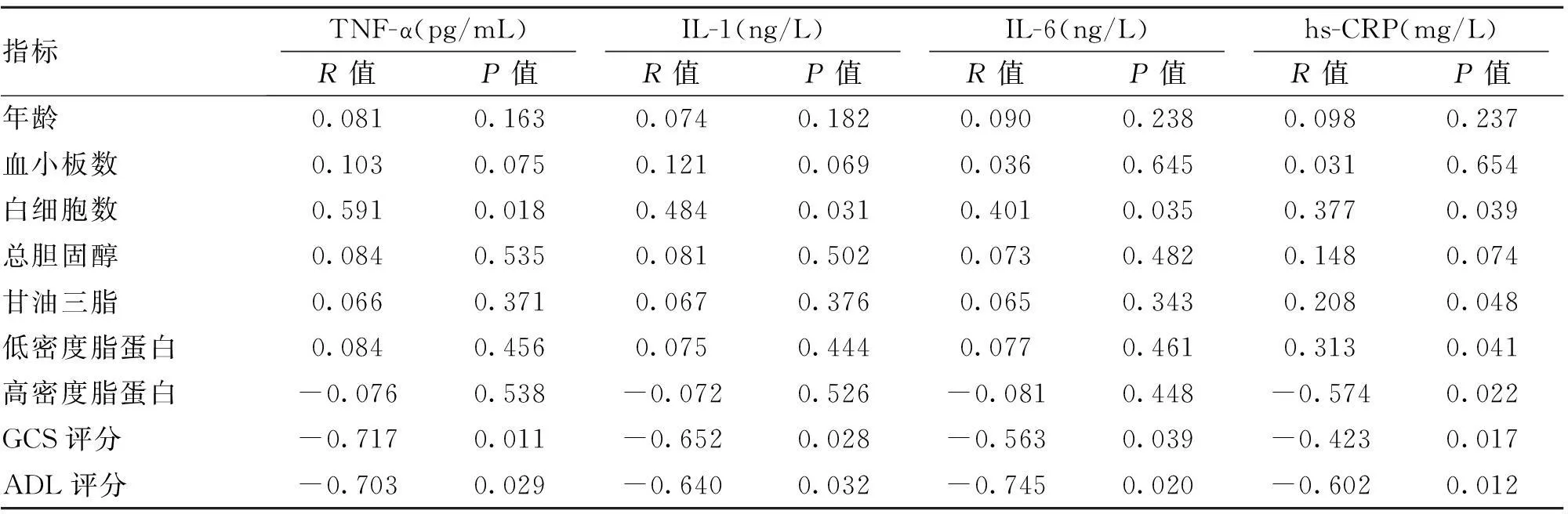
表3 患者急性期炎性因子水平与其他指标的相关性
2.4.2恢复期炎性因子水平与其他指标的相关性:如表4所示,相关分析法结果显示,在恢复期IL-1、IL-6、hs-CRP和TNF-α均与ADL评分呈现负相关关系,而其余指标则无明显相关。

表4 患者恢复期炎性因子水平与其他指标的相关性
3讨论
研究发现,高血压脑出血患者的病理机制主要是由颅内局部供血的小动脉灌流减少或中断所引起,常导致缺血、坏死或血肿性占位效应的结局,进而损伤脑组织并带来一系列如认知功能障碍、生活自理能力降低等临床症状。但是,不论是机体细胞的损伤还是修复机制都不可避免地需要细胞因子来参与,因而必然会引起血清中如炎性因子等细胞因子水平的改变。重要的是,这些炎性因子水平的高低还与疾病的发展及其预后有密切关系[7]。本研究就此展开对IL-1、IL-6、TNF-α和hs-CRP四种炎性因子与高血压脑出血预后的关系探讨,具有十分重要的临床指导意义和研究价值。
IL-1和IL-6都是细胞内的急性反应蛋白,均属于白细胞介素家族。有学者发现,高血压脑出血可诱发血液中的白细胞发生浸润,促使机体产生白细胞,导致炎症反应[8-9]。本研究发现,在治疗第1天,病例组患者的IL-1和IL-6水平均高于健康组,提示高血压脑出血患者出现明显的炎症应激反应。而且,随着时间的推移和治疗的进展,IL-1和IL-6水平珠江下降,呈现时间效应关系,充分表明高血压脑出血患者颅内组织损伤与IL-1和IL-6的释放增加相关。相关分析结果也显示,IL-1和IL-6均与白细胞数量、GCS评分和ADL评分呈现相关关系,说明脑出血患者的脑损伤都能够通过刺激IL-1和IL-6水平增加,激活免疫系统以缓解或改善脑功能缺损。作为与IL-6相互作用的分子之一,TNF-α也被认为是炎性反应启动的关键分子,也是诱导IL-6产生,上调IL-6水平的主要细胞因子[10]。值得注意的是,IL-6对TNF-α也具有负反馈调节作用。在颅内发生血肿性占位时,各种炎性因子的释放均可增加神经元损伤的风险,导致病灶的增大,因此TNF-α等炎性因子的水平与疾病的严重程度密切相关。本研究发现病例组的TNF-α含量在治疗开始时明显高于健康组,并随治疗时间的推移逐渐降低,该结果充分印证了这一理论。而且,相关分析的结果也发现,急性期TNF-α水平与白细胞数量呈现正相关关系,与GCS评分和ADL评分呈负相关关系,充分表明TNF-α与疾病的严重程度和预后密切相关。hs-CRP是在肝脏内合成的急性反应时相蛋白,被认为是与动脉粥样硬化和炎性损伤密切相关的一种重要炎性因子[11-12]。本研究结果显示,治疗第1天病例组hs-CRP明显高于健康组,同时与GCS呈负相关,提示发病后较高水平hs-CRP神经功能损伤更严重,而且hs-CRP水平越高,患者的预后也越差,主要表现为ADL评分值在高水平hs-CRP时更低。由此可见,hs-CRP水平的高低与高血压脑出血的严重程度和预后紧密相关。
4参考文献
[1]Biessels GJ, Zwanenburg JJ, Visser F, et al.Hypertensive cerebral hemorrhage: imaging the leak with 7-T MRI[J]. Neurology,2010,75(6):572-573.
[2]Zuo Y, Cheng G, Gao DK, et al.Gross-total hematoma removal of hypertensive basal ganglia hemorrhages: a long-term follow-up[J].J Neurol Sci,2009,287(1/2):100-104.
[3]Wei P, You C, Jin H, et al. Correlation between serum IL-1beta levels and cerebral edema extent in a hypertensive intracerebral hemorrhage rat model [J]. Neurol Res,2014, 36(2):170-175.
[4]Jalal FY, Yang Y, Thompson J, et al. Myelin loss associated with neuroinflammation in hypertensive rats [J]. Stroke,2012, 43(4):1115-1522.
[5]何瑞深, 王锡铭, 魏建功. 高血压脑出血患者的临床分析[J]. 检验医学与临床, 2013, 10(15): 1993-1994.
[6]Rabi D M, Daskalopoulou S S, Padwal R S, et al. The 2011 Canadian hypertension education program recommendations for the management of hypertension: blood pressure measurement, diagnosis, assessment of risk, and therapy [J]. Can J Cardiol, 2011, 27(4): 415-433.
[7]伍嘉坚,詹彩文.血清炎性细胞因子在急性脑出血并中枢性高热的表达及意义[J].中国实用神经疾病杂志, 2010,13(11):10-12.
[8]Howren MB, Lamkin DM, Suls J. Associations of depression with C-reactive protein, IL-1, and IL-6: a meta-analysis [J]. Psychosom Med,2009, 71(2):171-186.
[9]Singhal G, Jaehne EJ, Corrigan F, et al. Inflammasomes in neuroinflammation and changes in brain function: a focused review [J]. Front Neurosci,2014; 8(1):315.
[10]Trigo FM, Luizon MR, Dutra HS, et al. Interaction between IL-6 and TNF-α genotypes associated with bacteremia in multiple myeloma patients submitted to autologous stem cell transplantation (ASCT) [J].Leuk Res Rep, 2014; 3(2):76-78.
[11]Onitilo AA, Engel JM, Stankowski RV, et al. High-sensitivity C-reactive protein (hs-CRP) as a biomarker for trastuzumab-induced cardiotoxicity in HER2-positive early-stage breast cancer: a pilot study [J]. Breast Cancer Res Treat,2012, 134(1):291-298.
[12]Wang X, Du Y,Fan L,et al.Relationships between HDL-C, hs-CRP, with central arterial stiffness in apparently healthy people undergoing a general health examination[J].PLoS One,2013, 8(12):e81 778.
(收稿2014-12-12)
