替莫唑胺对人脑胶质瘤细胞生物活性的影响
2015-12-22王建文陈治标吴津成湖北荆州中心医院泌尿外科荆州434020武汉大学人民医院神经外科武汉430000
王建文 陈治标 吴津成湖北荆州中心医院泌尿外科 荆州 434020 2)武汉大学人民医院神经外科 武汉 430000
替莫唑胺对人脑胶质瘤细胞生物活性的影响
王建文1)陈治标2)△吴津成1)
1)湖北荆州中心医院泌尿外科 荆州 434020 2)武汉大学人民医院神经外科 武汉 430000
目的 探讨替莫唑胺(Temozolomide,TMZ)及其衍生物对人脑胶质瘤细胞生物活性的影响,为人脑胶质瘤的治疗提供理论指导。方法 制备TMZ衍生物2-替莫唑胺-8-羧酸聚乙二醇脂(2T-P400、2T-P600),观察不同浓度TMZ及其衍生物在胶质瘤细胞系SHG-44体外抑瘤中的作用。结果 随着终浓度的上升,TMZ、PEG400、PEG600对细胞生长的抑制率呈上升趋势,相同终浓度TMZ对细胞生长的抑制率均显著高于PEG400及PEG600(P<0.05);随着终浓度的上升,2T-P400、2T-P600对细胞生长的抑制率呈上升趋势,相同终浓度2T-P400与2T-P600对细胞体外生长的抑制率差异无统计学意义(P>0.05);2T-P400、2T-P600的IC50略高于TMZ,但差异无统计学意义(P>0.05),PEG400、PEG600的IC50均显著高于其他3种药物。结论 TMZ能够显著降低人脑胶质瘤细胞的生物活性,其衍生物2T-P400、2T-P600具有相似的抑瘤效应和更高的水溶性,为降低患者治疗过程中胃肠道不良反应、延长其生存预期提供了方向。
脑胶质瘤;替莫唑胺;细胞;生物活性
脑胶质瘤全称为脑胶质细胞瘤,是一种颅内肿瘤,良性脑胶质瘤患者病程长、症状不明显,而恶性脑胶质瘤患者瘤体生长快、进展迅速,病死率极高[1]。替莫唑胺(Temozolomide,TMZ)是一种化疗药物,对脑胶质瘤细胞繁殖有良好的抑制作用,但其水溶性较低,使单次注射浓度受到影响,导致疗效有所减弱[2]。而TMZ衍生物2-替莫唑胺-8-羧酸聚乙二醇脂(2T-P400、2T-P600)具有较高的稳定性和水溶性,有望在脑胶质瘤的治疗中加以应用。为探讨其对人脑胶质瘤细胞生物活性的影响,笔者进行了相关研究,现报告如下。
1 材料与方法
1.1 实验材料 选取本实验室自行建系培养的人脑胶质瘤体外细胞系SHG-44,主要试剂及设备包括:DMEM培养基(美国Invitrogen公司)、96孔细胞培养板(大连百奥思科生物科技有限公司)、二甲基亚砜(DMSO,北京市化学试剂厂)、小牛血清(上海怡成生物科技有限公司)、四甲基偶氮唑蓝(MTT,美国Sigma公司)、胰蛋白酶(德国Merck公司)、CO2细胞培养箱(法国Joual公司)、超净工作台(上海博迅实业公司)、酶联免疫检测仪(南京华东电子集团医疗装备有限责任公司)等。
1.2 实验操作
1.2.1 TMZ衍生物制备:将1分子水溶性高分子聚合物PEG400或PEG600(天津天士力药物研究院)与2分子TMZ聚合,在缩水剂作用下,脱水缩合即可形成2T-P400或2TP600,使用聚乙二醇调整2T-P400、2T-P600水溶性至合适范围后[3],使用60Co灭菌照射,-70℃保存待用。
1.2.2 细胞复苏及培养:将SHG-44细胞解冻复苏,置于DMEM培养液中,并在室温、5%CO2环境中进行培养,每隔1d换液1次,每隔3d使用EDTA-胰蛋白酶进行消化、传代培养。
1.3 检测方法
1.3.1 细胞生长抑制率:将SHG-44人脑胶质瘤细胞系接种至96孔板内(1×104个/mL,100μL),分为6组,分别为TMZ组、2T-P400组、2T-P600组、PEG400组、PEG600组及空白对照组,使用MTT比色法,比较各组各孔570nm处吸光度(OD)值,并计算细胞生长抑制率。细胞生长抑制率[4]=(空白对照组OD值-待测组OD值)/空白对照组OD值×100%。
1.3.2 半数抑制浓度:采用改良窛氏法对药物半数抑制浓度(lgIC50)进行计算,lgIC50=Xm-I(P-(3-Pm-Pn)/4),其中Xm=1g最大剂量,I=最大剂量/相邻剂量,P=阳性反应率之和,Pm=最大阳性反应率,Pn=最小阳性反应率。生物活性影响的判断参照文献[5]:若IC50≤10μg/mL视为具有明显体外杀伤活性。
1.4 统计学分析 采用SPSS 13.0进行统计学分析,计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TMZ、PEG400、PEG600对细胞生长的抑制率 随着终浓度的上升,TMZ、PEG400、PEG600对细胞生长的抑制率呈上升趋势,相同终浓度TMZ对细胞生长的抑制率均显著高于PEG400及PEG600(P<0.05)。见表1。
表1 不同终浓度TMZ、PEG400、PEG600对人脑胶质瘤细胞体外生长的抑制率 (%,±s)

表1 不同终浓度TMZ、PEG400、PEG600对人脑胶质瘤细胞体外生长的抑制率 (%,±s)
注:与TMZ比较,aP<0.05
药物 终浓度(μmol/L)10 25 50 100 200 TMZ 21.87±0.62 29.41±2.36 47.01±4.92 67.94±1.87 80.03±1.59 PEG400 1.23±0.48a1.17±0.23a4.36±2.98a4.74±2.59a9.03±1.74aPEG600 1.87±0.92a2.46±0.53a4.58±1.74a5.46±0.87a6.55±2.10a
2.2 2T-P400、2T-P600对细胞生长的抑制率 随着终浓度的上升,2T-P400、2T-P600对细胞生长的抑制率呈上升趋势,相同终浓度2T-P400与2T-P600对细胞体外生长的抑制率差异无统计学意义(P>0.05)。见表2。
表2 不同终浓度2T-P400、2T-P600对人脑胶质瘤细胞体外生长的抑制率 (%,±s)
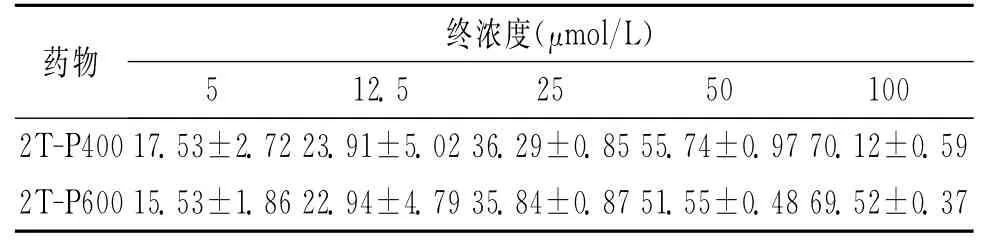
表2 不同终浓度2T-P400、2T-P600对人脑胶质瘤细胞体外生长的抑制率 (%,±s)
药物 终浓度(μmol/L)5 12.5 25 50 100 2T-P400 17.53±2.72 23.91±5.02 36.29±0.85 55.74±0.97 70.12±0.59 2T-P600 15.53±1.86 22.94±4.79 35.84±0.87 51.55±0.48 69.52±0.37
2.3 半数抑制浓度 2T-P400、2T-P600的IC50略高于TMZ,但差异无统计学意义(P>0.05),PEG400、PEG600的IC50均显著高于其他3种药物。见表3。
表3 各药物对人脑胶质瘤细胞半数抑制浓度比较 (μg/mL,±s)

表3 各药物对人脑胶质瘤细胞半数抑制浓度比较 (μg/mL,±s)
药物IC50 TMZ 9.89±0.35 2T-P400 12.7±0.29 2T-P600 15.5±0.27 PEG400 169.2±2.97 PEG600 175.3±6.43
3 讨论
脑胶质瘤占颅内肿瘤发病率的45%以上,恶性脑胶质瘤世界范围内35岁以下病死率居第2位,多数患者在患病6个月内即出现严重症状,且术后复发率较高[6],因此,有效的治疗药物合成是临床研究的重点。TMZ在近年来脑胶质瘤的治疗中得到广泛应用,其作用机制明确、血脑屏障通过率高等优势使得患者生存预期得到明显延长,但TMZ可导致明显胃肠道反应,影响患者依从性。有学者提出使用TMZ衍生物静脉给药方案,而TMZ较低的水溶性为高浓度注射剂的开发造成了较大阻碍[7]。
大量实验已证明,TMZ 8-位取代衍生物具有良好的抑瘤效应,而TMZ-8-羧酸在缩合剂作用下可与PEG的羧基脱水缩合,从而使TMZ具有水溶性。为探讨TMZ及其衍生物的体外抑瘤效果,笔者对TMZ及其衍生物在SGH-44人脑胶质瘤细胞生长抑制中的作用进行了相关实验,发现随着终浓度的上升,TMZ、PEG400、PEG600对细胞生长的抑制率呈上升趋势,相同终浓度TMZ对细胞生长的抑制率均显著高于PEG400及PEG600(P<0.05),且随着终浓度的上升,2T-P400、2T-P600对细胞生长的抑制率呈上升趋势,相同终浓度2T-P400与2T-P600对细胞体外生长的抑制率无明显差异(P>0.05);在IC50的分析中,我们发现2T-P400、2TP600的IC50略高于TMZ,但无明显差异(P>0.05),PEG400、PEG600的IC50均显著高于其他3种药物。说明TMZ、2T-P400及2T-P600均具有良好的抑瘤效应,能够显著降低人脑胶质瘤细胞的生物活性。TMZ是2代咪唑四嗪衍生物,其抑瘤效应主要借助TMZ细胞毒性导致的DNA甲基化和错配修复失败,在口服TMZ后,患者内源性血管生成抑素水平显著上升[8],使得新生肿瘤血管形成受到阻碍,且促进了肿瘤内皮细胞的凋亡,作为一类TMZ衍生物,2TP400及2T-P600亦具有相同的抑瘤机制,且在合成中,通过改变PEG的分子量能够良好地控制其水溶性,同时,研究可见,PEG对脑胶质瘤组织的抑制作用不明显,其与TMZ结合并不会影响疗效,因此,我们认为,TMZ衍生物较TMZ具有更明显的优势,亦具有更佳的应用前景。2T-P400、2TP600良好的水溶性和稳定性使得将TMZ类药物制成高浓度注射剂,有助于多渠道给药,以降低胃肠道不良反应的发生率,改善患者治疗体验[9];TMZ类药物水溶性的提高,有望促进脑胶质瘤腰椎穿刺蛛网膜下腔局部给药的实施,从而避开血脑屏障,有助于抑制脑胶质瘤的全身扩散,提高患者生存预期[10]。需要指出的是,本研究全部实验均在体外进行,与体内环境存在一定差异,因此,TMZ衍生物对人脑胶质瘤的体内治疗效果仍有待进一步动物实验研究和改进。
综上所述,TMZ能够显著降低人脑胶质瘤细胞的生物活性,其衍生物2T-P400、2T-P600具有相似的抑瘤效应和更高的水溶性,为降低患者治疗过程中胃肠道不良反应、延长其生存预期提供了研究方向。
[1]Warren KE,Gururangan S,Geyer JR,et al.A phaseⅡstudy of O6-benzylguanine and temozolomide in pediatric patients with recurrent or progressive high-grade gliomas and brainstem gliomas:a Pediatric Brain Tumor Consortium study[J].J Neurooncol,2012,106(3):643-649.
[2]孙爽,李鸿彬.替莫唑胺治疗脑转移瘤研究进展[J].人民军医,2011,54(3):235-236.
[3]肖勇辉,郑志坚,曾黄辉.替莫唑胺联合放疗治疗脑转移瘤的临床研究[J].肿瘤药学,2013,3(2):122-125.
[4]Blough MD,Beauchamp DC,Westgate MR,et al.Effect of aberrant p53function on temozolomide sensitivity of glioma cell lines and brain tumor initiating cells from glioblastoma[J].J Neurooncol,2011,102(1):1-7.
[5]魏磊.三维适形放疗联合替莫唑胺治疗在脑胶质瘤术后应用的效果观察[J].中国医药指南,2012,10(27):196-197.
[6]Lee EQ,Puduvalli VK,Reid JM,et al.Phase I study of vorinostat in combination with temozolomide in patients with highgrade gliomas:North American brain tumor consortium study 04-03[J].Clin Cancer Res,2012,18(21):6 032-6 039.
[7]陈云鹏,张弩,丁之明,等.敲低Aurora A基因增强替莫唑胺抗人脑胶质瘤U87细胞的作用[J].中国神经精神疾病杂志,2012,38(5):284-288.
[8]Albanese C,Alzani R,Amboldi N,et al.Anti-tumour efficacy on glioma models of PHA-848125,a multi-kinase inhibitor able to cross the blood-brain barrier[J].Br J Pharmacol,2013,169(1):156-166.
[9]唐东方,董军,黄强,等.替莫唑胺衍生物治疗人脑胶质瘤的实验研究[J].中国微侵袭神经外科杂志,2012,17(3):124-126.
[10]Chen J,Li Y,Yu TS,et al.A restricted cell population propagates glioblastoma growth after chemotherapy[J].Nature,2012,488(7 412):522-526.
(收稿2014-08-10)
R730.264
A
1673-5110(2015)11-0035-03
△通讯作者:陈治标,博士,主任医师,研究方向:神经外科学,E-mail:chenzbiaoh@126.com
