Poloxamer 407凝胶上铜绿假单胞菌药物敏感性分析*
2015-12-22李林彧敖弟书
宋 鸿,李林彧,敖弟书
(遵义医学院微生物学教研室,贵州遵义 563099)
基础医学研究
Poloxamer 407凝胶上铜绿假单胞菌药物敏感性分析*
宋 鸿,李林彧,敖弟书
(遵义医学院微生物学教研室,贵州遵义 563099)
目的建立一种新型Poloxamer 407(P407)温敏性即型凝胶培养体系,以探讨P407凝胶对铜绿假单胞菌药物敏感性的影响。方法临床分离17株铜绿假单胞菌,采用改良K-B纸片法检测细菌药物敏感性;通过RT-PCR、扫描电镜(Scanning electronmicroscopy,SEM)观察在P407和传统琼脂培养基中细菌生物膜形成情况。结果药敏结果显示在两种培养基上抑菌圈大小有显著差异(P<0.05);SEM下可见传统琼脂培养基上有大量杆状细菌,而在P407培养基上可见这些杆状细菌聚集在一起,被细胞外基质所包裹;RT-PCR结果显示,在P407培养基上algC和algD基因有明显表达,并随培养时间的延长逐渐增强。结论P407作为一种细菌培养基赋形剂,可用于临床药物敏感试验筛选。
Poloxamer 407;铜绿假单胞菌;抑菌圈;细菌生物膜;药物敏感性
P407是一种温敏性即型凝胶,由约70%的聚乙烯氧化物和30%的聚丙烯氧化物组成的嵌段共聚物,易溶于水,在最低临界溶解温度15℃以下,P407为溶液态,当温度高于临界温度时,P407由溶液态转为凝胶态。P407具有良好的安全性及生物相容性,并且容易获得,因此得到广泛应用[1-2]。国外从20世纪80年代开始就对P407凝胶进行了研究,但国内关于P407凝胶的研究和应用尚处于新兴期,且研究领域狭窄,主要在药剂学中得到应用[3]。近来有研究发现,P407凝胶可作为一种细菌培养基赋形剂,在P407凝胶培养基上细菌可形成生物膜[4-5],其生理学特点更加接近于在体内生长时的特点。因此,本研究通过建立一种新型P407温敏性即型凝胶培养体系,采用改良K-B纸片扩散法检测抗菌药物敏感性,探讨在不同培养基赋形剂下铜绿假单胞菌药物敏感试验结果的差异性,旨在为临床合理选择抗生素提供参考。
1 材料与方法
1.1 细菌来源 收集我院自2011年7月~12月各科室患者的痰液、尿液、伤口分泌物等临床标本82份,常规分离细菌108株,并采用法国生物梅里埃公司的全自动微生物分析仪进行鉴定,有17株为铜绿假单胞菌。
1.2 主要试剂 MH琼脂培养基购自杭州天和微生物试剂公司。药敏纸片购自英国Oxoid公司,Poloxamer 407购自上海力明生物工程有限公司。RT-PCR逆转录试剂盒为Fermentas公司生产。戊二醛为德国巴斯夫公司生产。其余试剂均为国产分析纯。
1.3 主要仪器 全自动微生物生化分析仪(法国生物梅里埃公司,VITEK2),多功能梯度PCR仪(美国Bio-Rad公司,S1000TM),扫描电子显微镜(日本日立公司,S-3000N)。
1.4 试验方法
1.4.1 P407培养基制备 将P407与MH肉汤培养基混合,终浓度为30%,充分搅拌后置于4℃冰箱过夜,待完全溶解后调整pH至7.2~7.4,高压灭菌,放置4℃冰箱过夜使其再次完全溶解,在使用前将其迅速倒入平皿,放置35℃培养箱,待完全凝固后备用。
1.4.2 药敏试验 采用改良K-B纸片法[6],测定17株铜绿假单胞菌对氨苄西林舒巴坦(Ampicillin-sulbactam,SAM)、亚胺培南(Imipenem,IPM)、美罗培南(Meropenem,MEPM)、庆大霉素(Gentamycin,CN)、环丙沙星(Ciprofloxacin,CIP)、左氧氟沙星(Levofloxacin,LVFX)、头抱曲松(Ceftriaxone,CRO)、头抱他啶(Ceftazidime,CAZ)、阿米卡星(Amikacin,AMK)和氨曲南(Aztreonam,AZT)的药物敏感性。
1.4.3 RT-PCR 取培养1、3和7 d的6株铜绿假单胞菌,提取总RNA,经逆转录后进行PCR反应,检测铜绿假单胞菌生物膜形成相关基因(algC和algD)在MH琼脂培养基和P407培养基上的表达情况。以基因ropD做内参照。PCR扩增条件: 94℃变性3 min;94℃变性3 s;algC、algD和ropD基因依次于60℃、60℃和45℃退火30 s;72℃延伸45 s;循环35次后,72℃延伸10min。引物序列(见表1)。
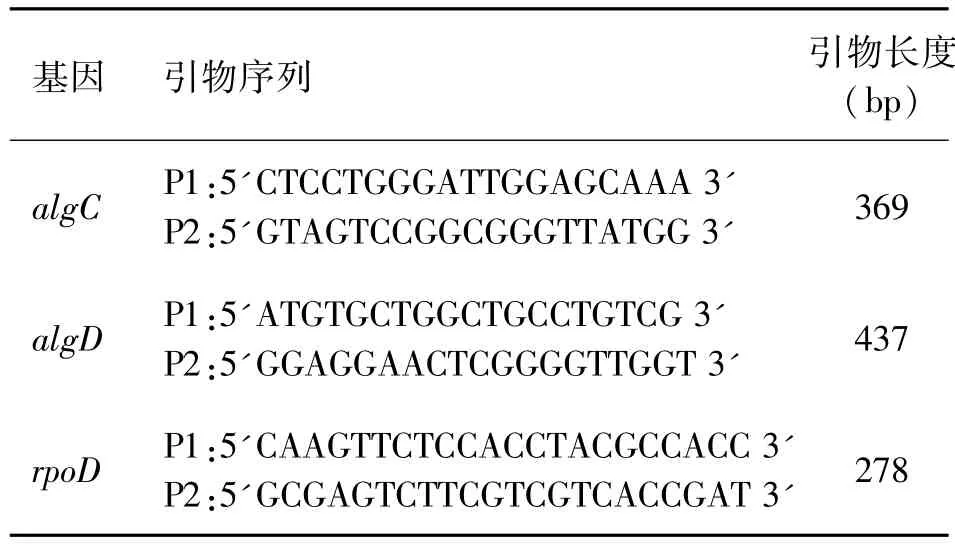
表1 PCR引物序列及产物长度
1.4.4 扫描电镜观察 将6株铜绿假单胞菌制成菌悬液,接种于滤膜上,再将滤膜分别置于P407培养基和MH培养基上,放入37℃培养箱孵育72 h。将滤膜取出,置于3%戊二醛中,在4℃冰箱固定24 h,用PBS缓冲液冲洗3次,梯度乙醇脱水,醋酸异戊醋置换,CO2临界点干燥,离子喷金镀膜,在SEM下进行观察。
1.5 统计学处理 所有数据采用SPSS 12.0统计软件处理。各组间的比较采用配对t检验,结果以均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 药敏试验结果 17株铜绿假单胞菌临床分离菌株药物敏感试验结果见表2。除铜绿假单胞菌SAM、AMK纸药片在P407培养基上抑菌圈大于MH琼脂培养基外,其余抗菌药物在P407培养基上的抑菌圈均小于MH琼脂培养基上的抑菌圈(P<0.05)。

表2 铜绿假单胞菌药物敏感试验结果(抑菌圈直径,mm)
2.2 RT-PCR结果 由图1结果可知,在P407培养基上algC和algD基因有明显表达,并随培养天数的延长逐渐增强,而在MH琼脂培养基上,algC和algD基因未见明显表达。

图1 RT-PCR检测两种培养基上铜绿假单胞菌生物膜相关基因表达情况
2.3 扫描电镜观察结果 通过SEM观察可见:在MH琼脂培养基上(见图2A)有大量生长的杆状细菌,细菌间的间隙清楚,而在P407凝胶培养基上(见图2B),这些杆状细菌聚集在一起,并被细胞外基质包裹成团。

图2 扫描电镜观察两种培养基上铜绿假单胞菌生物膜情况
3 讨论
铜绿假单胞菌是医院感染重要的条件致病菌,近年来研究显示该菌在感染机体中常以生物膜形式存在[7]。生物膜是一种细菌聚集群体,是细菌为了适应生存环境黏附于惰性或活性实体表面,并繁殖、分化、分泌大量胞外基质黏附成团,所形成一种与浮游细菌相对应的,具有特殊微环境的结构性细菌群落。细菌形成生物膜后无论其形态结构、生理生化特性、致病性,还是对环境因子的敏感性等都与浮游细菌有显著的不同[8-9]。研究发现细菌形成生物膜后,其耐药性增强,所需杀菌药物的浓度往往是浮游细菌的10~1 000倍[10]。因此,细菌形成的生物膜是细菌易产生耐药性的重要因素之一[11]。目前临床上所使用的传统药物敏感试验常常测定的是浮游细菌对抗菌药物的敏感性,却忽略了在感染机体中细菌形成生物膜后其药物敏感性发生了改变,这就导致了只依据传统方法测定的最低抑菌浓度(minmum inhibitory concentration,MIC)来指导临床抗菌药物的使用,往往很难达到满意的临床疗效。
一般来说,细菌生物膜对抗菌药物的抵抗作用起始于早期的黏附阶段,并随生物膜的生长其抗药性逐渐增强。临床实验室抗菌药物敏感性检测的标准方法是测定抗菌药物的MIC,但此方法仅仅适用于浮游菌,对于可以形成生物膜的细菌,则结果不准确。在试验中我们发现,P407药物敏感培养体系中的抑菌圈普遍小于琼脂培养体系,也就是说在P407培养体系中细菌对抗菌药物的抗药性明显增高。这表明在两种不同培养基介质中生长的细菌对抗菌药物的敏感性发生了表型变异。通过扫描电镜可见在P407凝胶培养基上细菌聚集成团,且聚集的细菌表面被大量细胞外基质所包裹,形成细菌生物膜的形态特征,而在琼脂培养基上细菌虽然聚集在一起,但在细菌表面没有见到明显包裹的细胞外基质。因此,我们推测细菌药物敏感性发生明显差异的现象,可能是由于在不同赋形剂培养基中细菌生长方式发生改变所导致的。
细菌表型的改变与其生长方式、基因表达及蛋白质的产生有关。就现有资料来看,藻酸盐是构成铜绿假单胞菌生物膜的主要成份之一,它可以通过调节中性粒细胞蛋白激酶C水平来改变信号传导途径,它对生物膜的形成、结构维持及营养支持等方面都有重要作用[12]。当铜绿假单胞菌到达物体表面或进入机体时,即可启动控制合成该物质的基因表达。研究发现algC和algD基因与藻酸盐合成密切相关[13]。本试验结果显示,在P407凝胶培养基上algC和algD基因有明显表达,并随时间的延长逐渐增强,而在MH琼脂培养基上未见algC和algD基因明显表达,这提示在P407凝胶培养基上铜绿假单胞菌合成的藻酸盐增多,可形成细菌生物膜。
总之,在临床药敏筛选试验时需考虑到在体内的细菌会形成生物膜,特别是在对一些反复感染或难治性感染药敏筛选试验中应考虑到细菌生物膜的形成。P407具有良好的生物相容性及安全性,有望作为一种新型的药敏筛选培养基赋形剂。对于P407药物敏感培养体系中抗菌药物的使用浓度、对抑菌圈大小及药物敏感性的结果判断等问题,还有待进一步研究。
[1]He C,Kin SW,Lee D S.In situ gelling stimuli-sensitive block copolymer hydrogels for drug delivery[J].J Control Release,2008,127(3):189-207.
[2]Mayol L,Quaglia F,Borzacchiello A,et al.A novel poloxamers/hyaluronic acid in situ forming hydrogel for drug delivery:rheological,mucoadhesive and in vitro release properties[J].Eur J Pham Biopham,2008,70 (1):199-206.
[3]邓丽娟,李桂玲,李眉.注射用原位凝胶的研究进展[J].中国抗生素杂志,2009,34(9):513-519.
[4]Clutterbuck A L,Cochrane CA,Dolman J,etal.Evaluating antibiotics for use in medicine using a polpxamer biofilm model[J].Ann Clin Microbiol Antimicrob,2007,6(2):1-10.
[5]宋鸿,李林彧,韩云竹.Poloxamer 407凝胶上细菌药物敏感性分析[J].重庆医学,2014,43(26):3468-3470.
[6]倪语星,王金良,徐英春,等.抗微生物药物敏感性试验规范[M].第2版.上海:上海科学出版社,2009:18.
[7]Mulcahy H,Sibley C D,Surette M G,et al.Drosophila melanogaster as an abimalmodel for the study of Pseudomonas aeruginosa biofilm infections in vivo[J].PloS Pathog,2011,7(10):e1002299.
[8]Yala J F,Thebault P,Hequet A,et al.Elaboration of antibiofilm materials by chemical grafting of an antimicrobial peptide[J].Appl Microbiol Biotechnol,2011,89 (3):623-634.
[9]卢忠义,宋鸿.金黄色葡萄球菌生物膜的研究进展[J].遵义医学院学报,2012,35(5):464-467.
[10]Ciofu,O,Mandsberg L F,Wang H,et al.Phenotypes selected during chronic lung infection in cystic fibrosis patients:implications for the treatment of Pseudomonas aeruginosa biofilm infections[J].FEMS Immunol Med Microbiol,2012,65(2):215-225.
[11]王艳,程惠娟,朱玲玲,等.鱼腥草素钠对铜绿假单胞菌生物被膜的影响[J].食品科学,2013,34(11): 173-176.
[12]Herzberg M,Rezene T Z,Ziemba C,et al.Impact of higher alginate expression on deposition Pseudomonas aeruginosa of in radial stagnation point flow and reverse osmosis systems[J].Environ Sci Technol,2009,43 (19):7376-7383.
[13]杜宝中,曾蔚,陶传敏,等.溶原性噬菌体对铜绿假单胞菌生物被膜形成的影响[J].四川大学学报:医学版,2008,39(6):886-889.
[收稿2015-04-27;修回2015-06-10]
(编辑:王 静)
M easurement of antim icrobial susceptibility of pseudomonas aeruginosa using Poloxamer 407 gel
Song Hong,Li Linyu,Ao Dishu
(Department of Microbiology,ZunyiMedical University,Zunyi Guizhou 563099,China)
Objective To establish a new type of bacteria culture system of Poloxamer 407(P407)thermosensitive in-situ gel as bacteriamedium model and investigate its influence on antimicrobial susceptibility of Pseudomonas aeruginosa.M ethods17 clinical Pseudomonasaeruginosa were isolated and collected from local hospitals. The antimicrobial susceptibility of bacteriawas then tested using K-B paper disk diffusion.Biofilm formation in P407 and MH agarmedia were observed through scanning electronmicroscopy(SEM).The expression of algC and algD genes,which related to bacterial biofilm formation,were detected through RT-PCR.Results In antimicrobial susceptibility tests,inhibition zones in P407 gel were found generally smaller than those in MH agar media(P<0.05).Moreover,Itwas found through SEM thata great quantity of bacilliwidely distributed in MH agarmedium,while the bacilli in P407 gel flocked together being coated by extracellularmatrices.Finally,the relative expressions of genes algC and algD in P407 gel were increased obviously and gradually compared with those in MH agarmedia.Conclusion P407 could be used as a new kind of excipient in bacteria culturemedia on clinical antimicrobial susceptibility tests.
Poloxamer 407;Pseudomonas aeruginosa;inhibition zone;bacterial biofilm;antimicrobial susceptibility
R379
A
1000-2715(2015)04-0383-04
贵州省科学技术基金资助项目(NO:黔科合G字LKZ[2011]37)。
宋鸿,女,博士,副教授,研究方向:病原微生物学,E-mail:450471068@qq.com。
