胰腺浆液性微囊性囊腺瘤 2例报道并文献复习
2015-12-21李皖云秦燕子谷从友欧玉荣
李皖云 秦燕子 吴 琼 朱 博 谷从友 欧玉荣
(蚌埠医学院第一附属医院病理科,蚌埠 233030)
胰腺浆液性微囊性囊腺瘤 2例报道并文献复习
李皖云 秦燕子 吴 琼 朱 博 谷从友 欧玉荣*
(蚌埠医学院第一附属医院病理科,蚌埠 233030)
目的 探讨胰腺浆液性微囊性囊腺瘤(SMC)的临床病理学特征。方法 分析2013~2014年本科室诊断的2例 SMC的临床表现、影像学特点、组织病理学及免疫组化特点。结果 2例 SMC既往有上腹部隐痛不适或腰痛等病史,均行CT检查示胰腺占位。肿瘤为单发、境界清楚的圆形肿物,大体呈微囊、海绵状,壁薄,囊内含清亮、稀薄液体;镜下见囊壁由含糖原的单层立方或扁平上皮构成,核小,居中,细胞无明显异型性。免疫表型:瘤细胞CK7、CK19、vimentin、MUC1、inhibin-α、EMA阳性,特殊染色 PAS阳性,NSE、CgA、CD10、CD34等阴性。术后随访4~19个月均未见肿瘤复发及转移。结论 SMC是发生于胰腺外分泌部的一种罕见肿瘤,多数位于胰体、尾部,常见于老年女性患者,大部分患者实验室检查及血清肿瘤标志物均正常。经病理常规和免疫组化检测可以确诊。
胰腺肿瘤;浆液性微囊性囊腺瘤;病理学,临床
胰腺浆液性微囊性囊腺瘤(serous microcystic cystadenoma,SMC)是发生于胰腺外分泌部的一种罕见肿瘤,多为老年女性,以胰腺体尾部为主[1]。本文报道2例 SMC,结合文献复习,加以分析。
材料和方法
1.材料
收集蚌埠医学院第一附属医院 2013~2014年手术治疗的2例 SMC。
2.方法
标本经10%中性福尔马林固定,系列脱水、二甲苯透明,石蜡包埋,切片厚4μm,常规染色,光镜观察。免疫组化采用EliVision法。一抗 CK7(OVTL12/30)、CK19(A53-B/A2.2b)、EMA(COL-1)、MUC1、vimentin(V9)、inhibin-α(R1)、NSE(E27)、WT1(WT49)、calretinin(SP17)、CgA(5P12)、CD10(56c6)、CD34(QBEnd/10)均购于福州迈新生物技术开发有限公司。用阿尔辛蓝-过碘酸雪夫(AB/PAS)法进行特殊染色。
结 果
1.临床资料
例1女性,61岁。半个月前无明显诱因出现上腹部隐痛不适,阵发性,不向腰背部及右肩部放射,尤以空腹时为剧,偶伴夜间痛,可自行缓解。超声、CT检查示:胰头部占位,长径约3.0cm(图1A、1B)。2014年9月 1日,本院肿瘤外科在支气管插管静脉复合麻醉下行剖腹探查,术中发现于胰头后、肝十二指肠韧带旁见散在肿大淋巴结,直径 0.5~1.0cm,行胰十二指肠切除术。
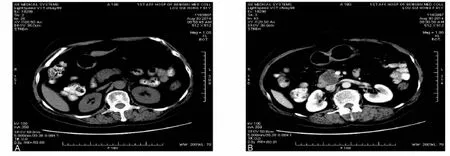
图1 CT检查示胰腺占位.A,胰腺头钩突占位;B,增强后不均质强化,呈多房囊状阴影Fig.1 The pancreas placeholders for CT scanning.A,The head of the pancreas hook placeholders;B,Presenting multilocular cystic shadow after heterogeneous enhancement
例2女性,73岁。半个月前定期体检时行 PETCT示:胰尾部占位。自诉偶有腰痛未行任何治疗。2013年6月 7日,本院肝胆外科在全麻下打开胃肠韧带,探查胰腺,见胰体尾部有一直径约 4.5cm质硬的肿瘤,其与脾动静脉关系紧密,遂行胰体尾 +脾切除术。
2.病理检查
巨检:例 1送检胰腺组织8.0cm×4.0cm× 2.0cm,已剖开,切面见一囊性区,3.0cm×2.0cm× 1.0cm,呈多房囊状、海绵状或蜂窝状,囊径0.1~0.5cm。例2送检胰腺组织5.0cm×4.0cm×3.0cm,胰尾已剖开,切面见一灰白色肿块,长径 3.8cm,描述同上。
镜检:肿瘤由形态多样的微囊构成,内含淡粉色浆液,少数伴出血;局部区域与胰腺有分界,大部分区域则与胰腺无分界,穿插于胰腺实质(图2A)。间质为宽窄不一的纤维组织间隔,大部分伴纤维化、胶原化及透明变性(图2B)。囊壁内衬单层扁平、立方细胞,胞质透亮,核小、居中,大小一致,无明显异型性,未查见核分裂象,核仁不明显,少数上皮增生呈细乳头状突向腔内,无纤维血管轴心(图2C)。
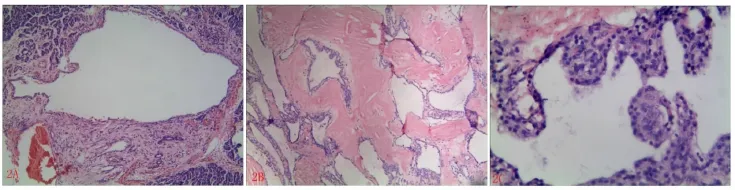
图2 HE染色特点.A,囊穿插入正常胰腺实质中(EliVision 100×);B,宽窄不一的纤维间隔,间质显著胶原化、透明变性(EliVision 100 ×);C,囊壁内衬单层立方上皮,囊腔内呈乳头状凸起,无纤维血管轴心 (EliVision 400×)Fig.2 The characteristic of the tumor for HE staining.A,Capsules insert to pancreatic parenchyma(EliVision 100×);B,Interval or width fibrous septum,interstitial collagen and hyaline degeneration significantly(EliVision 100×);C,Capsule walls lined by simple layer of cuboidal epithelium,the papillary projection of the cystic cavity without fiber axis or blood vessels(EliVision 400×)
特殊染色:例1瘤细胞 PAS染色阳性(图3A)。
免疫表型:例 1瘤细胞 CK7、CK19(图 3B)、MUC1、vimentin(图 3C)、inhibin-α均阳性,NSE、WT1、calretinin、CK5/6、Ki-67均阴性;例2瘤细胞CK7、CK19、inhibin-α、EMA均阳性,CgA、CD10、CD34、Syn、NSE均阴性,vimentin(+/-)、WT1(+/-)、Ki-67(+,个别)。
病理诊断:胰腺浆液性微囊性囊腺瘤

图3 特殊染色和免疫组化特点.A,PAS(100×);B,CK19(EliVision 100×);C,vimentin(EliVision 100×);在囊壁中的表达为阳性Fig.3 Specific staining(PAS)andimmunohistochemistry of the tumor.A,PAS(100×);B,CK19(EliVision 100×);C,vimentin(EliVision 100×);Positive expression of them in capsule walls
讨 论
1.临床特点
胰腺浆液性微囊性囊腺瘤(SMC)于1987年由Compagno等[2]首次提出,但是还不能清楚地与另一些有很大恶性潜能的胰腺囊性肿瘤相区别。此瘤发生在胰头部更易因术后的并发症或胃肠道、胆道梗阻导致病死率上升。有学者[3]提出“浆液性囊腺瘤”一词如未特别说明均特指“微囊性囊腺瘤”。胰腺 SMC是胰腺外分泌部发生的一种罕见肿瘤,几乎占所有胰腺外分泌部肿瘤的 1%-2%[4],占胰腺囊性肿瘤的25%[5]。该肿瘤常发生于26-91岁女性患者(67%-80%),平均年龄66岁;肿瘤最常见于胰体尾部,占 50%-70%[4],部分患者可有腹部包块、腹痛、恶心、呕吐及消瘦等临床表现,个别报道可合并糖尿病[6]。有学者[7]对此类患者 20例的诊治分析发现除一例黄疸患者肝功能异常外,其他患者血常规、血生化、肝肾功能及血清肿瘤标志物(CA19-9,CA125、CEA和AFP)检查均在正常范围内。超声及 CT示边界清楚的多房蜂窝状囊肿,囊腔与胰腺导管系统不相通。
2.病理诊断
肿瘤常为单个、界清、圆形肿物,切面呈海绵状、微囊状,囊壁光滑,壁厚0.01~0.3cm,囊内含透亮浆液。囊壁间可见中央星状瘢痕,纤维分隔向周边呈放射状延伸,中央可见少量簇状小囊。组织学特点为:肿瘤由大小不等囊腔组成,周边的囊腔常大于中心部位的囊腔,囊壁内衬富含糖原的扁平、立方或低柱状上皮细胞,胞质透亮,核小居中,不见核仁及分裂象,细胞无异型性;PAS染色阳性,经淀粉酶消化后PAS及阿尔辛蓝染色均阴性;可见残存的胰岛、胰腺导管或腺泡,亦可见钙盐沉积或中央伴有骨化(有学者[8]认为SMC骨化可能是一种化生现象)。免疫表型:瘤细胞CK7、CK8、CK18、CK19及EMA阳性,CgA、WT1、calretinin阴性,浆液性囊腺瘤 inhibinα、MUC6及 MUC1的 表达 率 分 别是 82%、70%、34%[4]。
3.鉴别诊断
3.1 胰腺浆液性寡囊性腺瘤(serous oligocystic adenoma,SOA)
常发生在男性,肿瘤边界不清,囊腔形状不规则,无中央星状瘢痕,与SMC免疫表型及超微结构特征相似,是同一个病理概念的不同组织学形态。二者鉴别的要点仅为构成肿瘤的囊腔数量和大小:SMC的囊腔较多,常超过6个,囊腔直径常小于2cm;SOA则相反[9]。
3.2 胰腺浆液性微囊性腺癌
其组织学形态与 SMC十分相似,不易区别,但恶性诊断必须有侵袭性行为(如侵袭血管、神经、区域淋巴结或其他器官的转移)。Strobel等[10]报道25%的浆液性囊腺癌出现远处转移才能诊断,有38%原发肿瘤经病理检测不能鉴别良恶性,在原发和(或)转移性肿瘤中,可借助常规基因分析、Ki-67、p53或有无核的异型性、乳头状结构、远处转移等加以鉴别。
3.3 胰腺黏液性囊性肿瘤
此瘤囊壁内衬高柱状黏液上皮细胞,不含糖原,常形成乳头,内衬上皮下可见富于细胞的“卵巢样”间质(SMA、ER、PR及inhibin-α等阳性),且常有非典型性,其中非典型增生者间质细胞核 PR阳性率(63%)低于无非典型者(83%),存在“卵巢样”间质是其 诊断 的必 要 条件[4]。瘤 细 胞 CEA、CA19-9、EMA等阳性,PAS及阿尔辛蓝染色加淀粉酶消化后均阳性。
3.4 胰腺淋巴管瘤和海绵状血管瘤
以年轻人多见,该瘤糖原染色阴性,免疫组化上皮标记阴性,淋巴管或血管内皮标志物(如D2-40、CD34、CD31、VIII因子等)阳性,胰腺淋巴管瘤的纤维间质可见多少不等的淋巴细胞且形成淋巴滤泡,银染可有嗜银膜包绕。
4.预后及遗传学
目前治疗仍以手术切除为主,彻底切除可治愈。王益林等[11]研究 35例行手术治疗的 SMC患者,其中32例获随访,除2例因其他疾病死亡,其余均健在,术后无复发。张磊等[7]研究发现 20例 SMC患者均行手术治疗,术后随访 12~79个月,中位随访39.5个月,均无肿瘤复发。袁菲等[12]对52例 SMC患者之中的20例进行4个月到 8年不等的随访,未发现复发及转移。目前SMC被认为是无恶性倾向的良性肿瘤,但有文献报道浆液性囊性肿瘤中有3%的浆液性囊腺癌[10]。Bramis等[13]认为胰腺浆液性囊性肿瘤(其中SMC占绝大多数[14])转变为恶性肿瘤的风险确实存在,尽管普遍认为其不会转变为恶性。此类患者应该积极采取手术治疗,因为其预后很好。本篇两例术后分别随访 4~19个月,均健存,无复发及转移。当然,尚需积累更多病例资料加以验证。
遗传学研究发现,部分肿瘤有 VHL等位基因位点的杂合性缺失,其形成可能与 VHL基因失活导致VEGF异常活化有关[15]。Moore等[16]报道 50%以上的 SMC在 10q染色体上出现等位基因杂合性缺失,40%的患者出现3p染色体等位基因的缺失,位于3p染色体上的 VHL基因约有22%的病例发生体细胞失活突变,因此检测10q及3p染色体上的基因改变对于诊断SMC的意义更为明显。目前未发现K-ras或者p53的体细胞基因失活突变,SMC具有野生型 K-ras,免疫组化标记 TP53阴性。
[1]李建华,刘光,周静,等.胰腺浆液性微囊性腺瘤 2例临床病例观察.诊断病理学杂志,2013,20(1):9-12
[2]Compagno J,Oertel J E.Microcystic adenomas of the pancreas(glycogen-rich cystadenomas):a clinicopathologic study of 34 cases.Am J Clin Pathol,1978,69(3):289-298
[3]Colonna J,Plaza J A,Frankel W L,et al.Serous cystadenoma of the pancreas:clinical and pathological features in 33patients.Pancreatology,2008,8(2):135-141
[4]Bosman F T,Carneiro F,Hruban R H,et al.WHO classification of tumors of the digestive system.4thed.Lyon:IARC Press,2008
[5]Compton CC.Serous cystic tumors of the pancreas.Semin Diagn Pathol,2000,17(1):43-55
[6]伍健,张晓莹,费绍华.胰腺浆液性微囊性腺瘤临床病理分析.肿瘤防治研究,2010,37(12):1420-1422
[7]张磊,王科伟,孔凡民,等.胰腺浆液性囊腺瘤20例诊治分析.中国实用外科杂志,2013,33(6):497-499
[8]林生明,张声,陈余朋,等.胰腺浆液性微囊性腺瘤13例临床病理分析.临床与实验病理学杂志,2013,29(7):721-725
[9]Kim H J,Lee D H,Ko Y T,et al.CT of serous cystadenoma of the pancreas and mimicking masses.Am J Roentgenol,2008,190(2):406-412
[10]Strobel O,Z’graggen K,Schmitz-Winnenthal F H,et al. Risk of malignancy in serous cystic neoplasms of the pancreas.Digestion,2003,68(1):24-33
[11]王益林,雷若庆,陈泉宁,等.36例胰腺浆液性囊腺瘤的临床分析.外科理论与实践,2007,12(3):229-232
[12]袁菲,高亚博,吴华成,等.52例胰腺浆液性囊腺瘤临床病理分析.诊断学理论与实践,2008,7(6):621-624
[13]Bramis K,Petrou A,Papalambros A,et al.Serous cystadenocarcinoma of the pancreas:report of a case and management reflections.World J Surg Oncol 2012,10(1):51-55
[14]Tseng JF,Warshaw AL,Sahani DV,et al.Serous cystadenoma of the pancreas:Tumor growth rates and recommendations for treatment.Ann Surg 2005,242:413-421
[15]Warshaw AL,Compton CC,Lewandrowski K,et al.Cystic tumors of the pancreas.New clinical,radiologic,and pathologic observations in 67 patients.Ann Surg,1990,212(4):432-445
[16]Moore P S,Zamboni G,Brighenti A,et al.Molecular characterization of pancreatic serous microcystic adenomas:evidence for a tumor suppressor gene chromosome 10q.Am J Pathol,2001,158(1):317-321
Serous microcystic cystadenoma of the pancreas:report of two cases and literature review
Li Wanyun,Qin Yanzi,Wu Qiong,Zhu Bo,Gu Congyou,Ou Yurong*
(Department of Pathology,the First Affiliated Hospital of Bengbu Medical College,Bengbu 233003,China)
Objective To explore the clinicopathologic features of serous microcystic cystadenomas(SMC)of the pancreas. Methods Two SMC cases of the pancreas from 2013 to 2014 in our department were analyzed for clinical features,imaging characteristics,histopathology and immunohistochemistry.Results Both had a history of epigastric discomfort and lumbago,and then CT scanning showed pancreatic lesions.The tumor was a well-defined single mass,generally round,microcystic and spongy.Its thin wall contained clear and thin liquid.Microscopically,the tumor was composed of multiple small cysts lined by a single layer of glycogen-rich cuboidal or flattened cells with small nuclei in the middle,but the cells had no obvious atypia.Immunohistochemically,the tumor cells were positive for CK7,CK19,vimentin,MUC1,inhibin-α,EMA,and periodic acid-Schiff(PAS)staining but negative for NSE,CgA,CD10 and CD34.No recurrence or metastasis were confirmed during follow-up at 4 months and 19 months respectively.Conclusions SMC,a rare type of pancreatic exocrine tumor,is mainly observed in the pancreatic body or tail,and commonly found in elderly female patients.The laboratory examinations and serum tumor markers of most patients are normal,but routine pathologic and immunohistochemical detections can make accurate diagnosis.
Pancreatic neoplasms;Serous microcystic cystadenoma;Pathology,clinical
R735.9
A
10.16705/j.cnki.1004-1850.2015.05.022
2015-03-15
2015-07-21
李皖云,女(1987年),汉族,硕士研究生
* 通讯作者(To whom correspondence should be addessed):13955209008@qq.com
