Slug和 E-cadherin在非小细胞肺癌恶性胸水细胞中的表达变化
2015-12-21李长思徐爱华杨杨李斌李建华孙永新
李长思徐爱华杨 杨李 斌李建华孙永新
(1中国医科大学附属第一医院康复医学科,2中国医科大学附属一医院病理科,辽宁 110001)
Slug和 E-cadherin在非小细胞肺癌恶性胸水细胞中的表达变化
李长思1徐爱华1杨 杨1李 斌1李建华2*孙永新1
(1中国医科大学附属第一医院康复医学科,2中国医科大学附属一医院病理科,辽宁 110001)
目的 研究锌指转录因子 Slug、E-cadherin和 Vimentin在非小细胞肺癌恶性胸水细胞中的表达。方法 应用免疫细胞化学和 western blot检测 Slug、E-cadherin和 Vimentin在非小细胞肺癌胸水中的表达。结果 在121例非小细胞肺癌胸水中,Slug、E-cadherin和Vimentin的阳性表达率分别为35.5%(43/121)、71.9% (87/121)和39.71% (48/121),在非小细胞肺癌细胞中 Slug和E-cadherin阳性表达率均高于正常胸水,Slug表达的增强通常伴随 E-cadherin表达下调及 Vimentin表达的增强。结论 Slug与 E-cadherin在胸水中非小细胞肺癌细胞中的表达呈负相关,在胸水中提取非小细胞肺癌细胞,研究 Slug和E-cadherin,Vimentin的表达及其在上皮间质转化中的调节作用对探讨肿瘤细胞在人体中的转移进展很有意义。
Slug;E-cadherin;EMT;胸腔积液;非小细胞肺癌细胞
肺癌是目前世界范围内引起死亡人数最多的肿瘤。虽然关于肺癌发生的蛋白和转移机制已经部分阐明,但位居死亡率之首的肺癌五年存活率仍无明显改善(仅15%-20%),缺乏有效的早期诊断和治疗手段是两大主要原因之一[1]。因此,充分利用痰脱落细胞、支气管灌洗液等临床诊断材料进行肿瘤进展阶段及侵袭机制的研究具有重要的理论和实践意义。
上皮 细胞-间质 转 化 (epithelial mesenchymaltransition,EMT)是多细胞生物胚胎发生中的基础过程,也存在于多种慢性疾病以及肿瘤的发生发展过程中,它以上皮细胞极性丧失及其间质特性的获得为主要特征。EMT与肿瘤细胞的原位侵袭和远处转移有着密切的关系[2]。EMT(上皮间质转化)表现为上皮细胞失去极性,与周围的细胞和基质接触减少,细胞间黏附力下降,迁移和运动能力下降,同时细胞表型发生变化。这些特点与肿瘤细胞的原位侵袭和远处转移密切相关。传统观点认为,在EMT的发生过程中,上皮细胞的标志物如 E-钙黏蛋白(E-Ca)、桥粒斑蛋白、紧密连接蛋白、角蛋白、黏蛋白等表达下调,间叶表型标记物如波形蛋白,纤维连接蛋白,N-钙粘蛋白等表达上调,以及诱导EMT的细胞因子和转录因子如 Snail,Slug,twist,Rho,转化生长因子,成纤维细胞特异蛋白,成纤维细胞生长因子等亦表达上调,对 EMT有辅助作用的基质金属蛋白酶-2和基质金属蛋白酶-9等表达亦上调[3]。作为上皮细胞的标志物,细胞黏附分子的表达缺失对于诱导和完成 EMT都是十分必要的,而它的重新激活可能也会导致相反的过程——间质上 皮 转化 (MET)[5-7]。在 肿瘤 侵 袭 过 程 中,EMT可能只是一个瞬时现象,当肿瘤细胞完成侵袭过程后将重新获得上皮特征——E-cadherin重新表达[5,7]。EMT概念的提出使人们对肿瘤侵袭转移机制有了更深刻的理解。
锌指因子 Slug属于 Snail转录抑制子超家族,编码的转录因子表达在不同组织发育的各阶段,在原肠胚和中胚层的形成中发挥重要作用。Slug基因有高度保守的 C2H2-型锌指结构域,连接到 E-box可以抑制靶基因的转录[8,9]。另外,Slug还可以促进上皮细胞-间充质细胞的转换(epithelial-mesenchymal transition,EMT)和抑制上皮细胞钙黏蛋白(E-cadherin)在内的粘附分子和上皮细胞标记物表达,促进细胞的迁移。功能获得和缺失实验同样表明在鸡和爪蟾胚胎特定区域的 Slug可以启动 EMT[8]。目前,国内外有很多体内和体外研究显示了Slug在不同类型的肿瘤侵袭和转移中的作用。然而,试验中使用的材料和方法不同,得出的结论也具有很大差异,说明Slug在肿瘤发生侵袭过程中的作用还需要进一步去证实。
本研究采用免疫细胞化学、免疫荧光及western blot方法检测Slug蛋白、E-cadherin蛋白及 Vimentin蛋白在非小细胞肺癌细胞中的表达,旨在了解它们的相关性及在肿瘤细胞发生EMT中的作用。
材料和方法
1.材料
1.1 病例
收集2008年12月至2010年2月中国医科大学附属第一医院门诊及病房恶性胸水患者标本,优选以肿瘤细胞为主、炎性细胞较少未接受过治疗的121例作为研究对象(经支气管镜及术后组织学证实为非小细胞肺癌细胞)。另外 28例良性胸水标本作为对照,共计149例。其中,男性患者69例,女性患者52例;年龄26-89岁,平均年龄56岁。
1.2 试剂
兔抗人 E-cadherin抗体购自美国 abcam公司,鼠抗人 Slug抗体购自美国santa cruz抗体试剂公司产品,鼠抗人 Vimentin,SP-B、SP-A、CK7、E-cadherin、TTF-1抗体购自福州迈新公司销售的美国Biox公司产品。
2.方法
2.1 液基细胞薄层检测技术(TCT)
收集新鲜胸水20ml左右,室温下800r/min离心5分钟,弃去上清,取沉淀底层细胞,加入清洗液后再次离心。取沉淀与保存液混合后机器自动制片。
2.2 细胞包埋块的制备
采用液基细胞薄层方法(TCT)常规制片、诊断后,每份标本收集新鲜胸水标本 200ml左右,经95%乙醇固定 24小时后石蜡包埋、切片。每份标本切片7张,分别用做 HE染色、SP-B、SP-A、CK7、E-cadherin、Vimentin、TTF-1免疫细胞化学 SP法染色。此外,每份标本制备 3张 TCT涂片,分别做Slug、E-cadherin的免疫荧光染色及 Slug的免疫细胞化学 SP法染色。
2.3 免疫荧光染色
采用间接免疫荧光染色法检测 Slug和 E-cadherin的表达定位。首先,TCT涂片放入4%福尔马林中固定20分钟。加非免疫动物血清 37℃封闭 30分钟,滴加一抗(1:100稀释),4℃孵育过夜;免疫荧光二抗(1:100稀释),37℃孵育30分钟。DAPI复染细胞核。50%缓冲甘油封片,荧光显微镜 Nikon90i下观察并照相。孵育二抗以后步骤均在避光条件下进行。阴性对照实验:用等量的 0.01mol/L PBS代替一抗,其余步骤同前。结果判定:以细胞中呈现明亮的绿色荧光信号定位0ct3/4阳性。
2.4 SP法
采用链霉菌抗生物素-过氧化物酶(streptavidinperoxidase,SP)法,PBS缓冲液代替第一抗体作为空白对照,DAB显色,苏木素复染。常规脱水透明,中性树胶封片。
以细胞出现棕黄色颗粒为阳性,阳性程度判断:细胞无着色或着色细胞数占总细胞数<10%为(-);阳性着色细胞数占总细胞数 10%~25%为(+);26% ~50%为(++),≥51%为(+++);阳性表达即+ ~ + + +。每张切片选取 10个高倍视野(400×),对免疫细胞化学结果进行评估。
2.5 Western Blot
在121例非小细胞肺癌胸水和 28例良性胸水中检测 Slug,E-cadherin和Vimentin的蛋白水平。总蛋白从胸水细胞中提取,冰上超声处理,4℃静置,孵育50min,4℃ 离心20min(1000r/min),提取上清,放入 -70℃冰箱里保存。使用前,用 Brodford法测定蛋白浓度,以每孔80μg蛋白加入10%SDS-PAGE凝胶电泳后,4℃ ,50V(Slug)、100V(E-cadherin)条件下湿电转移仪将蛋白转入0.22μmPVDF膜,5%脱脂奶粉封闭液封闭2h,一抗(Slug 1:100稀释,E-cadherin 1:1000稀释)4℃过夜,X底片曝光,显影,定影后拍照,以 β-actin为内参,每组结果均为相同条件重复3次。
2.6 统计分析
应用 SPSS11.0软件进行统计学处理,多组数据的阳性率比较采用卡方检验,以P<0.05为差异有统计学意义。
实验结果
1.非小细胞肺癌的鉴定
常规使用液基细胞薄层方法检测胸水中细胞成分之后,细胞石蜡包埋,HE染色、免疫细胞化学染色,阳性表达证实为非小细胞肺癌肺癌细胞(图 1),患者经手术后切除肺,经组织学进一步证实为非小细胞肺癌。
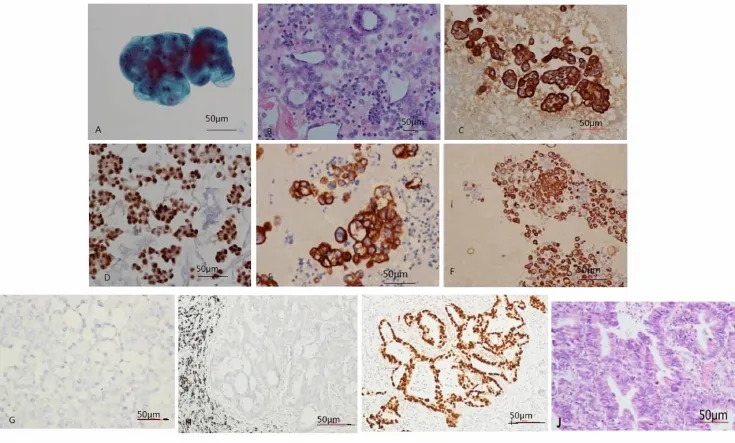
图1 胸水中非小细胞肺癌免疫细胞化学染色表达。图1A,恶性胸水TCT涂片,细胞学;B,细胞包埋石蜡切片,HE;C,免疫细胞化学染色,CK7在胸水非小细胞肺癌细胞中阳性表达;D,免疫细胞化学染色TTF-1在胸水非小细胞肺癌细胞中阳性表达;E,免疫细胞化学染色,SPA在胸水非小细胞肺癌细胞中阳性表达;F,免疫细胞化学染色,SP-B在胸水非小细胞肺癌细胞中阳性表达;G,CK5/6在非小细胞肺癌细胞中阴性表达;H,CK5/6在非小细胞肺癌组织中阴性表达,SP法;I,TTF-1在非小细胞肺癌组织中阳性表达 SP法;J,非小细胞肺癌组织切片 HE染色Fig.1 A,Tumor cells were detected in pleural fluid of non small lung cancer by TCT;B,Tumor cells were detected in pleural fluid of non small lung cancer by HE;C,CK7 expression in pleural fluid of the non small lung cancer by immunocytochemistry(membrane positive);D,TTF-1 expression in pleural fluid of the non small lung cancer by immunocytochemistry(nuclear positive);E,SP-A expression in pleural fluid of the non small lung cancer by immunocytochemistry(cytoplasm positive);F,SP-B expression in pleural fluid of the non small lung cancer by immunocytochemistry(cytoplasm positive);G,CK5/6 non expression in pleural fluid of the non small lung cancer by immunocytochemistry(cytoplasm positive);H,CK5/6 non expression in tissue of the non small lung cancer by immunocytochemistry(cytoplasm positive);I,TTF-1 expression in tissue of the non small lung cancer(SP);I,tissue of non small lung cancer,HE
2.Slug,E-cadherin和 Vimentin在非小细胞肺癌中的表达
免疫光结果显示 Slug表达定位于非小细胞肺癌细胞核,E-cadherin表达定位于非小细胞肺癌细胞膜(图2)
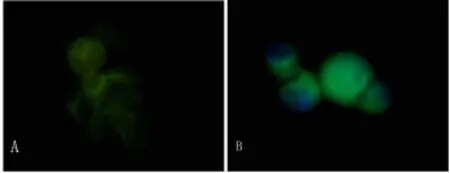
图2 A免疫荧光染色E-cadherin膜表达,600×;B免疫荧光染色 Slug核表达,600×Fig.2 A.Expression of E-cadherin by immunofluorescence(600 ×);B.Expression of Slug by immunofluorescence(600×)
在大多数非小细胞肺癌标本中,Slug的表达与E-cadherin呈相反的趋势(表1)。低分化,单个无连接的非小细胞肺癌细胞中 Slug表达较好,而在分化好,呈乳头样结构的非小细胞肺癌细胞中,Slug通常弱阳性或阴性表达(图3,图4)。Slug在非小细胞肺癌细胞中表达增强通常伴有E-cadherin表达的减弱及Vimentin的表达。对于高分化或中等分化的非小细胞肺癌细胞,排列呈腺腔样结构、紧密连接的非小细胞肺癌细胞,E-cadherin蛋白通常高表达。而对于那些分化较差,单个散在分布的非小细胞肺癌细胞 E-cadherin表达较弱或不表达(图5)。在高分化非小细胞肺癌细胞中,Vimentin呈胞浆弱表达,而在低分化非小细胞肺癌细胞,排列成腺腔样,紧密排列或成团状排列的非小细胞肺癌细胞中染色增强(图6)。良性上皮细胞中,Slug与E-cadherin都没有表达。
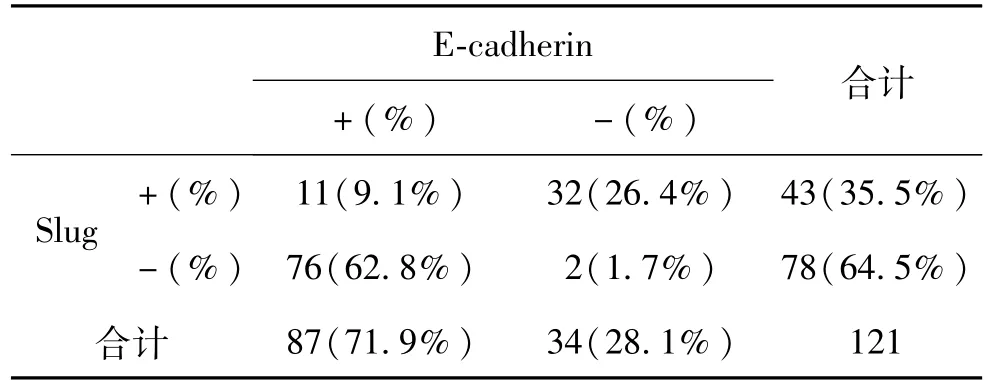
表1 Slug和 E-cadherin蛋白在胸水中非小细胞肺癌细胞中的表达Table 1 Expression of Slug and E-cadherin in inpleural fluid of non small lung cancer
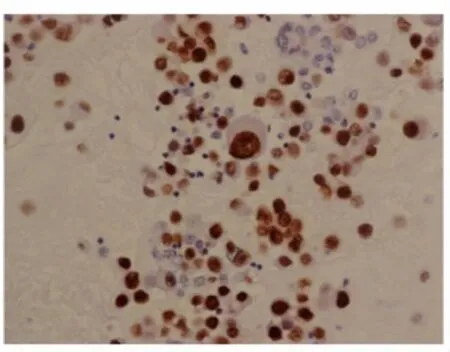
图3 Slug在胸水非小细胞肺癌细胞中的表达,细胞核阳性表达,400×Fig.3 Slug expression in pleural fluid of non small lung cancer by immunocytochemistry(nuclear positive 400×)
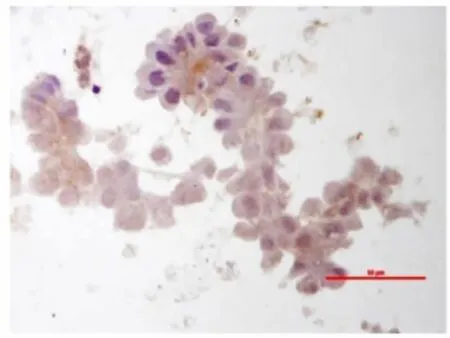
图4 Slug在胸水非小细胞肺癌细胞中弱表达或阴性表达,400×Fig.4 Slug expression in pleural fluid of non small lung cancer by immunocytochemistry(cytoplasm positive weakly or negative 400×)
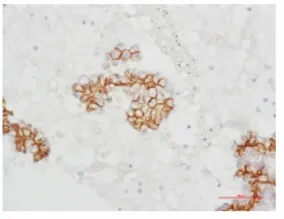
图5 E-cadherin在胸水非小细胞肺癌细胞中表达,细胞膜阳性表达,400×Fig.5 E-cadherin expression in pleural fluid of non small lung cancer by immunocytochemistry(membrane positive 400×)
收集细胞量大且肿瘤细胞含量大于85%的恶性胸水标本40例。采用Western blot方法检测Slug,E-cadherin和 Vimentin的表达。结果显示 Slug,E-cadherin和Vimentin在恶性胸水中肿瘤细胞中阳性表达,而在对照组的增生上皮细胞中不表达。Slug表达的增强通常伴随 E-cadherin表达下调及 Vimentin表达的增强。而 E-cadherin表达较强的标本通常Slug表达较弱(图7)。
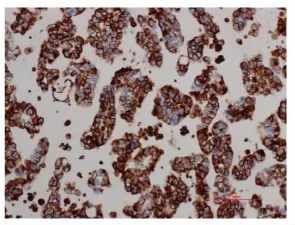
图6 Vimentin在胸水非小细胞肺癌细胞中的表达,细胞浆阳性表达,400×Fig.6 E-cadherin expression in pleural fluid of non small lung cancer by immunocytochemistry(cytoplasm positive 400×)
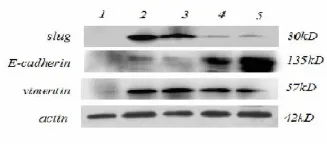
图7 Slug、E-cadherin及Vimentin在胸水中提取细胞蛋白的表达。1.良性上皮细胞;2.3.非小细胞肺癌细胞;4.腺鳞混合型;5.异型增生上皮细胞Fig.7 Expression of Slug,E-cadherin and Vimentin in pleural fluid by western blot.(1,hyperplasia epithelial cells;2,3 non small lung cancer cells;4,adenosquamous carcinoma cells;5,dysplasia epithelial cells)
讨 论
EMT通常在胚胎发育过程中在组织形态方面发生,在恶性肿瘤侵袭转移过程中发挥重要作用,是肿瘤侵袭转移的关键步骤[10]。通过上皮间质转化,肿瘤细胞变得更有活动性,并且能够通过获得间质细胞的特征来增加侵袭能力[11]。从恶性胸水中提取的非小细胞肺癌细胞属于具有高侵袭性的转移肿瘤细胞。在我们的研究中,我们利用转移肿瘤细胞探索EMT的标记蛋白。
Slug作为锌指转录因子,是snail超家族的成员之一。Snail作为 E-cadherin抑制因子,在果蝇、小鼠的发育过程,鼠类和人类肿瘤及黑色素瘤细胞系中的作用早已被证实。先前的研究也已经证明 Slug的过 表达 与 非小 细 胞肺 癌[12-14,21,24],食 管 鳞状 细 胞癌[15,16],消化道肿瘤[17],结肠癌[18],肝细胞癌[19],胰腺 癌[20],肺 癌[21]和 卵 巢 癌[12,23]有 关 。关 于 部 分 肿瘤的研究发现,Slug的过表达与肿瘤的浸润深度、淋巴结转移和不良预后有关[15],与E-cadherin表达呈负相关[17]。且有关直结肠癌的研究发现,Slug高表达的患者预后较差[18]。此外,体外实验证明 Slug的过表达能够增加肺癌细胞的侵袭力,血管发生和加速细胞生长[21]。而 Victoria Bolós等在 MDCK细胞中的研究发现,Slug在上皮细胞中的过表达能够有效的抑制 E-cadherin,诱导完整的 EMT过程[25]。这些文献都证明了 Slug对 E-cadherin的抑制作用,并与上皮间质转化有关。然而,Slug在人体非小细胞肺癌细胞中的表达的相关报道还十分有限。在研究中,我们选取恶性胸水中的非小细胞肺癌细胞作为研究对象,发现 Slug选择性的表达于胸水中的非小细胞肺癌细胞。121例标本中,43例发现了 Slug阳性表达,而78例标本未见Slug明显表达,这可能与胸水中脱落的肿瘤细胞退行性改变有关。先前的研究说明,Slug高表达的肺癌组织侵袭和转移能力更强。Slug可诱导肿瘤细胞向间质表型转化,同时上皮标记物表达降低,促使细胞发生上皮间质转化。当肿瘤细胞侵破胸膜,转移至胸水,可在胸水中继续分化,发生间质上皮转化(MET),重新获得上皮表型,形成新的细胞连接。Marcello Guarino等人在关于EMT的综述中也曾提出过类似的观点:EMT的反相过程 MET可能使发生过 EMT之后的细胞得以继续生长、分化,形成新的转移灶。在我们的实验中,E-cadherin在恶性胸水中肿瘤细胞中表达,阳性细胞大都分化成腺腔样结构,形成新的细胞连接,这与MET的理论相符合。
我们发现,免疫细胞化学和 western blot的结果都显示Slug与E-cadherin表达呈负相关。这些结果显示Slug的高表达抑制 E-cadherin表达,伴随 Vimentin的表达。Western blot结果中,样本 2和3显示Slug高表达,E-cadherin表达减弱及 Vimentin的表达增强。然而,样本4中,E-cadherin与 Vimentin同时阳性表达。这可能是同一个标本中可能存在上皮表型的肿瘤细胞和间质表型的肿瘤细胞。
在肿瘤细胞侵破胸膜的过程中,Slug和其他转录因子抑制E-cadherin的表达,从而使肿瘤细胞间质化,获得侵袭能力。
Slug和 E-cadherin在胸水非小细胞肺癌中表达,在对照组的增生上皮中不表达,Slug与 E-cadherin在胸水中非小细胞肺癌细胞中的表达呈负相关,即 Slug表达的增强通常伴随 E-cadherin表达下调及Vimentin表达的增强。而 E-cadherin表达较强的标本通常 Slug表达较弱。在胸水中提取非小细胞肺癌细胞,研究 Slug的表达及其在上皮间质转化中的调节作用对探讨肿瘤细胞在人体中的转移进展很有意义,进一步研究将会为临床诊断及指导临床预后有更大帮助。
[1]Meyerson M,Carbone D.Genomic and proteomic profiling of lung cancers:lung cancer classification in the age of targeted therapy.J Clin Oncol,2005;23:3219-3226
[2]Mareel M,Leroy A.Clinical,cellular,and molecular aspects of cancerinvasion.Physiol Rev,2003;83:337-376
[3]Hay ED.The mesenchymal cell,its role in the embryo,and theremarkable signaling mechanisms that create it.Dev Dyn,2005;233:706-720
[4]Birchmeier W.and J.Behrens.Cadherin expressionin carcinomas:role in the formation of cell junctionsand the prevention of invasivenesss.Biochim BiophysActa,1994;1198,11-26
[5]Brabletz T,Hlubeck F,Spaderna S,et al.Invasion and metastasis in colorectal cancer:epithelial-mesenchymal transition,mesenchymalepithelial transition,stem cells and b-catenin. Cells Tissues Organs,2005;179:56-65
[6]Hay ED.The mesenchymal cell,its role in the embryo,and the remarkable signaling mechanisms that create it.Dev Dyn,2005;233:706-720
[7]Guarino M,Micheli P,Pallotti F,et al.Pathological relevance of epithelial and mesenchymal phenotype plasticity.Pathol Res Pract,1999;195:379-389
[8]Nieto MA,Sargent MG,Wilkinson DG,et al.Control of cellbehavior during vertebrate development by Slug,a zincfinger gene.Science,1994,264(5:160):835-839
[9]Bolós V.,H.Peinado,M.A.Pérez-Moreno,et al.The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions:a comparison with Snail and E47repressors.J Cell Sci,2003;116,499-511
[10]Thiery JP.Epithelial-mesenchymal transitions in development and pathologies.Curr Opin Cell Biol,2003;15:740-746
[11]Thiery JP.Epithelial-mesenchymal transitions in tumour progression.Nat Rev Cancer,2002;2:442-454
[12]Elloul S,M.B.Elstrand,J.M.Nesland,C.G.et al.Slug,and Smad-interacting protein 1 as novel parameters of disease aggressiveness in metastatic ovarian and breast carcinoma. Cancer,2005;103:1631-1643
[13]Martin TA,A Goyal,G Watkins,et al Expression of the transcription factors snail,Slug,and twist and their clinical significance in human breast cancer.Ann Surg Oncol,2005;12:488-496
[14]Côme C.,F.Magnino,F.Bibeau,et al.Snail and Slug play distinct roles during breast carcinoma progression.Clin Cancer Res,2006;12:5395-5402
[15]Uchikado Y,S.Natsugoe,H.Okumura,et al.Slug Expression in the E-cadherin preserved tumors is related to prognosis in patients with esophageal squamous cell carcinoma.Clin Cancer Res,2005;11:1174-1180
[16]Kumar A,T.Chatopadhyay,M.Raziuddin,et al.Discovery of deregulation of zinc homeostasis and its associated genes in esophageal squamous cell carcinoma using cDNA microarray.Int J Cancer,2007;120:230-242
[17]Castro AC,E.Rosivatz,C.Schott,R,et al.Slug is overexpressed in gastric carcinomas and may act synergistically with SIP1 and Snail in the down-regulation of E-cadherin.J Pathol,2007;211:507-515
[18]Shioiri M,T.,Shida K.,Koda K,et al.Slug expression is an independent prognostic parameter for poor survival in colorectal carcinoma patients.Br J Cancer,2006;94:1816-1822
[19]Giannelli G,C.Bergamini,E.Fransvea,et al.Laminin-5 with transforming growth factorbeta1 induces epithelial to mesenchymal transition in hepatocellular carcinoma.Gastroenterology,2005;129:1375-1383.20
[20]Hotz B,M.Arndt,S.Dullat,S.et al.Epithelial to mesenchymal transition expression of the regulators snail,Slug,and twist in pancreatic cancer.Clin Cancer Res,2007;13:4769-4776.21
[21]Shih JY,MF Tsai,TH Chang,et al.Transcription repressor Slug promotes carcinoma invasion and predicts outcome of patients with lung non small lung cancer.Clin Cancer Res,2005;11:8070-8078.22
[22]Sivertsen S,R.Hadar,S.Elloul,L.et al.Expression of Snail,Slug and Sip1 in malignant mesothelioma effusions is associated with matrix metalloproteinase,but not with cadherin expression.Lung Cancer,2006;54:309-317.23
[23]Elloul S,I.Silins,CG Tropé,et al.Expression of E-cadherin transcriptional regulators in ovarian carcinoma.Virchows Arch,2006;449:520-528.24
[24]Hajra KM,DY Chen,ER.Fearon.The SLUG zincfinger protein represses E-cadherin in breast cancer.Cancer Res,2002;62:1613-1618.25
[25]Victoria Bolós,Hector Peinado,Mirna A.et al.The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions:a comparison with Snail and E47 repressors.J Cell Sci,2003;116:499-511
Slug and E-cadherin expression in non small cell lung cancer
Li Changsi1,Xu Aihua1,Yang Yang1,Li Bin1,Li Jianhua2*,Sun Yongxin1
(1Department of Rehabilitation,2Department of Pathology,First Hospital,china medical university,Liaoning 110001,China)
Objective To study Slug and E-cadherin expressions in non small cell lung cancer.Methods The expression of Slug,E-cadherin and Vimentin in the lung cancer was detected by immunocytochemistry and Western blotting.Results In the pleural effusion of 121 patients with non small cell lung cancer,the positive expression rates of Slug,E-cadherin and Vimentin were respectively 35.5% (43/121),71.9% (87/121),and 39.71% (48/121),and the rates of positive expression of Slug and E-cadherin were higher than in normal plural effusion.The augmentation of Slug expression was usually accompanied by down-regulated E-cadherin expression and enhanced Vimentin expression.Conclusion The expressions of Slug and E-cadherin in plural effusion of non small cell lung cancer are negatively correlated(P<0.05).It is very meaningful to extract non small cell lung cancer cells from plural effusion and to study Slug,E-cadherin and Vimentin expressions and their regulatory role in the epithelial mesenchymal transformation in order to explore the metastatic progression of tumor cells in the human body.
Slug;E-cadherin;EMT;Pleural fluid;Non small cell lung cancer
R734.2
A
10.16705/j.cnki.1004-1850.2015.05.004
2015-04-01
2015-06-22
李长思,男(1983年),汉族,住院医师
*通讯作者(To whom correspondence should be addressed):LIJH@mail.cmu.edu.cn
