CD151通过 ERK促进体外血管生成
2015-12-21沈小清杨秀婷左后娟刘正湘费宇杰刘曌宇
沈小清 杨秀婷 左后娟 刘正湘 费宇杰 刘曌宇
(华中科技大学同济医学院附属同济医院:1心血管内科;2消化内科,武汉 430030)
论 著
CD151通过 ERK促进体外血管生成
沈小清 杨秀婷 左后娟 刘正湘 费宇杰 刘曌宇*
(华中科技大学同济医学院附属同济医院:1心血管内科;2消化内科,武汉 430030)
目的 探讨 p38MAPK信号通路及ERK信号通路激活在 CD151促进体外基质胶(matrigel)上类微血管结构形成的机制。方法 包装 CD151、antiCD151和 GFP的重组腺相关病毒并转染人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVEC)。将转染后的细胞种植在 Matrigel上,观察其管型结构的形成。Western Blot法检测CD151、ERK、p38MAPK蛋白的表达;给予 ERK抑制剂、p38 MAPK抑制剂,分别观察其对 CD151促进管型结构形成的影响。结果 CD151高表达组较对照组及 GFP组显著促进 HUVECs matrigel上管型结构形成。高表达的CD151能够促进p-ERK的表达,但是对 p-p38MAPK的蛋白表达影响不明显。ERK抑制剂能显著减弱 CD151对管型结构形成的促进作用,但 p38 MAPK抑制剂则对CD151促进管型结构的形成无显著影响。结论 高表达的 CD151通过激活 ERK信号通路促进HUVECs在 matrigel上管型结构形成,其作用与p38 MAPK信号通路的激活无明显关系。
CD151;血管生成;胞外信号调节激酶;丝裂原活化蛋白激酶
血管生成(angiogenesis)在诸多疾病尤其是心血管疾病的病理生理过程中起着举足轻重的作用。随着冠脉血管病变的严重性和复杂性,传统治疗方法难以奏效,故“治疗性血管生成”为当前缺血性心血管疾病研究热点之一,多种促血管生成的因子也相继被发现并报道。
CD151是 TM4SF家族最重要的成员之一[1-3],它在内皮细胞呈高表达,与多种整合素(α6β1、α3β1等)特异性结合形成 CD151-整合素复合体,参与调节细胞多种功能,包括调节细胞形态、增殖、粘附、迁移、肿瘤细胞的侵袭及转移等过程[4-7]。近年来,国外研究发现CD151在维持细胞形态和血管稳定性方面发挥重要作用,CD151敲除则导致病理性的血管生成显著被破坏。故 CD151在血管生成中的作用越来越值得研究和重视。我们课题组前期有多项研究证实CD151高表达可促进小型猪缺血心肌组织的微血管和小动脉的生成,促进侧枝循环的建立,显著改善缺血心肌组织的血流灌注[8];CD151高表达可促进大鼠缺血后肢的微血管形成和功能恢复[9,10]。但是,CD151促血管生成的机制尚不清楚。
既往发现CD151高表达可促进细胞迁移并促进体外管型结构形成,且可促进 ERK信号通路的激活[11],但是,CD151的促体外管型结构形成是否由ERK介导并不清楚;而其他信号通路如p38MAPK信号通路是否也参与 CD151促管型结构形成的作用尚未见报道。本研究主要探讨ERK信号通路和p38MAPK信号通路在 CD151促体外血管生成中的作用。
材料和方法
1.材料
1.1 细菌与质粒
pZeoSV-CD151由美国 Tennessee大学惠赠。HUVEC细胞购自武汉大学物种保存中心。pAAVCD151-HA重组质粒由本课题组前期构建[10],rAAV包装质粒 pXX2、腺病毒辅助质粒 phelper、真核表达载体pXXUF1含绿色荧光蛋白序列(Green fluorescentprotein,GFP)由美国Pittsburgh大学分子遗传及生物 化 学系 Xiao Xiao博士 惠 赠。工 程 菌 株E.ColiDH5a由同济医院心血管研究室保存。293细胞购自ATCC(美国)。
1.2 主要试剂
所有细胞培养的标准试剂,胎牛血清(FBS)、DMEM培养基、胰蛋白酶等均购自 GIBCO公司。蛋白质提取试剂Trizol购自美国Life technologies公司。羊抗兔CD151、鼠抗β-actin、兔抗p38MAPK、兔抗phospho-p38MAPK、兔 抗 ERK1/2、兔 抗 phospho-ERK1/2购自美国 Santa Cruz Biotechnology公司。Western杂交显影用增强的化学发光试剂(SuperSignal Substrate,ECL)购自美国 Pierce公司。辣根过氧化酶标记兔抗羊 IgG、兔抗鼠IgG和羊抗兔 IgG购自美国Pierce公司。p38 MAPK抑制剂(SB203580)购自Calbiochem公司,ERK抑制剂(PD098059)购自Gibco公司。Matrigel购自德国 R&D Biosciences公司。其余试剂为国产分析纯试剂。
2.方法
2.1 质粒构建及酶切鉴定
pAAV-CD151、pAAV-antiCD151和 pAAV-GFP质粒的由本课题组前期构建[10]。将构建的 CD151和antiCD151分别转化大肠杆菌DH 5α,挑选阳性单克隆,进行酶切鉴定。
2.2 重组腺相关病毒的包装及滴度测定
碱裂解法分别大量提取 pAAV-GFP、pXX2、phelper和pAAV-CD151、pAAV-antiCD151质粒,并用聚乙二醇超速离心纯化。用磷酸钙三质粒共转染法转染293细胞包装rAAV-CDl51、rAAV-antiCD151和rAAV-GFP病毒[10],收获病毒原液,纯化后备用。斑点杂交法测定病毒滴度[10]。
2.3 HUVEC培养
HUVEC用含胎牛血清、肝素钠的DMEM/F12培养基培养,胰酶消化后传代,制成细胞悬液,细胞计数后传至六孔板。随机分为四组:空白对照组、GFP组、CD151组、antiCD151组,根据病毒滴度于上述四组中按 500pfu/个细胞分别加入等体积 PBS、rAAV-GFP、rAAV-CD151和 rAAV-antiCD151转染。在37℃、5%CO2条件下,培养箱中过夜,次日各孔分别加入1 ml DMEM新鲜培养基,继续培养。
2.4 体外 Matrigel管型结构形成实验
转染 rAAV-CD151、rAAV-antiCD151和 rAAVGFP的细胞 5天后,更换成无血清的 DMEM继续培养。将 Matrigel置于冰浴中6 h溶解;以预冷的灭菌枪取250(l铺于24孔板底部,置冰浴,消除气泡;置37℃、5%CO2培养箱30 min使胶凝固;用0.05%的胰酶(含0.02%的EDTA)消化各组细胞,含0.5%胎牛血清的 DMEM培养基调整细胞为1×105/mL,每孔加入100 μl细胞悬液,继续培养36 h,并在显微镜下照相,选取 5个视野,使用 Scion Image软件计算类微血管结构的区域面积。
2.5 CD151、ERK、p38MAPK免疫印迹检测
收集各组按上述方法进行转染的细胞并提取总蛋白。配制SDS-PAGE凝胶,取含等量蛋白的裂解液,常规电泳,转膜,封闭;加入鼠抗人 CD151(或ERK、p38MAPK抗体)(1:1000),4℃过夜。加入相应的二抗(1:5000),37℃孵育2 h;ECL显色;GENE SNAP TOOL软件分析目的条带相对吸光度值,各组数据均用相应的 β-actin进行标准化处理。
2.6 CD151促血管生成的信号转导机制检测
在上述 matrigel的实验中,分别给予rAAVCD151转染+ERK抑制剂(PD98059,20 μmol/L),或+p38 MAPK抑制剂(SB203580,20 μmol/L)。转染后,再按上述方法检测细胞体外管型结构的形成。
2.8 统计学方法
结 果
1.病毒转染效率检测
本实验中采用三质粒共转染法进行病毒的包装。携带报告基因 GFP三质粒共转染法包装病毒,转染 24~48 h后,检测病毒包装的转染效率可达90%以上(图1)。其后,病毒转染细胞时,再进行病毒转染的转染率检测,转染率可达70%。
图1 三质粒共转染48 h后观察GFP表达,大多数细胞内均有GFP表达(400×)Fig.1 The GFP expression observed with inverted fluorescence microscope at 48h after triple-plasmid cotransfection
2.转染细胞后 CD151蛋白的表达
分别用rAAV-CD151、rAAV-antiCD151转染HUVECs细胞,结果发现 rAAV-CD151组 CD151蛋白表达明显较对照组和 rAAV-GFP组增加,差异有显著意义(P<0.05),而rAAV-antiCD151组CD151的蛋白表达则明显低于 rAAV-CD151组(P<0.05)(图2)。结果说明 rAAV-CD151促进了CD151蛋白的表达,而 rAAV-antiCD151则抑制蛋白的表达。
3.CD151促进体外管型结构的形成
与对照组和rAAV-GFP组相比,rAAV-CD151组体外管型结构形成明显增多(P<0.05);rAAV-antiCD151组与rAAV-CD151组比较,管型结构形成能力明显减弱,差异具有统计学意义(P<0.05)(图3,4)。结果说明CD151基因转染能促进体外管型结构的形成,而 antiCD151则抑制体外管型结构的形成。
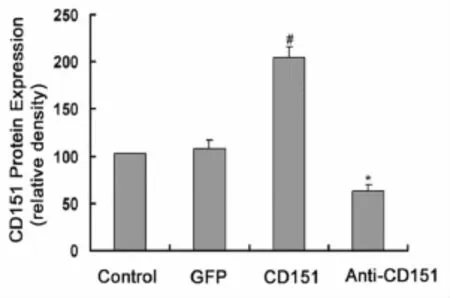
图2 Western blot法检测病毒转染后细胞 CD151蛋白表达(n=3)。CD151蛋白表达的相对吸光度值,均以均数 ±标准差表示。#,和对照组、rAAV-GFP组比较P<0.05;*,和rAAV-CD151组比较P<0.05Fig.2 Western blot analysis for the CD151 protein expression after rAAVs transfection.The relative density of CD151 protein expression.Data are mean±SEM.#,P<0.05 vs the control group and rAAV-GFP group;*,P<0.05 vs the rAAV-CD151 group
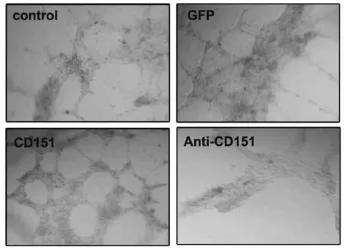
图3 在 Matrigel上类管型结构形成(n=3)。相差显微镜结果Fig.3 The capillary-like tube formation on Matrigel(n=3).The results was shown by inverted phase contrast microscope
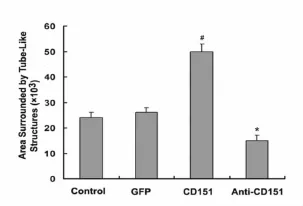
图4 Matrigel上管型结构形成(n=3)。使用Scion Image软件分析后的统计结果。#,和对照组、rAAV-GFP组比较P<0.05。*,和rAAV-CD151组比较P<0.05Fig.4 The area of the capillary-like tube formation on Matrigel(n=3).Quantitative analysis of the effect of CD151 on tube formation by Scion Image.#,P<0.05 vs the control group and rAAV-GFP group;*,P<0.05 vs the rAAV-CD151 group
4.ERK及 p38MAPK信号通路的激活
各组p-ERK、p-p38MAPK分别用ERK、p38MAPK进行标准化处理。结果显示rAAV-CD151组 p-ERK/ERK表达明显高于对照组和rAAV-GFP组,rAAV-antiCD151组 p-ERK/ERK表达明显低于rAAV-CD151组(P<0.05);而p-p38MAPK/p38MAPK表达在各组之间的差异不明显(P>0.05)(图5)。结果说明CD151可显著促进 ERK的磷酸化激活,而对p38 MAPK的磷酸化激活无显著作用。
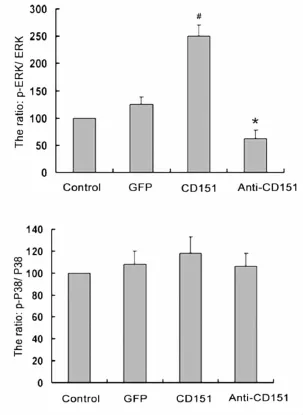
图5 Western blot法检测ERK、MAPKs蛋白表达。#,P<0.05与对照组、rAAV-GFP组比较 P<0.05;与rAAV-CD151组比较P<0.05Fig.5 Western blot analysis for the ERK and MAPKs proteins expression.#,P<0.05 vs the control group and rAAV-GFP group;*,P<0.05 vs the rAAV-CD151 group
5.ERK及 p38MAPK信号通路的激活在 CD151促进体外管型结构形成中的作用
重组腺相关病毒介导 CD151转染HUVECS细胞的同时,分别给予 ERK抑制剂或 p38 MAPK抑制剂,观察体外血管管型结构的形成。结果显示,ERK抑制剂显著抑制 CD151转染后促进的管型结构的形成(P<0.05),提示ERK介导了 CD151促进的管型结构形成的作用(图6)。而 p38MAPK则在 CD151促进管型结构形成中的作用不明显。
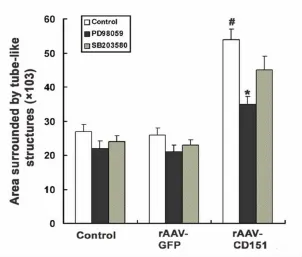
图6 CD151促类微血管结构形成的信号转导机制(n=3)。使用Scion Image软件分析后的统计结果。#,与对照组、rAAVGFP组比较P<0.05;*,与信号转导抑制剂外其它组比较P<0.05Fig.6 Signal transduction mechanism of CD151 promoting the capillary-like tube formation.Quantitative analysis of the effect of CD151 on tube formation by Scion Image.#,P<0.05 vs the control group and rAAV-GFP group;*,P<0.05 vs the groups without inhibitors
讨 论
TM4SF是整合素(integrin)重要的关联蛋白,是近年来被高度关注的一个基因家族,其中,CD151是TM4SF最重要的成员之一。CD151与多种整合素(α6β1、α3β1等)特异性结合形成 CD151-整合素复合体,作为众多信号转导分子的 “跨膜连接器”[12,13]。其中,CD151在血管生成的作用尤为引起研究的关注。
CD151在内皮细胞表达较高,而高表达CD151蛋白则可促进内皮细胞的迁移和迁移[14,15]。而CD151基因敲除小鼠的病理性血管生成显著被破坏,血管生成中的众多步骤如:迁移、伸展、浸润、基质胶接触、条索生成及出芽均受到影响[16];此外,CD151尤其影响生成血管的稳定性,CD151敲除则导致已生成血管的渗透性显著增加,生成的血管被破坏而不能维持[17]。我们课题组前期进行了有关 CD151与血管生成的体内研究,研究结果证实 CD151可促进缺血心肌组织的微血管形成,改善心梗后的心功能[8]。这些研究表明CD151具有促进体内外血管生成的作用,但是,其促血管生成的机制尚不清楚。
既往对CD151的机制研究发现,CD151能抑制RAS途径,Sawada等在鼠成纤维细胞中转染CD151质粒,他们发现 CD151下调PKB/c-Akt和 ERK1/2的表达,即 CD151在成纤维细胞中对ERK有抑制作用[18]。Takeda等进行 CD151基因敲除小鼠的研究,他们发现 CD151基因敲除的肺内皮细胞中导致 PKB/c-Akt、e-NOS、Rac及 Cdc42活性减弱,但是,Raf、ERK、p38MAPK、FAK和 Src的活性未发生变化[16],即CD151对ERK、p38MAPK信号通路的激活无显著作用。那么,在血管生成的过程中,ERK、p38MAPK信号通路的激活是否参与 CD151的促血管生成作用呢?我们研究发现CD151高表达可促进 ERK信号通路激活,但是,对 p38MAPK信号通路的激活无显著作用。但是,CD151可促进ERK信号激活,ERK信号通路是否介导 CD151促管型结构形成作用呢?
进一步的研究中,我们在 CD151转染细胞的同时分别加用了ERK抑制剂(PD98059)及 p38 MAPK抑制剂(SB203580)。我们的研究结果显示ERK抑制剂能部分逆转 CD151促 matrigel上管型结构形成作用,即ERK信号通路部分介导 CD151在 matrigel上促管型结构形成的作用。而 p38 MAPK抑制剂对此无显著作用。
本研究结果揭示了ERK信号通路和p38 MAPK信号通路在CD151促体外血管生成中的作用,这些结果说明 CD151可通过激活 ERK信号通路促进体外 matrigel上的管型结构生成,而 p38 MAPK信号通路不参与 CD151的促管型结构生成的作用。然而,血管生成是个极其复杂的过程,管型结构的形成只是其中某一个步骤。下一步的研究中,我们将探讨CD151在粘附、迁移、维持血管稳定性方面的机制。
[1]Hemler ME.Tetraspanin functions and associated microdomains.Nat Rev Mol Cell Biol.2005;6(10):801-811
[2]Fu H,Tan J,Yin Q.Effects of recombinant adeno-associated virus-mediated CD151 gene transfer on the expression of rat vascular endothelial growth factor in ischemic myocardium.Exp Ther Med.2015;9(1):187-190
[3]Baldwin G,Novitskaya V,Sadej R,Pochec E,Litynska A,Hartmann C,Williams J,Ashman L,Eble JA,Berditchevski F.Tetraspanin CD151 regulates glycosylation of(alpha)3(beta)1 integrin.JBiolChem.2008;283(51):35445-35454
[4]Lammerding J,Kazarov AR,Huang H,et al.Tetraspanin CD151 regulates alpha6beta1 integrin adhesion strengthening.Proc Natl Acas Sci USA.2003;100:7616-7621
[5]Sincock PM,Fitter S,Parton RG,et al.PETA-3/CD151,a member of the transmembrane 4 superfamily,is localised to the plasma membrane and endocytic system of endothelial cells,associates with multiple integrins and modulates cell function.J Cell Sci.1999;112:833-844
[6]Palmer TD,Martínez CH,Vasquez C,et al.Integrin-free tetraspanin CD151 can inhibit tumor cell motility upon clustering and is a clinical indicator of prostate cancer progression.Cancer Res.2014;74(1):173-187
[7]Li P,Zeng H,Qin J,et al.Effects of tetraspanin CD151 inhibition on A549 human lung adenocarcinoma cells.Mol Med Rep.2015;11(2):1258-1265
[8]Zuo H,Liu Z,Liu X,et al.CD151 gene delivery after myocardial infarction promotes functional neovascularization and activates FAK signaling.Mol Med.2009;15(9-10):307-315
[9]Liu WF,Zuo HJ,Chai BL,et al.Role of tetraspanin CD151-α3/α6 integrin complex:Implication in angiogenesis CD151-integrin complex in angiogenesis.Int J Biochem Cell Biol.2011.43(4):642-650
[10]Lan RF,Liu ZX,Liu XC,et al.CD151 promotes neovascularization and improves blood perfusion in a rat hind-limb ischemia model.J Endovasc Ther.2005;12:469-478
[11]Peng D,Zuo H,Liu Z,et al.The tetraspanin CD151-ARSA mutant inhibits angiogenesis via the YRSL sequence.Mol Med Rep;7(3):836-842
[12]Zhang XA,Kazarov AR,Yang X,et al.Function of the tetraspanin CD151-alpha6beta1 integrin complex during cellular morphogenesis.Mol Biol Cell.2002;13(1):1-11
[13]Yáñez-Mó M,Alfranca A,Cabañas C,et al.Regulation of endothelial cell motility by complexes of tetraspan molecules CD81/TAPA-1 and CD151/PETA-3 with alpha3 beta1 integrin localized atendothelial lateral junctions.J Cell Biol.1998;141(3):791-804
[14]Takeda Y,Kazarov AR,Butterfield CE,et al.Deletion of tetraspanin Cd151 results in decreased pathologic angiogenesis in vivo and in vitro.Blood.2007;109(4):1524-1532
[15]许富英,罗望翠,曾和松,等.整合素β1在CD151促HUVEC迁移增殖中的机制研究.中国组织化学与细胞化学杂志.2010;19(2):113-117
[16]Zhang F,Michaelson JE,Moshiach S,et al.Tetraspanin CD151 maintains vascular stability by balancing the forces of cell adhesion and cytoskeletal tension.Blood.2011;118(15):4274-4284
[17]Zheng ZZ,Liu ZX.Activation of the phosphatidylinositol 3-kinase/protein kinase Akt pathway mediates CD151-induced endothelial cell proliferation and cell migration.Int J Biochem Cell Biol.2007;39:340-348
[18]Sawada S,Yoshimoto M,Odintsova E,et al.The tetraspanin CD151 functions as a negative regulator in the adhesion-dependent activation of Ras.J Biol Chem.2003;278:26323-26326
CD151 promotes angiogenesis through the activation of ERK in vitro
Shen Xiaoqing,Yan Xiuting,Zuo Houjuan,Liu Zhengxiang,Fei Yujie,Liu Zhaoyu*.
(Department of Cardiology,TongJi Hospital,TongJi Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To assess the roles of extracellular signal-regulated kinase(ERK)and p38 mitogen-activated protein kinase(MAPK)in the CD151-induced capillary-like tube formation of human umbilical vein endothelial cells(HUVEC).Methods CD151,anti-CD151 and GFP were constructed into the recombinant adeno-associated virus(rAAV)vector and used to transfect HUVECs.After transfection,the expression of CD151 was measured.Tube formation was examined on matrigel.The potential involvement of p38MAPK and ERK signaling pathways was explored using ERK or p38 MAPK inhibitors.Results In the CD151 group,compared with the control and GFP groups,capillary-like tube formation in vitro was significantly promoted,while in the antiCD151 group it was significantly inhibited.The overexpressions of CD151 promoted the phosphorylation of ERK and increased the vitality of ERK,but not the phospho-p38 MAPK.Furthermore,CD151-induced capillary-like tube formation on matrigel was attenuated by the ERK inhibitor but not by the p38 inhibitor.Conclusion CD151 promotes capillary-like tube formation in vitro by activating the ERK signaling pathway,but not the p38MAPK signaling pathway.
CD151;Angiogenesis;Mitogen-activated protein kinase,MAPK;Extracellular signal-regulated kinase,ERK
Q463
A
10.16705/j.cnki.1004-1850.2015.05.001
2015-05-25
2015-07-02
国家自然科学基金项目资助(81000047)
沈小清,女(1963年),汉族,副主任护师
*通讯作者(To whom correspondence should be addressed):zhaoyuliu-33@hotmail.com
