功能山杏整仁的酶法制备条件优化及功能评价
2015-12-20张乔会董施斌王建中
崔 洁,李 琳,张乔会,董施斌,王建中,*
(1.北京林业大学自然保护区学院,北京 100083;2.北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
功能山杏整仁的酶法制备条件优化及功能评价
崔 洁1,李 琳2,张乔会2,董施斌2,王建中2,*
(1.北京林业大学自然保护区学院,北京 100083;2.北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
本研究对完整形态的山杏整仁进行酶解,使之释放出具有功能活性的短肽,以强化或赋予其保健功能,拟开发出具有降血糖和抗氧化活性的功能山杏仁产品。在单因素试验的基础上,采用响应面试验优化脱苦山杏整仁的酶解条件,得到的最佳酶解参数为:温度50 ℃、pH 7.0、加酶量6.0%、酶解时间8.0 h;同等条件下进行验证实验,得到山杏整仁的水解度为26.43%,与理论模型预测值27.85%基本相符。脱苦山杏整仁水解物表现出了良好的体外抗氧化能力和α-葡萄糖苷酶抑制活性。当质量浓度为10.00 mg/mL时,对1,1-二苯基-2-三硝基苯肼自由基、超氧阴离子自由基(O2-·)和羟自由基(·OH)的清除率分别为50.44%、65.22%、22.78%;当质量浓度为160.00 mg/mL时,其总还原力(吸光度)为1.072;通过超滤分离得到≤5、5~10、10~30、≥30 kD这4 组不同分子质量组分,当质量浓度为10.00 mg/mL时,对α-葡萄糖苷酶的抑制率分别为3.65%、4.43%、7.94%、10.00%;选取抑制效果最好的≤5 kD组分经凝胶层析进一步分离得到3 个洗脱峰,质量浓度为10.00 mg/mL时,3 个洗脱峰的α-葡萄糖苷酶抑制率分别为11.52%、10.65%、9.67%。结果表明:脱苦山杏整仁酶解后产生了具有良好抗氧化活性和抑制α-葡萄糖苷酶活性的多肽,与未经酶解的山杏整仁相比,其保健活性显著提高。
山杏整仁;功能食品;木瓜蛋白酶;响应面;抗氧化;α-葡萄糖苷酶抑制活性
山杏(Armeniaca sibirica)是蔷薇科杏属植物,又称西伯利亚杏,其杏仁可食,种皮深黄色或红棕色,略扁呈心形,种子长1~1.5 cm,宽约1 cm[1]。山杏蛋白的氨基酸组成丰富,含有8 种人体所必需的氨基酸,含量为7.92%,占到山杏蛋白氨基酸总量的30%左右,比其他坚果类食品氨基酸种类多、含量比例好,是良好的蛋白来源[2]。目前山杏蛋白的应用研究主要是制备功能多肽,或制成药剂形式的功能性产品或直接作为食品辅料加入食品中[3-4]。但因深加工水平落后使得我国杏仁主要以原料形式出口,2009年我国山杏整仁产量约2×104t,出口量7 000~8 000 t,占世界贸易量的80%[5]。随着杏仁产量不断提高,需要探索杏仁油脂特别是杏仁蛋白质的高值化、功能化开发手段,以杜绝不必要的资源浪费[6]。有研究发现,山杏整仁蛋白经酶消化后会释放出具有生物学功能的肽类,具有抗疲劳、调节激素分泌、调节生理代谢、促进矿质吸收、增进免疫调节、降血压、抗氧化等特性[7]。
以食品自身为载体,强化或赋予其一定的功能活性是当今功能食品的研究发展方向之一。本研究以脱苦山杏整仁为原料,经木瓜蛋白酶酶解山杏整仁(富肽功能山杏整仁),以期强化或赋予山杏整仁营养功能。首先以水解度为响应值,采用响应面方法优化山杏整仁酶解工艺参数,探索富含功能多肽的山杏整仁保健产品的加工技术;其次,评价山杏整仁酶解物的抗氧化活性和α-葡萄糖苷酶抑制活性。本研究旨在为富含功能性多肽的山杏整仁保健产品的研发提供新思路,并为其合理应用提供一定的理论指导。
1 材料与方法
1.1 材料与试剂
山杏整仁,由承德平泉亚欧杏仁贸易有限公司提供。
α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(纯度>99 %)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;Na2HPO4·12H2O、NaH2PO4·2H2O、Na2CO3、无水乙醇、木瓜蛋白酶(4.342×104U/g)、中性甲醛、石油醚、氢氧化钠、盐酸、柠檬酸 北京化工厂;邻苯三酚、三羟甲基氨基甲烷(Tris)、三氯乙酸、邻二氮菲、硫酸亚铁、双氧水、铁氰化钾、氯化铁 天津市津科精细化工研究所。以上试剂除特别说明外均为分析纯。实验用水为蒸馏水。
1.2 仪器与设备
FW100高速万能粉碎机 天津市泰斯特仪器有限公司;TH/T16MM台式高速离心机 湖南赫西仪器装备有限公司;恒温水浴锅、磁力搅拌器、752 紫外分光光度计上海美谱达仪器有限公司;PHS-3D型精密型pH计 上海三信仪表厂;真空冷冻干燥机LL-1500 赛默飞世尔科技(中国)有限公司;SENCOR-201旋转蒸发仪 上海申顺生物科技有限公司;Model-680酶标仪 美国Bio-Rad公司;高效液相色谱分析仪 上海沪西仪器分析厂有限公司。
1.3 方法
1.3.1 分析方法
山杏整仁含水量检测参考GB 5009.3-2010《食品安全国家标准食品中水分测定》;吸水率检验参考SN/T 0800.10-1999《进出口粮食、饲料吸水率检验方法》;水解度的测定方法参考文献[8-9]。
1.3.2 山杏整仁的酶解工艺流程及操作要点
酶解工艺流程:山杏整仁→脱苦→去皮→浸酶→培养→灭酶→烘干。
操作要点:将脱苦去皮的山杏整仁浸泡到按一定比例配制好的酶液中,55 ℃、一定酸碱度条件下充分浸渍4.0 h,将浸足酶液的山杏整仁取出密封,在一定温度条件下使用木瓜蛋白酶酶解,酶解好的山杏整仁于100 ℃灭酶10 min,在干燥箱中烘干,封袋保藏。脱苦方法[10]:脱苦时间20 min,液料比为10∶1(V/m),柠檬酸质量浓度为0.24 g/L,脱苦温度为82℃,真空度为-0.09 MPa。
1.3.3 山杏整仁酶解条件单因素试验
首先,固定酶解pH值为7.0、酶解时间为7.0 h、酶解温度为50 ℃,分别以加酶量(质量分数,下同)为4.0%、5.0%、6.0%、7.0%、8.0%进行酶解;其次,固定酶解pH值和酶解温度同上,加酶量为6.0%,分别酶解3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0 h;再次,分别在pH 5.0、6.0、7.0、8.0、9.0条件下进行酶解,固定其他因素同上;最后,分别以45、50、55、60、65℃环境进行酶解,固定其他因素同上。所有试验重复3 次,以水解度为指标确定最佳因素水平。
1.3.4 山杏整仁酶解条件响应面试验
根据单因素试验结果,选取影响酶解效果显著的3 个因素进行响应面优化试验,运用Design Expert 7.1软件,根据Box-Behnken中心组合试验设计原理[11-14],采用三因素三水平的响应面分析法,以山杏整仁水解度为响应值,确定最佳制备工艺。
1.3.5 山杏整仁酶解多肽的制备
根据1.3.4节得到的最佳酶解工艺制备山杏整仁,经粉碎磨粉过筛,取山杏整仁粉在50 ℃去离子水中恒温搅拌浸提1.0 h,冷却至室温,4 000 r/min离心10 min,取上清液冷冻干燥,备用。
1.3.6 山杏整仁酶解液的体外抗氧化能力测定
以未酶解的山杏整仁作为参照,测定山杏整仁酶解后抗氧化能力变化。其中, DPPH自由基清除率测定方法参照文献[15-16];超氧阴离子自由基清除率测定方法参照文献[17-18];羟自由基(·OH)清除率测定方法参照文献[19];还原力测定方法参照文献[20]。
1.3.7 山杏整仁酶解液中具有α-葡萄糖苷酶抑制剂活性(α-glucosidase inhibitor activity,AGA)组分的筛选分离
将山杏整仁酶解溶液微滤后,分别经截留分子质量为5、10、30 kD的超滤膜进行超滤,进行体外α-葡萄糖苷酶抑制活性检测,然后经凝胶层析分离,再测定其α-葡萄糖苷酶抑制活性。
层析条件:样品质量浓度:50 mg/mL;进样量2.0 mL;流速1.50 mL/min;洗脱液Tris-HCl缓冲液(pH 8.0);凝胶柱规格:1.5 cm×60 cm,填料为G-25葡聚糖凝胶,检测波长为280 nm[21]。
α-葡萄糖苷酶抑制率测定方法参照文献[22],有所调整。计算公式如下:
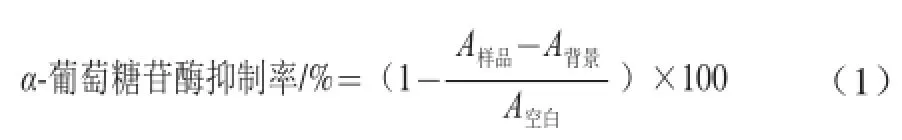
式中:A样品为样品体系在405 nm波长处的吸光度;A空白为空白体系在405 nm波长处的吸光度;A背景为不加酶体系在405 nm波长处的吸光度。
1.4 数据分析
每组实验均重复3 次,取平均值,采用t检验进行的显著性分析。
2 结果与分析
2.1 山杏整仁的含水量和吸水率
按照GB 5009.3-2010方法测得脱苦山杏整仁的含水量为3.80%左右。根据基础含水量,测定在50 ℃条件下山杏整仁的吸水率,结果如图1所示。

图1 山杏整仁吸水率变化Fig.1 Effect of hydrolysis time on water-absorbing capacity of apricot kernel
由图1可知,山杏整仁在前2 h内吸水迅速,而后趋于平缓,在第4小时山杏整仁的吸水率达到53.34%,与第3小时差异显著(P<0.05),而第5小时后山杏整仁的吸水率有所减小,可能是山杏整仁中的可溶性物质溶出所致,故确定山杏整仁酶解液浸渍时间为4.0 h。
2.2 单因素试验结果

图2 不同单因素对山杏整仁水解度的影响Fig.2 Effects of different factors on enzymatic hydrolysis of apricot kernel
由图2a可知,在一定条件下,山杏整仁水解度随木瓜蛋白酶加酶量的增加也平稳增加,当加酶量在8%时,水解度达到28.03%,说明底物与酶解条件一定的情况下,山杏整仁水解度随加酶量的递增而增加。酶用量继续增加,水解度变化幅度不大,可能是酶解液已达到饱和状态。同时酶用量太大会影响山杏整仁的口感和色泽,导致其感官食用性降低;由图2b可知,温度在50℃时,山杏整仁水解度达到了最大值25.85% (P<0.05),随后温度升高,水解度反而下降,这可能是温度超过木瓜蛋白酶的最适温度,导致酶活性下降,酶解效果降低;由图2c可知,当pH<7.0时,随pH值升高,山杏整仁水解度提高,在pH 7.0时达到最大值25.76%(P<0.05),而在pH>7.0后山杏整仁水解度开始降低,这可能是超出木瓜蛋白酶最适pH值所致;由图2d可知,当酶解时间<8 h时,山杏整仁水解度随酶解时间延长而增加,趋势明显;第8小时达到25.53%(P<0.05),之后随时间延长增加幅度减小,这可能是底物减少造成的。
2.3 响应面试验结果
2.3.1 响应面数据及模型的建立
在单因素试验结果的基础上进行进一步优化试验,以酶解温度、酶解pH值、加酶量3 个因素作为变量,以水解度Y为响应值,设计响应面试验(表1)。

表1 Box-Behnken试验设计方案与结果Table 1 Box-Behnken design with experimental values of hydrolysis degree
根据表1的试验结果,经回归分析后得回归方程:


表2 回归方程方差分析Table 2 Analysis of variance of regression equation
由表2可知,此回归模型的F值为242.16,P<0.001,表明该模型高度显著,并由P值可知,只有<0.1%的机率发生模拟无效,而失拟项不显著,这说明该模型符合实际实验情况,能够很好地模拟该实验的结果。
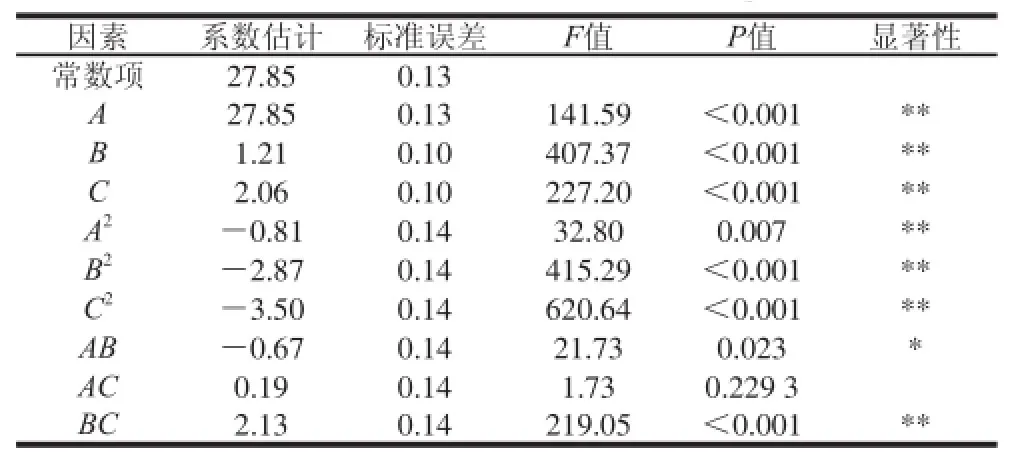
表3 回归方程系数显著性检验Table 3 Signifi cance test of regression equation
由表3可知,各因素对水解度的影响均极显著(P<0.01)。由F值可知,各因素对山杏整仁水解度的影响次序是酶解pH值>加酶量>酶解温度。
2.3.2 响应面分析
利用Design Expert软件根据响应面模型的拟合结果,以山杏整仁水解度为响应值,固定1 个因素于中心水平,以另外2个因素为自变量绘制响应面和等高线,见图3。由图中可以直观看出该响应面模型具有最高点。


图3 不同因素交互作用的响应面和等高线Fig.3 Response surface and contou r plots for the effects of different factors on hydrolysis degree
根据上述模型拟合结果可知,山杏整仁的最优酶解工艺是酶解温度50 ℃、酶解pH 7.0、加酶量6.0%,在此条件下模型预测山杏整仁水解度最高为27.85%。为了检验模型预测结果是否可靠,对上述条件进行了验证,得到山杏整仁水解度为26.43%,与预测值基本一致,由此得出该模型可以很好地模拟预测山杏整仁的酶解条件。
2.4 山杏整仁酶解液的体外抗氧化活性
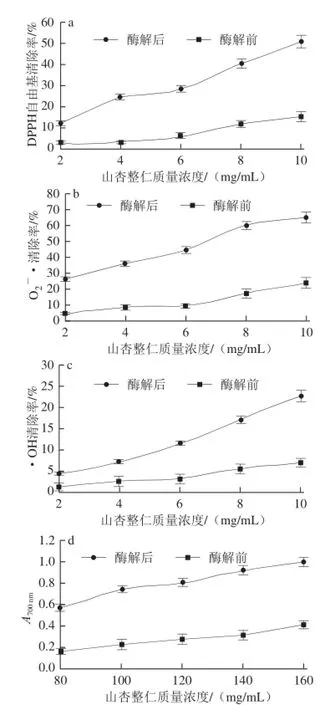
图4 山杏整仁酶解液的抗氧化能力Fig.4 Antioxidant activity of apricot kernel hydrolysate
由图4a可知,未经酶解的山杏整仁同样具有一定的DPPH自由基清除能力,经对比可看出,酶解山杏整仁清除DPPH自由基的能力更强,且清除率与剂量相关,说明酶解产生了更多清除DPPH自由基的小分子肽类。当酶解山杏整仁质量浓度为10.00 mg/mL时,DPPH自由基清除率达到了最大值50.44%(P<0.05);由图4b可知,酶解后山杏整仁清除O2-·能力也明显提升,且清除能力随质量浓度增加而增强。当酶解山杏整仁质量浓度为10.00 mg/mL时,清除率达到65.22%(P<0.05)。而后O2-·清除效果逐渐趋于平稳状态,这说明山杏整仁经酶解后多肽含量增多,逐步达到其最大清除能力;山杏整仁经酶解清除·OH能力亦明显提高,且随质量浓度升高稳定上升,当酶解山杏整仁质量浓度为10.00 mg/mL时,·OH清除率达到22.78%(P<0.05),说明酶解后山杏整仁具有更好的清除·OH能力;山杏整仁较酶解前还原力大幅提升且与样品质量浓度成正相关,当质量浓度为160.00 mg/mL时,在700 nm波长处的吸光度达到1.072 (P<0.05),这说明酶解使得山杏整仁具有更好的还原力。这些结果与先磨粉后酶解的山杏整仁多肽抗氧化能力结果非常接近[2],同时与其他蛋白酶解产物相比较[23],抗氧化能力更有优势,这也充分印证了酶解山杏整仁富含多肽的营养价值。
2.5 山杏整仁酶解液AGA测定结果
2.5.1 超滤组分AGA测定结果

图5 不同分子质量山杏整仁多肽α-葡萄糖苷酶抑制率曲线Fig.5 Inhibition curves of apricot kernel peptides with different molecular weights against α-glucosidase
由图5可知,随质量浓度增加,不同分子质量超滤组分的α-葡萄糖苷酶抑制率都相应增加;当质量浓度为10.00 mg/mL时,≤5、5~10、10~30、≥30 kD组分对α-葡萄糖苷酶的抑制率可分别达10.00%、7.94%、4.43%、3.65%。说明分子质量越小,α-葡萄糖苷酶抑制效果越好。这与王晟等[24]对山杏整仁先磨粉后酶解的结果相比,抑制效果接近但是稍弱一些,原因可能是山杏整仁与酶解液接触不充分,酶解效果较后者弱一些;与蜂王浆水溶性蛋白多肽的抑制效果趋势一致[25],分子质量越小,抑制效果越好。
2.5.2 山杏整仁酶解液中≤5 kD组分凝胶层析结果与AGA分析

图6 6 ≤5 kD活性组分的Sephadex G-25分离谱图(a)及分离组分的AGA比较结果(b)bFig.6 Separation of ≤ 5 kD peptides isolated from pepsin hydrolysate using Sephadex G-25 and their inhibitory effect curves
由图6可知,山杏整仁酶解液中≤5 kD组分经凝胶层析分离得到3 个洗脱峰,当质量浓度为10.00 mg/mL时,3 个洗脱峰的α-葡萄糖苷酶抑制率分别为11.52%、10.65%、9.67%,洗脱峰1中多肽活性较高。与分离前抑制效果区别不大,这一点与蜂王浆水溶性蛋白多肽不同[25],后者分子质量变小之后,尤其是<650 D的分子质量片段,抑制效果可以达到35%。
3 结 论
本实验测得脱苦山杏整仁含水量为3.80%,且第4小时吸水率基本接近最大值,为53.34%,故后期山杏整仁在酶液中浸泡时间定为4.0 h。
通过响应面方法优化了山杏整仁最佳酶解条件为:酶解温度50℃、酶解pH 7.0、加酶量6.0%。并在此条件下进行验证实验,水解度为26.43%,与预测值27.85%相接近,说明该响应面模型可以很好地模拟预测山杏整仁酶解条件。而且,本实验制备酶解山杏整仁的方法工艺简单、技术成熟、易于实现工业化生产。
本实验测得山杏整仁经酶解后具有更好的抗氧化活性和一定的α-葡萄糖苷酶抑制作用,其中酶解物中≤5 kD组分在经Sephadex G-25凝胶层析前后α-葡萄糖苷酶抑制活性变化不大,表明酶解后富含多肽的山杏整仁的抗氧化应激损伤和抑制餐后血糖上升的能力明显增强,同时也说明无需进行功能活性部位的分离提纯,这将大大降低加工成本。因此,通过整仁酶解方法提升山杏整仁的功能保健性与食用性是可行的。
[1] 李强. 志丹杏杏仁中苦杏仁苷提取、纯化及水解研究[D]. 西安: 陕西师范大学, 2006: 1-2.
[2] 顾欣, 崔洁, 李迪, 等. 山杏仁肽的体外抗氧化活性研究[J]. 中国油脂, 2012, 37(9): 40-43.
[3] 张昊, 任发政. 天然抗氧化肽的研究进展[J]. 食品科学, 2008, 29(4): 443-447.
[4] 田金强, 兰彦平, 朱克瑞, 等. 欧李仁综合利用关键技术研究[J]. 中国油脂, 2012, 37(2): 65-69.
[5] 王静, 李兴文, 张雪峰, 等. 我省山杏仁生产大发展初探[J]. 河北林业, 2009(2): 9.
[6] 宋曰钦, 王建中, 赵云霞, 等. 苦杏仁蛋白开发利用的前景[J]. 中国农学通报, 2006, 22(1): 68-70.
[7] 盛小娜, 王璋, 许时婴. 甜杏仁蛋白的功能和结构的研究[J]. 食品工业科技, 2008, 29(5): 133-136.
[8] 孙立, 毛晓英, 陈计峦, 等. 碱性蛋白酶酶解红花籽蛋白制备抗氧化肽工艺的研究[J]. 中国油脂, 2014, 39(9): 31-35.
[9] 谈佳玉, 王承明. 响应面法优化酶法制备花生蛋白的工艺研究[J].中国粮油学报, 2011, 26(8): 100-104.
[10] 张乔会, 李军, 逄锦慧, 等. 响应面法优化山杏仁脱苦工艺的研究[J].食品工业科技, 2014, 35(21): 248-252.
[11] 曲留柱, 金世超, 崔洁, 等. 响应面优化闪式提取香蕉多酚氧化酶[J].食品科学, 2013, 34(2): 136-142.
[12] WANG G, DONG Zuomin, AITCHISON P. Adaptive response surface method: a global optimization scheme for approximation-based design problems[J]. Engineering Optimization, 2001, 33(6): 707-734.
[13] FAN Sanhong, HU Yanan, LI Chen, et al. Optimization of preparation of antioxidative peptides from pumpkin seeds using response surface method[J]. PLoS ONE, 2014, 9(3): e92335. doi: 10.1371/journal. pone.0092335.
[14] TANG Desong, TIAN Yingjuan, HE Yuanzhe, et al. Optimisation of ultrasonic-assisted protein extraction from brewer’s spent grain[J]. Czech Journal of Food Science, 2010, 28(1): 9-17.
[15] 杨少辉, 宋英今, 王洁华, 等. 雪莲果体外抗氧化和自由基清除能力[J].食品科学, 2010, 31(17): 166-169.
[16] MOON J Y. Antioxidant and antiproliferative activities of mango (Mangifera indica L.) fl esh and peel[J]. Food Chemistry, 2010, 121(2): 429-436.
[17] 赵艳红, 李建科, 李国荣. 石榴皮多酚纯化及其抗氧化活性表征[J].食品科学, 2010, 31(11): 31-37.
[18] LIU Qian, KONG Baohua, XIONG Youling, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010, 118(2): 403-410.
[19] YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach (Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry, 2011, 124(1): 188-194.
[20] 崔洁, 顾欣, 黄昆, 等. 山杏果肉可溶性膳食纤维的抗氧化活性与红外光谱分析[J]. 食品与发酵工业, 2012, 38(1): 123-127.
[21] GU Xin, HOU Yakun, LI Di, et al. Separation, purification and identifi cation of angiotensin I: converting enzyme inhibitory peptides from walnut (Juglans regia L.) hydrolyzate[J]. International Journal of Food Properties, 2015, 18(2): 266-276.
[22] 周琳娜. 杜仲叶的发酵及其α-葡萄糖苷酶抑制活性[D]. 北京: 北京林业大学, 2012: 13-14.
[23] 范金波, 王芳, 孙雁, 等. 丝胶蛋白酶解产物抗氧化活性的研究[J].食品科学, 2008, 29(5): 250-253.
[24] 王晟, 崔洁, 顾欣, 等. 木瓜蛋白酶制备山杏源降糖肽工艺优化研究[J].食品工业科技, 2014, 35(9): 169-173.
[25] 励建荣, 齐旦旦, 张蕾. 蜂王浆水溶性蛋白质及其水解多肽对自由基的清除能力和对胰脂肪酶和α-葡萄糖苷酶的抑制活性[J]. 中国食品学报, 2012, 12(9): 8-15.
Optimization of Enzymatic Hydrolysis Whole Apricot (Armeniaca sibirica) Kernel and Biological Activities of Its Hydrolysate
CUI Jie1, LI Lin2, ZHANG Qiaohui2, DONG Shibin2, WANG Jianzhong2,*
(1. School of Nature Conservation, Beijing Forestry University, Beijing 100083, China; 2. Beijing Key Laboratory of Forest Food Processing and Safety, College of Biological Sciences and Technology, Beijing Forestry University, Beijing 100083, China)
By using single factor and orthogonal array designs, the optimized hydrolysis conditions of whole apricot kernel employing papain for improved degree of hydrolysis were obtained as hydrolysis temperature of 50 ℃, initial pH of 7.0, hydrolysis time of 8.0 h, and enzyme concentration of 6.0%. Under these conditions, the maximum experimental value of hydrolysis degree of 26.43% was achieved, agreeing with the predicted value of 27.85%. This paper also reports on the antioxidant activity and α-glucosidase inhibitory effect of the enzymatic hydrolysate. The scavenging rates of 1,1-diphenyl-2-picrylhydrazyl radical (DPPH), superoxide anion radicaland hydroxyl radical (·OH) with the hydrolysate at a concentration of 10.00 mg/mL were 50.44%, 65.22% and 22.78%, respectively. When the concentration increased to 160.00 mg/mL, the absorbance value for reducing power was 1.072. Four peptides extracted from the hydrolysate were separated by ultrafiltration as ≤ 5, 5-10, 10-30 and ≥ 30 kD. The inhibitory rates of α-glucosidase by the four peptides at 10.00 mg/mL were 3.65%, 4.43%, 7.94% and 10.00%, respectively. Then, the peptide fraction with molecular weight less than 5 kD, the most active against α-glucosidase, was further separated into three components by gel filtration chromatography, with inhibitory rates on α-glucosidase of 11.52%, 10.65% and 9.67%, respectively. The results showed that the peptides derived from enzymatic hydrolysate of whole apricot kernel have good antioxidant activity and α-glucosidase inhibitory effect in vitro, exert ing improved health-protective effects than native apricot kernel.
whole apricot kernel; functional food; papain; response surface methodology; antioxidant activity; α-glucosidase inhibitory activity
TS201.2
A
1002-6630(2015)19-0153-06
10.7506/spkx1002-6630-201519027
2014-12-18
国家林业局林业公益性行业科研专项(201004081)
崔洁(1986-),女,博士,研究方向为植物资源利用与天然产物开发。E-mail:cuijie@bjfu.edu.cn
*通信作者:王建中(1952-),男,教授,硕士,研究方向为植物资源利用与天然产物开发,农副产品加工与贮藏保鲜,区域农业规划。E-mail:w62338221@163.com
