不同体积分数乙醇沉淀桑黄胞内多糖的理化性质及抗氧化活性
2015-12-20周慧吉马海乐郭丹钊王振斌
周慧吉,马海乐,郭丹钊,王振斌
(江苏大学 江苏省农产品物理加工重点实验室,江苏 镇江 212013)
不同体积分数乙醇沉淀桑黄胞内多糖的理化性质及抗氧化活性
周慧吉,马海乐*,郭丹钊,王振斌
(江苏大学 江苏省农产品物理加工重点实验室,江苏 镇江 212013)
研究桑黄胞内多糖醇沉过程中乙醇体积分数对多糖得率、纯度、理化性质和抗氧化活性等的影响。结果表明:随着乙醇体积分数的增加,沉淀粗多糖的得率增加,而粗多糖中多糖含量呈现不规则的变化;不同体积分数乙醇沉淀获得的桑黄多糖中均含有木糖、甘露糖、半乳糖和葡萄糖。扫描电镜图像显示,低体积分数(65%、75%、85%)乙醇沉淀的多糖呈现均匀球状,高体积分数(95%)乙醇沉淀的多糖连成大块片状。桑黄胞内多糖体外抗氧化能力存在明显的量-效关系,95%乙醇沉淀的多糖对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基的清除效果最好,对Fe3+的还原能力最强,抗氧化活性最高。
桑黄;胞内多糖;理化性质;体外抗氧化活性
桑黄是我国的一种传统药物,通常生长在桑属植物上,因其子实体颜色鲜黄而俗称为桑黄。桑黄的主要活性成分是桑黄多糖和黄酮类化合物[1-2]。有关研究证明,桑黄多糖具有抗肿瘤、抗突变、抗氧化、免疫调节、抗肝硬化和保肝等活性功能[3-4]。由于桑黄自然生长缓慢,液体发酵成为了工业化高效制备桑黄多糖的重要途径[5-6]。醇沉是从发酵提取液中分离多糖的主要方法,乙醇体积分数直接影响着所获得多糖的结构及其性质。本研究在前期优化桑黄菌丝体液体发酵及其胞内多糖提取技术的基础上,重点针对利用乙醇沉淀获取提取液粗多糖的过程中,乙醇体积分数对多糖得率、纯度、理化性质和抗氧化活性等的影响开展研究,旨在为桑黄多糖的高效制备和科学利用提供技术支持。
1 材料与方法
1.1 材料、试剂与培养基
桑黄菌株(菌株编号为5.95),购于中国普通微生物菌种保藏管理中心。
氯仿、正丁醇、盐酸羟胺、吡啶、盐酸、苯酚、水杨酸、氯化钠、磷酸氢二钠、磷酸二氢钠、醋酸钠均为国产分析纯。
培养基由小麦粉51.6 g、米糠13.8 g、磷酸二氢钾0.9 g、硫酸镁0.54 g组成,加自来水配制至1 000 mL。
1.2 仪器与设备
CARY紫外扫描分光光度计 美国瓦里安公司;YC-211恒温培养摇床 上海福玛实验设备有限公司;HP6890N气相色谱仪、DEC-A2型表面处理仪、HITACHI S-570型扫描电子显微镜 美国Agilent公司。
1.3 方法
1.3.1 摇瓶液体发酵
在250 mL三角瓶中装100 mL配制好的发酵培养基,按体积分数10%的量接种桑黄菌种,发酵温度为27.5 ℃,摇床转速为125 r/min,发酵时间为7 d,发酵结束后过滤菌丝,冷冻干燥后备用[7]。
1.3.2 桑黄粗多糖的提取与醇沉实验
将干燥的桑黄菌丝体碾磨粉碎。加入10 倍体积分数为70%的乙醇,静置12 h,5 000 r/min离心10 min去除上清液,旨在脱除黄酮类物质。离心残渣中按照1∶30 (m/V)的料液比加入水,于100 ℃水浴锅中水煮2 h,以同样的料液比水煮3 次。10 000 r/min离心15 min后收集上清液[8-9],旋转蒸发浓缩至原来体积的1/4。分别加入4 倍体积分数为65%、75%、85%、95%的乙醇,过夜。10 000 r/min离心10 min取沉淀,真空冷冻后即得到桑黄粗多糖[10]。研究不同体积分数醇沉多糖的组成及其特性。
1.3.3 桑黄多糖的检测分析
按照上述提取条件对Sevag法[11]除蛋白后得到的粗多糖的多糖含量、单糖组成、红外光谱、体外抗氧化活性、电镜扫描进行测试分析。
1.3.3.1 多糖含量测定
参照文献[12-13]的方法进行标准曲线的绘制和桑黄多糖含量的测定,通过式(1)、(2)计算粗多糖得率及多糖含量。

1.3.3.2 单糖组成分析
采用糖精乙酸酯作为衍生物,气相色谱法测定桑黄多糖的单糖组成[12]。
1.3.3.3 黄酮含量测定
用电子天平精确称取芦丁标准品5 mg,于25 mL容量瓶中,并用70%乙醇溶解定容,配制成0.2 mg/mL的标准溶液。取0.0、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL容量瓶中,加蒸馏水至6 mL,依次加入质量分数5%亚硝酸钠1 mL,摇匀静置6 min。加入质量分数10%硝酸铝1 mL,摇匀静置6 min;再加入质量分数4.3%氢氧化钠10 mL,最后加蒸馏水定容,摇匀静置15 min。空白参照液直接加入6 mL蒸馏水,后面依次加入相同的试剂。用紫外分光光度计在510 nm波长处测定吸光度,绘制标准曲线。准确称取各粗多糖样品0.5 g加6 mL蒸馏水,按上述方法测定吸光度,计算黄酮含量。
1.3.3.4 红外光谱扫描[13]
取样品l mg,溴化钾压片,测定范围4 000~400 cm-1。
1.3.3.5 体外抗氧化活性测定
采用文献[14]的方法进行1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定;采用文献[15]的方法进行羟自由基(·OH)清除能力的测定;参照Rice-Evans等[16]所报道的方法进行水溶性VE(trolox)等价抗氧化能力(trolox equivalent antioxidant capacity,TEAC)测定;采用文献[17]的方法进行铁离子还原能力(ferric reducing antioxidant potential assay,FRAP)的测定。
1.3.3.6 扫描电镜观察
将冻干的多糖样品直接压在涂过导电银胶的样品台上,用DEC-A2型表面处理仪喷镀金原子,采用HITACHI S-570型扫描电子显微镜观察并拍照。
2 结果与分析
2.1 桑黄粗多糖中多糖含量

表1 乙醇体积分数对桑黄粗多糖中多糖含量的影响Table 1 Effect of alcohol concentration on crude polysaccharide yield and protein content
不同体积分数乙醇沉淀桑黄粗多糖得率及其多糖含量如表1所示,随着乙醇体积分数的增加,沉淀粗多糖的得率增加,而粗多糖中多糖含量呈现不规则的变化,其主要原因可能在于当乙醇体积分数达到一定值之后,乙醇体积分数的变化更多的是影响到沉淀中粗多糖的结构,因为低体积分数乙醇沉淀下来的主要是高分子质量的多糖、高体积分数乙醇沉淀下来的则是较小分子质量的多糖和低聚糖。分子质量越小,分子中的自由氨基越多,可能致使其活性增强[18-19]。当然多糖的生物活性不仅与分子质量大小有关,还与其立体结构、糖单元的组成、糖苷键的类型、取代基的种类及数量等都有密切关联[20-21]。后续将研究不同体积分数乙醇沉淀所得多糖的结构与抗氧化活性的变化。各粗多糖样品在510 nm波长处的吸光度均基本为0.0,说明粗多糖中不存在或存在非常少的黄酮类物质。
2.2 桑黄粗多糖中单糖组成分析
采用鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖6 种标准单糖样品作为参照,进行桑黄粗多糖的单糖组成分析。标准单糖的气相色谱图如图1所示,不同体积分数醇沉多糖的气相色谱图如图2所示,其定量分析结果见表2。

图1 单糖标准品的气相色谱图Fig.1 Gas chromatogram of mixed monosaccharide standards
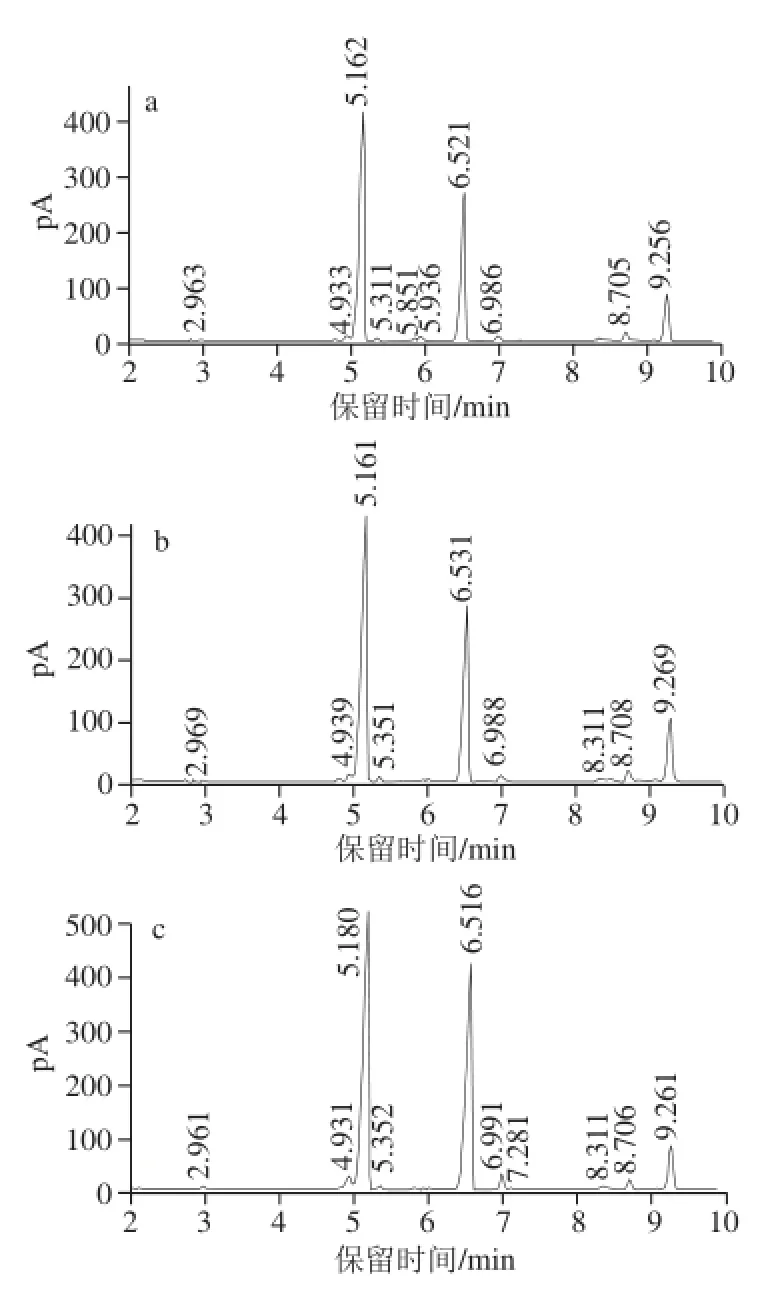

图2 不同体积分数乙醇沉淀样品的气相色谱图Fig.2 Gas chromatogram of samples precipitated by different alcohol concentrations
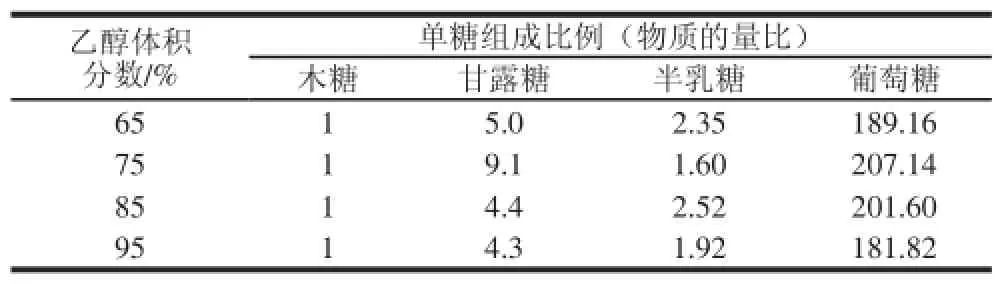
表2 乙醇体积分数对单糖组分的影响Table 2 Effect of alcohol concentration on monosaccharide composition of crude polysaccharides
由表2和图2可知,不同体积分数乙醇沉淀的多糖样品单糖组成相似,均含有木糖、甘露糖、半乳糖和葡萄糖,但单糖组成比例有一定的差异。此外,4 种样品均包含1 种未知单糖成分,其出峰时间大约在6.5 min左右,该单糖峰在4 种样品中的含量也略有差异。
2.3 桑黄多糖的红外光谱分析
用来检测化合物结构的红外光谱通常指波数在4 000~400 cm-1之间的中红外光谱。其具有高度的特征性,能够测定分子内部原子间的相对振动和分子转动等信息,是研究聚合物结构和化学键,表征或鉴别不同化合物的常用手段之一。由于多糖的结构具有一定的相似性,所以多糖的红外光谱具有某些相同的特征吸收峰[22]。在红外光谱中,3 400 cm-1附近是O-H和N-H键较强的伸缩振动吸收峰,在2 920 cm-1附近的吸收峰是-CH2或-CH3中C-H键的伸缩振动引起的,在1 600 cm-1附近的吸收峰可能是COO-中的C=O键的不对称伸缩振动引起的或是N-H变角振动引起的,1 400 cm-1附近的吸收峰可能是由-COOH中的C-O键伸缩振动或是C-H键的反对称伸缩振动和变角振动引起的;1 000 cm-1附近的吸收峰是由C-O-H和吡喃糖环的C-O-C中的两种C-O键的伸缩振动引起的。
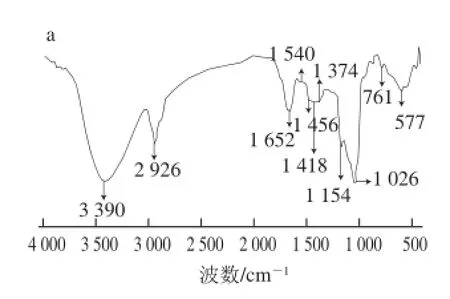
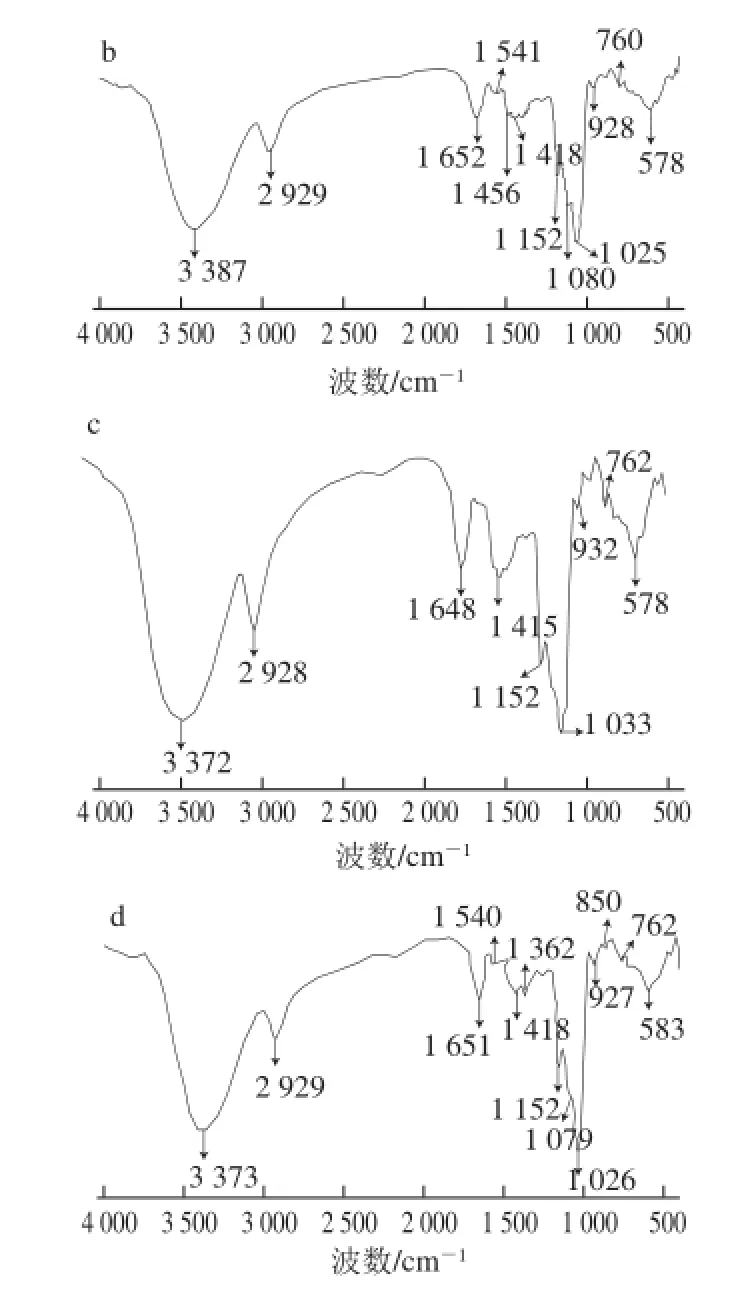
图3 不同体积分数乙醇提取桑黄多糖的红外光谱图Fig.3 Infrared spectra of polysaccharides precipitated by different ethanol concentrations
由图3可知,所有的多糖均在3 420、2 900、1 400、1 100 cm-1这4 个区域出现糖类物质的典型特征吸收峰,而且在1 000~800 cm-1间有许多弱小吸收峰,说明可能含有β-D-吡喃葡萄糖环,可能以β-糖苷键连接。可以看出,不同体积分数乙醇沉淀的多糖在结构上并无明显不同。
2.4 桑黄多糖的形态

图4 桑黄多糖的扫描电镜图Fig.4 SEM ima ges of polysaccharides precipitated by different ethanol concentrations
图4是不同体积分数乙醇沉淀桑黄多糖的扫描电镜图。可以看出65%、75%、85%乙醇沉淀的多糖呈球状,比较均匀。95%乙醇沉淀的多糖会有大块片状出现。随着乙醇体积分数的升高,桑黄多糖粒径增大,紧密度减小,变得松散,当乙醇体积分数达到95%时,桑黄多糖已经连成片状。
2.5 桑黄多糖的体外抗氧化活性
2.5.1 DPPH自由基清除效果
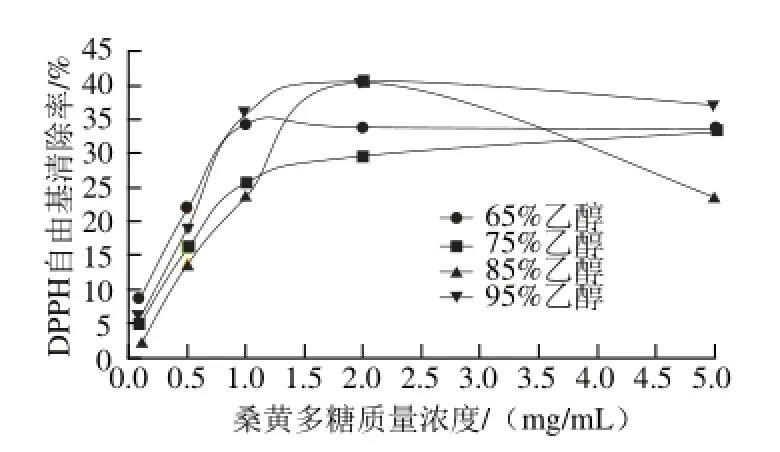
图5 不同体积分数乙醇沉淀桑黄多糖的DPPH自由基清除率Fig.5 DPPH radical scavenging rates of Phellinus igniarius polysaccharides precipitated by different ethanol concentrations
由图5可知,低体积分数乙醇提取的桑黄多糖,随着多糖质量浓度的增加,其对DPPH自由基的清除率升高,且量-效关系明显,但是桑黄多糖质量浓度较高时,其DPPH自由基清除率略微下降,有可能是乙醇将多糖析出,从而了影响体系吸光度。桑黄多糖质量浓度为2 mg/mL时,65%、75%、85%、95%乙醇沉淀的多糖对DPPH自由基的清除率分别为(33.85±2.00)%、(29.61±0.05)%、(40.40±0.15)%和(40.57±1.35)%。95%乙醇提取的桑黄多糖对DPPH自由基清除率最高,是75%体积分数乙醇的1.31 倍。
2.5.2 ·OH清除效果

图6 不同体积分数乙醇沉淀桑黄多糖的·OH清除率Fig.6 Hydroxyl radical scavenging rates of Phellinus igniarius polysaccharides precipitated by different ethanol concentrations
图6是不同体积分数乙醇沉淀的多糖对·OH清除率的影响。随着多糖质量浓度的增加,其对反应体系产生的·OH的清除率增大,量-效关系非常明显。在相同质量浓度下,65%、75%、85%、95%乙醇沉淀的桑黄多糖清除·OH的IC50分别为3.19、3.60、3.86、3.18 mg/mL。IC50越小,说明所需的多糖质量浓度越低,其抗氧化性越好。以上实验数据均表明,不同体积分数乙醇制取的桑黄多糖对·OH清除效果只有略微差别。
2.5.3 TEAC值
以水溶性VE为参照物,测得不同质量浓度水溶性VE与TEAC值的校准曲线方程为y=0.891 7x+0.028 3 (R2=0.998 8)。图7是不同体积分数乙醇沉淀桑黄多糖的TEAC值,65%、75%、85%、95%乙醇沉淀的桑黄多糖的TEAC值分别为(0.149±0.006)、(0.122±0.004)、(0.141±0.006)、(0.176±0.005) μmol/mg。

图7 不同体积分数乙醇沉淀桑黄多糖的TEAC值Fig.7 TEAC values of polysaccharide precipitated by different ethanol concentrations
2.5.4 FRAP值
以FeSO4为参照物,测得不同质量浓度FeSO4与FRAP值的校准曲线方程为y=0.018 1x-0.017 5(R2= 0.994 1)。图8是不同体积分数乙醇沉淀桑黄多糖的FRAP值,65%、75%、85%、95%乙醇沉淀的桑黄多糖得到的FRAP值分别为(9.59±0.20)、(8.56±0.04)、(10.58±0.32)、(10.66±0.45)mmol/L。
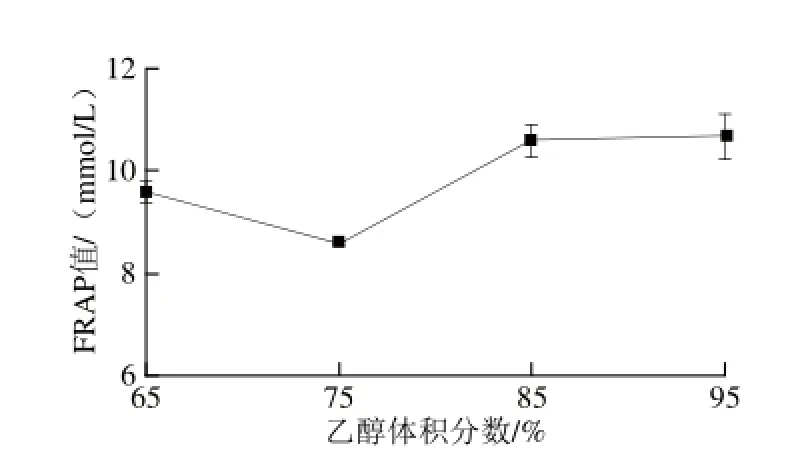
图8 不同体积分数乙醇沉淀桑黄多糖的FRAP值Fig.8 FRAP values of polysaccharides precipitated by different ethanol concentrations
3 结 论
本实验初步研究了不同体积分数乙醇对桑黄胞内多糖的提取、理化性质和单糖组成的影响,并以此为基础探讨桑黄胞内多糖的体外抗氧能力,为深入研究桑黄多糖的化学结构和生物活性的构效关系提供参考。
不同体积分数乙醇沉淀可能会影响桑黄多糖的分子质量、糖单元组成、立体结构,从而改变多糖的生物活性。随着乙醇体积分数的增加,粗多糖的得率增加,而粗多糖中多糖含量呈现不规则的变化;不同体积分数乙醇沉淀获得的桑黄多糖中均含有木糖、甘露糖、半乳糖和葡萄糖,但是各种多糖间比例存在差异,并且4 种样品中均检测出一种未知成分。红外光谱扫描结果显示65%、75%、85%、95%乙醇沉淀获得的样品均在3 420、 2 900、1 400、1 100 cm-1区域内出现糖类物质的典型特征吸收峰,并且都含有β-D-吡喃葡萄糖环,在结构上类似;而单糖成分及结构的差异性也会引起桑黄多糖生物活性的差异性[23-24]。
扫描电镜图像显示,低体积分数乙醇沉淀的多糖呈现均匀球状,高体积分数乙醇沉淀的多糖连成大块片状。随着乙醇体积分数的升高,桑黄多糖粒径增大,紧密度减小,松散度增加;桑黄胞内多糖体外抗氧化能力存在明显的量-效关系,95%乙醇沉淀的桑黄多糖抗氧化活性最高,其对DPPH自由基清除率为40.57%、清除·OH的IC50为3.18 mg/mL、TEAC值为0.176 μmol/mg、FRAP值为10.66 mmol/L。
[1] 莫顺燕, 杨永春, 石建功. 桑黄化学成分研究[J]. 中国中药杂志, 2003, 28(4): 339-341.
[2] 周存山, 马海乐. 桑黄及其药理作用研究进展[J]. 食用菌, 2005, 27(2): 50-51.
[3] IM S A, KIM K, LEE C K. Immunomodulatory activity of polysaccharide isolated from Salicornia herbacea[J]. International Immunopharmacology, 2006, 6(9): 1451-1458.
[4] YANG Tiehong, JIA Min, MENG Jia, et al. Immunomodulatory activity of polysaccharide isolated from Angelica sinensis[J]. International Journal of Biological Macromolecules, 2006, 39(4): 179-184.
[5] 马海乐, 闫景坤, 祝子坪, 等. 桑黄菌诱变菌株液体发酵试验[J]. 江苏大学学报: 自然科学版, 2012, 33(1): 6-10.
[6] 谢丽源, 张勇, 彭卫红, 等. 桑黄胞内多糖免疫及抗氧化活性研究[J].食品科学, 2011, 32(9): 276-281.
[7] 胡文彬, 马海乐, 周存山. 桑黄菌液体发酵培养基及发酵条件研究[J].中国食用菌, 2006, 25(3): 49-52.
[8] 车会莲. 桑黄提取物抑制肿瘤作用及其机制研究[D]. 哈尔滨: 哈尔滨医科大学, 2005: 42-43.
[9] 温克, 陈劲, 李红, 等. 桑黄等四种抗癌药物抗癌活性比较[J]. 吉林大学学报: 医学版, 2002, 28(3): 247-249.
[10] 郭树凡, 张慧丽, 李昱, 等. 桑黄子实体多糖提取条件的研究[J]. 食用菌学报, 2007, 13(4): 49-55.
[11] 冀颐之, 杜连祥. 深层培养裂褶菌胞外多糖的提取及结构研究田[J].微生物学通报, 2003, 30(5): 15-20.
[12] 张培敏, 朱岩, 凌艳艳. 离子色谱脉冲安培检测法测定水体颗粒物与河口沉积物中的糖[J]. 浙江大学学报: 理学版, 2004, 31(4): 431-434.
[13] ZHAO Liyan, DONG Yanhong. Extraction, purification, characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J]. Carbohydrate Polymers, 2010, 80(3): 783-789.
[14] OKADA Y, OKADA M. Scavenging effect of water soluble proteins in broad beans on free radicals and active oxygen species[J]. Journal of Agricultural and Food Chemistry, 1998, 46(2): 401-406.
[15] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060.
[16] RICE-EVANS C A, MILLER N J, PAGANGA G. Structureantioxidant activity relationships of fl avonoids and phenolic acids[J]. Free Radical Biology and Medicine, 1996, 20(7): 933-956.
[17] LEUNG P H, ZHAO Shuna, HO K P, et al. Chemical properties and antioxidant activity of exopolysaccharides from mycelial culture of Cordyceps sinensis fungus Cs-HK1[J]. Food Chemistry, 2009, 114(4): 1251-1256.
[18] 杨典洱, 林晓怡, 向本琼, 等. 脱乙酰壳多糖抑制真菌生长的构效关系[J]. 化学学报, 2005, 63(18): 1661-1665.
[19] WASSER S P. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Applied Microbiology and Biotechnology, 2002, 60(3): 258-274.
[20] 封聚强, 赵骏. 中药多糖的分子量及结构研究进展[J]. 时珍国医国药, 2008, 19(3): 624-625.
[21] CLEARY J A, KELLY G E. The effect of molecular weight and β-1,6-linkages on priming of macrophage function in mice by (l,3)-β-D-glucan[J]. Immunology & Cell Biology, 1999, 77: 395-403.
[22] GNANASAMBANDAM R, PROCTOR A. Determination of pectin degree of esterification by diffuse reflectance Fourier transform infrared spectroscopy[J]. Food Chemistry, 2000, 68(3): 327-332.
[23] 侯安继, 陈腾云, 彭施萍, 等. 茯苓多糖抗衰老作用研究[J]. 中药药理与临床, 2004, 20(3): 10-11.
[24] 冯慧琴, 杨庆尧, 杨晓彤, 等. 灰树花子实体多糖和菌丝体多糖的比较分析[J]. 华东师范大学学报: 自然科学版, 2001(3): 91-96.
Physicochemical Properties and Antioxidant Activity of Intracellular Polysaccharides from Phellinus igniarius Precipitated by Different Ethanol Concentrations
ZHOU Huiji, MA Haile*, GUO Danzhao, WANG Zhenbin
(Key Laboratory of Physical Processing of Agricultural Products in Jiangsu Province, Jiangsu University, Zhenjiang 212013, China)
In this study, the effect of ethanol concentration on the yield, purity, physicochemical properties and antioxidant activity of intracellular polysaccharides (IPs) isolated from Phellinus igniarius was analyzed. Results indicated that with an increase in ethanol concentration, the yield of crude polysaccharides increased, but polysaccharide content of the precipitated crude polysaccharides changed irregularly. Each of the IPs precipitated by different concentrations of ethanol contained xylose, mannose, galactose and glucose. Scanning electron microscopy (SEM) images showed that the IPs precipitated by low concentration (65%、75%、85%) of ethanol presented a uniform spherical shape, whereas those precipitated by high concentration (95%) of ethanol were clustered into large fl akes. IPs of Phellinus igniarius had obvious antioxidant activity in vitro in a dose-dependent manner and the IPs precipita ted by 95% ethanol had the best scavenging activity against DPPH, hydroxyl and ABTS+free radicals and the strongest ferric reducing antioxidant power.
Phellinus ign iarius; intracellular polysaccharides (IPs); physicochemical properties; antioxidant activity in vitro
TS205.9
A
1002-6630(2015)19-0034-05
10.7506/spkx1002-6630-201519006
2014-11-19
“十二五”国家科技支撑计划项目(2012BAD36B05);国家自然科学基金青年 科学基金项目(31301544);镇江市科技支撑计划工业项目(GY20130018)
周慧吉(1990-),女,硕士,研究方向为农产品加工及贮藏。E-mail:zhouhuiji0523@163.com
*通信作者:马海乐(1963-),男,教授,博士,研究方向为农产品加工及贮藏。E-mail:mhl@ujs.edu.cn
