辉光放电等离子体对水溶液中棒曲霉素的降解作用
2015-12-20蒲陆梅龙海涛张慧秀薛华丽
孙 艳,蒲陆梅,龙海涛,张慧秀,薛华丽,毕 阳,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学理学院,甘肃 兰州 730070)
辉光放电等离子体对水溶液中棒曲霉素的降解作用
孙 艳1,蒲陆梅2,*,龙海涛2,张慧秀2,薛华丽2,毕 阳1,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学理学院,甘肃 兰州 730070)
研究辉光放电等离子体在不同酸度条件下和不同催化剂存在时对水溶液中棒曲霉素的降解作用。结果表明:当直流电压为600 V,电流范围为145~155 mA时,辉光放电等离子体可在40 min内有效降解水溶液中的棒曲霉素。在pH 4.0时降解棒曲霉素效率更高,Fe2+、H2O2对降解反应具有催化作用,可提高棒曲霉素的降解速率,而纳米ZnO却减小了棒曲霉素的降解速率。
辉光放电等离子体;棒曲霉素;降解
由于人们生活水平的不断提高,人们越来越关注食品营养和安全的问题,而关于真菌毒素引发的问题层出不穷。据联合国粮食及农业组织报告,全球每年约有25%的农产品受到真菌毒素的污染,约有2%的农产品因污染严重而失去营养和经济价值,造成数百亿美元的经济损失[1]。棒曲霉素(patulin,简称Pat),又称展青霉素,是一种具有神经毒性的真菌代谢产物,具有致癌、致畸和致突变作用,会危害人及动物的健康。大量的研究表明,棒曲霉素具有基因毒性、细胞毒性、免疫毒性和生殖毒性[2],能够导致哺乳动物细胞的DNA损伤[3],染色体畸变和微核形成[4],并且会损害动物的肾脏、肝脏和肠等器官组织[5]。棒曲霉素含量已成为食品的质量指标之一。世界上很多国家都对果汁产品中棒曲霉素的最大限量做了规定,如欧盟(European Union,EU)、美国食品与药物管理局(US Food and Drug Database,USFDA)规定果汁产品中棒曲霉素的最大限量为50 μg/kg[6-7]。我国相应的标准规定苹果、山楂半成品限量标准为100 μg/kg,果汁、果酱、果酒、罐头和果脯的限量标准为50 μg/kg[8]。
目前,常用控制棒曲霉素的方法主要有物理方法和化学方法,物理方法包括活性炭吸附[9]和树脂吸附[10]等物理吸附,以及调控其制品的贮藏条件(低温贮藏和气调贮藏等),人工拣选和清洗等。然而,物理吸附随时间的延长,其吸附能力会出现一定程度的下降,而且这些脱除技术没有根本地降解棒曲霉素,而是转移到吸附剂、水、残渣和沉淀物中,这些物质的排放同样对环境造成污染。还有微波处理[11]、γ射线辐照[12]、脉冲光辐照[13-14]和紫外线辐照[15-16]等,需要控制剂量大小。化学方法主要是使用杀菌剂来防治由致病霉菌引起的腐烂,以及采用臭氧[17]、添加添加剂及巯基类物质降解棒曲霉素[18],会带来农药残留、降解不彻底等食品安全问题。
辉光放电等离子体(glow discharge plasma,GDP)处理是一种绿色环保、新兴的电化学高级氧化技术,利用外加电场作用,在水体中持续产生如H·、·OH、H2O+gas、H2O2等高活性粒子[19],可使有机物彻底降解为CO2、H2O和简单无机盐,已较多地被用于研究水体中有机污染物的降解[20-22],其特点是降解效率高、能够彻底降解,以及不使用有害化学试剂,不会造成二次污染。但降解棒曲霉素的研究尚未报道。因此,本实验拟利用GDP降解水溶液中的棒曲霉素,并研究在不同酸度、不同催化剂存在时GDP对棒曲霉素的降解效果,测定降解后棒曲霉素的含量是否小于我国规定的限量标准,以期为辉光放电等离子体脱除食品中棒曲霉素的研究与应用提供理论依据。
1 材料与方法
1.1 材料与试剂
棒曲霉素标准品 北京泰乐祺科技有限公司;乙腈(色谱纯) 山东禹王实业有限公司化工分公司;30%过氧化氢(分析纯) 上海中秦化学试剂有限公司;无水硫酸钠、稀硫酸、硫酸亚铁、氧化锌(分析纯) 天津化学试剂有限公司。
1.2 仪器与设备
DH1722-6型高压直流电源 北京大华无线电仪器厂;pHS-3C型数字酸度计 上海分析仪器厂;78HW-1恒温磁力搅拌器 杭州仪表电机厂;FL2200-2液相色谱系统(配有可变波长紫外检测器和FL2200色谱工作站)中国浙江福立分析仪器有限公司。
1.3 实验装置
实验装置包括直流电源和反应器,见图1。反应器中的阳极为将直径0.5 mm的铂丝密封于烧结石英管中,尖端外露而制得的铂电极,浸入液面。阴极为直径1.0 cm碳棒。反应温度由水浴控制。当施加电压超过临界值时,阳极产生辉光放电,且放电现象非常稳定,在阳极尖端和液面之间呈现特殊的锥形等离子体区域。
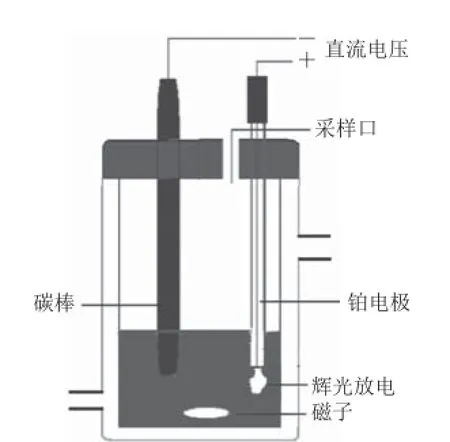
图1 实验装置示意图Fig.1 Schematic diagram of the experimental apparatus of glow discharge
1.4 方法
1.4.1 样品制备
将棒曲霉素标准品溶于乙腈溶液后,用除去溶解氧的质量浓度为1 g/L硫酸钠溶液稀释,得到标准溶液,储存于4 ℃备用。
1.4.2 棒曲霉素降解
取一定量、一定质量浓度的样品溶液加入反应器,调节酸度,加入催化剂,以直流电压为600 V、电流范围为145~155 mA的条件下产生的辉光放电等离子体处理反应液。定时从反应器中取出一定体积的反应液,供分析测定。
1.4.3 棒曲霉素含量测定方法
按照SN 0589-1996《出口饮料中棒曲霉素的检验方法》测定棒曲霉素含量,实验条件进行修订。色谱柱:Ultimate XB-C18反相柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(10∶90,V/V);检测器:紫外检测器,波长276 nm;柱温:25 ℃;流量:1.0 mL/min;进样量:20 μL;检测低限:0.01 mg/L;棒曲霉素相对保留时间:10.438 min。
2 结果与分析
2.1 GDP对水溶液中棒曲霉素的降解作用
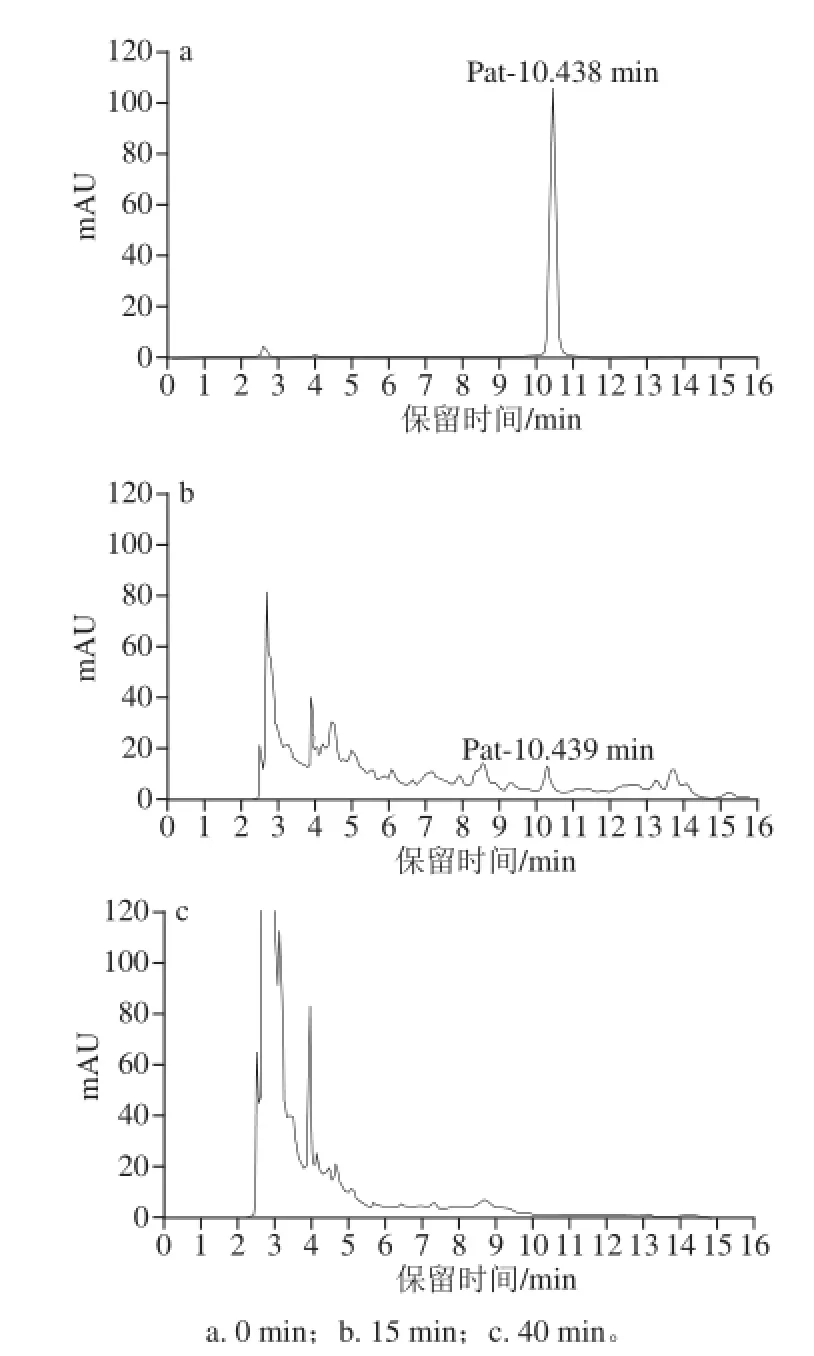
图2 降解不同时间后棒曲霉素水溶液的HPLC图Fig.2 HPLC chromatogram of patulin in aqueous solution after different degradation periods
图2为降解不同时间后棒曲霉素水溶液的高效液相色谱图(high performance liquid chromatography,HPLC)。结果表明,水溶液中棒曲霉素的含量随降解时间的延长而显著降低,当降解时间为40 min时,棒曲霉素已检测不到。棒曲霉素的初始质量浓度为12.27 mg/L,降解15 min后质量浓度减小到1.63 mg/L,其降解效率达86%。降解40 min后,未检出棒曲霉素(低于0.01 mg/L)。此外,从图2b中可看到,HPLC检测到棒曲霉素和其他物质,可以认为是辉光放电等离子体降解棒曲霉素过程中可能产生的小分子羧酸类物质。从图2c中可看到,HPLC已检测不到棒曲霉素,表明棒曲霉素已被辉光放电等离子体完全降解。
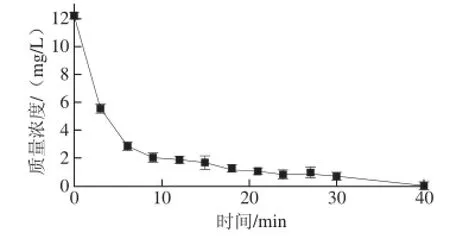
图3 棒曲霉素质量浓度随降解时间变化的动态曲线Fig.3 Dynamic degradation curve of patulin
由图3可知,降解效率随时间的变化可分两个阶段,在最初的9 min内棒曲霉素被快速降解,降解率达到了83%。这说明,在这个时间段内,辉光放电等离子体中的·OH主要与棒曲霉素发生反应。在9~30 min之间,棒曲霉素降解速率缓慢,主要是由于反应过程中产生的中间产物消耗·OH致使与棒曲霉素发生反应的·OH减少。降解40 min后检测不到棒曲霉素,表明GDP能有效、彻底地降解棒曲霉素。
2.2 酸度对棒曲霉素降解效率的影响
由于棒曲霉素在碱性溶液中不稳定并可失去其生物活性[23],所以本实验分别研究了pH值为2.0、3.0、4.0、5.0、6.0和7.0的6 种条件下辉光放电等离子体对棒曲霉素的降解作用,其降解效率见图4。
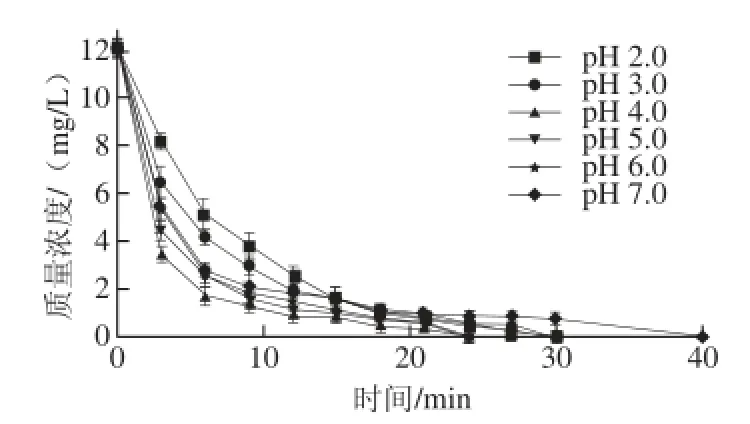
图4 酸度对棒曲霉素降解效率的影响Fig.4 Effect of acidity on the degradation effi ciency of patulin
由图4可知,在上述6 种条件下,GDP对棒曲霉素水溶液均有一定的降解作用,40 min后棒曲霉素均可被降解,经HPLC检测未检出。尤其是在pH 4.0的条件下,GDP对该棒曲霉素溶液的降解作用非常明显,降解效率最高,是因为在该酸度下,·OH的电极电势高,氧化能力强,可以增大降解效率。在pH 2.0和pH 3.0的条件下GDP对棒曲霉素水溶液降解效率变慢,是因为高酸性溶液中过量的H+结合·OH生成水,消耗产生的·OH。而20 min后降解快于中性条件,这个是因为随着时间延长,降解液的pH值逐渐上升,20 min时其pH值为4.05,增加到适宜酸度。
2.3 Fe2+、H2O2和纳米ZnO对棒曲霉素降解效率的影响
在3种棒曲霉素水溶液中,分别加入FeSO4、H2O2和纳米ZnO(粒径约为27 nm),使其质量浓度为100 mg/L,其降解效率见图5。
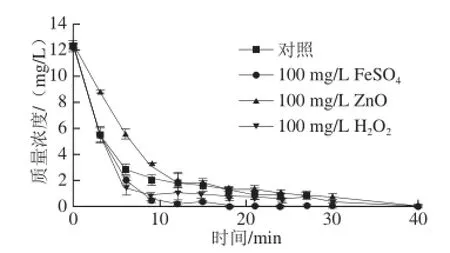
图5 催化剂对棒曲霉素降解效率的影响Fig.5 Effects of catalysts on the degradation effi ciency of patulin
由图5可知,水溶液中的棒曲霉素均可被降解,经HPLC检测未检出。在Fe2+存在的条件下棒曲霉素降解最快,Fe2+具有明显的催化作用,与有关Fe2+在辉光放电等离子体中作用的许多报道一致[24-25]。原因是Fe2+可以与放电过程中产生的H2O2发生Fenton反应,产生更多的·OH,从而提高了棒曲霉素的降解效率。
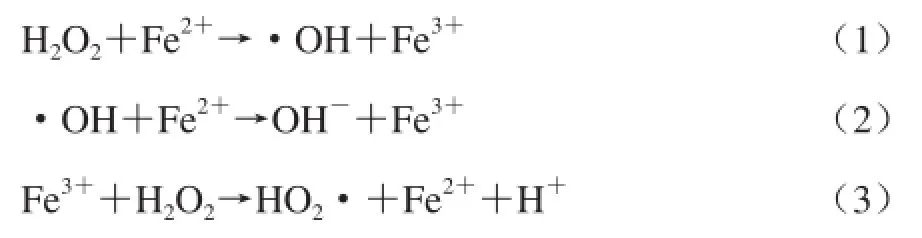
H2O2也具有催化作用,可较快地降解棒曲霉素。因为加入H2O2后,反应体系中H2O2、·OH、O2、HO2·等氧化性粒子的数目增多,使降解效率提高。而ZnO存在的条件下不利于棒曲霉素的降解,ZnO具有抑制作用。这可能是由于纳米氧化锌吸附辉光放电等离子体中的·OH而生成锌的羟基配合物,使·OH的氧化活性降低,从而起到了抑制降解的作用。
2.4 棒曲霉素降解液pH值的变化
由图6可知,棒曲霉素降解液的pH值均先迅速降低,然后上升。原因是棒曲霉素与·OH等高活性粒子反应生成了羧酸类物质,而随着反应的进行,羧酸类物质又与·OH等高活性粒子反应生成了酸性更小的CO2和H2O。
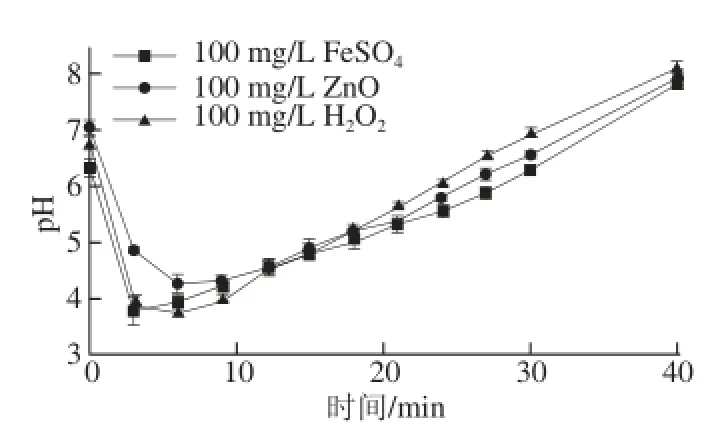
图6 棒曲霉素降解液的pH值随时间的变化Fig.6 pH change of patulin solutions at different degradation times
2.5 棒曲霉素降解动力学方程回归
研究表明,指数速率模型可在较大范围内拟合有机物的降解[26],降解速率v与基质质量浓度ρ的关系表达为:

式中:ρ为基质质量浓度/(mg/L);k为降解速率常数,是单位质量浓度的反应速率,又称为比速;n为反应级数。上式的积分形式为:

在不同条件下降解动力学方程不同,可根据棒曲霉素的质量浓度ρ和降解时间t的关系,根据式(5)拟合降解速率方程,结果见图7。
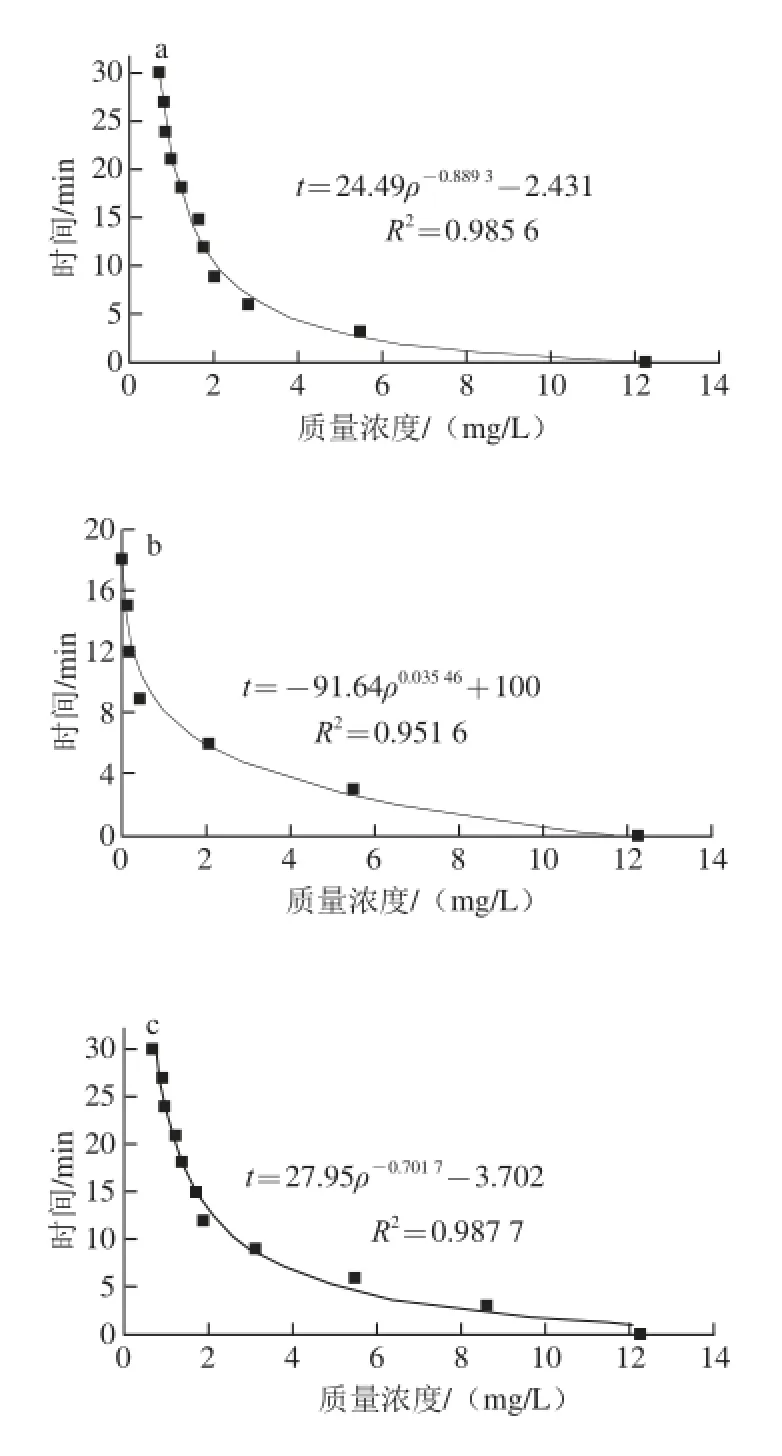
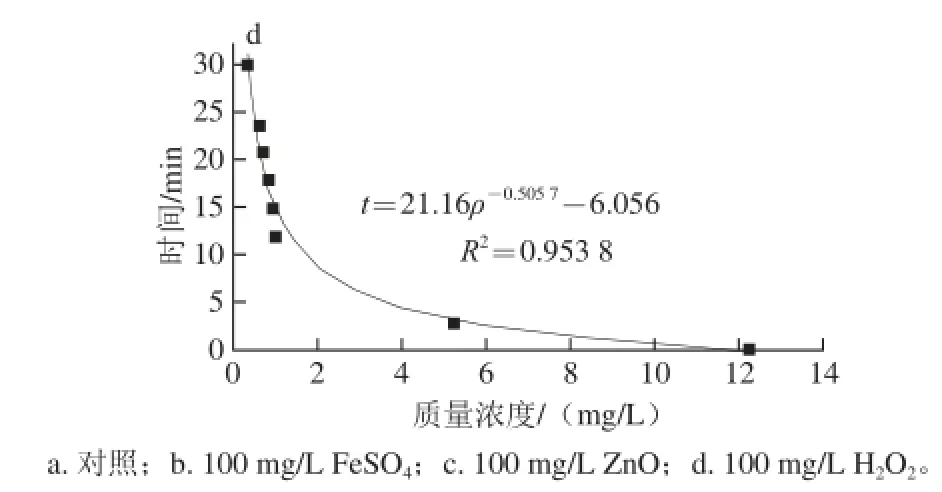
图7 棒曲霉素降解动力学拟合曲线Fig.7 Fitting curves of degradation kinetic equations for patulin
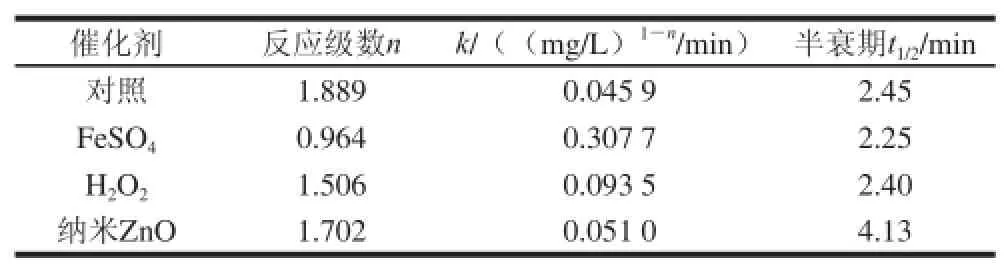
表1 棒曲霉素降解动力学方程参数Table 1 Parameters of degradation kinetic equations for patulin
根据图7中拟合曲线方程和式(5),可计算出反应级数n和降解速率常数k。当ρ=1/2ρ0,即棒曲霉素质量浓度降解一半时,所经历的时间称为半衰期t1/2,其动力学方程参数列于表1。FeSO4反应级数n接近于一级反应,其他均在一、二级之间。此外,其半衰期值与实验结果相一致。FeSO4和H2O2的t1/2比对照短,可较快地降解棒曲霉素;而纳米ZnO的半衰期最长,可抑制降解作用。
3 结 论
辉光放电等离子体可有效降解水溶液中的棒曲霉素。在pH 4.0条件下更有利于降解棒曲霉素,Fe2+、H2O2均具有催化作用,而ZnO具有抑制作用。此外,降解速率明显依赖于反应体系中·OH的浓度,·OH越多,棒曲霉素的降解速率越快。而且降解液pH值先迅速降低,然后上升的变化趋势可推断出反应过程中产生羧酸类物质,直至生成CO2和H2O。因此,本研究为棒曲霉素的降解提供了理论依据,在食品质量安全控制领域具有非常重要的意义。
[1] 王蓉珍, 赵笑天, 林勤保, 等. 真菌毒素的分析技术研究进展[J]. 中国卫生检验杂志, 2010, 20(11): 3071-3076.
[2] GLASER N, STOPPER H. Patulin: mechanism of genotoxicity[J]. Food and Chemical Toxicology, 2012, 50(5): 1796-1801.
[3] ZHOU Simin, JIANG Liping, GENG Chengyan, et al. Patulin-induced oxidative DNA damage and p53 modulation in HepG2 cells[J]. Toxicon, 2010, 55(2/3): 390-395.
[4] MELO F T, OLIVEIRA I M, GREGGIO S, et al. DNA damage in organs of mice treated acutely with patulin, a known mycotoxin[J]. Food and Chemical Toxicology, 2012, 50(10): 3548-3555.
[5] MOHAN H M, COLLINS D, MAHER S, et al. The mycotoxin patulin increases colonic epithelial permeability in vitro[J]. Food and Chemical Toxicology, 2012, 50(11): 4097-4102.
[6] GÖKMEN V, ACAR J. Rapid reversed-phase liquid chromatographic determination of patulin in apple cider[J]. Journal of Chromatography A, 1996, 730(1): 53-58.
[7] GÖKMEN V, ACAR J. Incidence of patulin in apple juice concentrates produced in Turkey[J]. Journal of Chromatography A, 1998, 815(1): 99-102.
[8] 罗雪云, 李凤琴, 刘秀梅, 等. GB 2761-2005 食品中真菌毒素限量[S].北京: 中国标准出版社, 2005.
[9] LEGGOTT N L, SHEPHARD G S, STOCKENSTROM S. The reduction of patulin in apple juice by three different types of actived carbon[J]. Food Additives & Contaminants, 2001, 18(9): 825-829.
[10] 刘华峰, 韩舜愈, 盛文军, 等. 不同树脂对苹果汁棒曲霉素的吸附[J].甘肃农业大学学报, 2010, 45(3): 126-130.
[11] 张小平, 李元瑞, 师俊玲, 等. 微波处理对苹果汁中棒曲霉素的破坏作用[J]. 农业机械学报, 2006, 37(3): 64-67.
[12] ZEGOTA H, ZEGOTA A, BACHMANN S. Effect of irradiation on the patulin content and chemical composition of apple juice concentrates[J]. European Food Research and Technology, 1988, 187(3): 235-238.
[13] MOREAU M, LESCURE G, AGOULON A, et al. Application of the pulsed light technology to mycotoxin degradation and inactivation[J]. Journal of Appllied Toxicology, 2013, 33(5): 357-363.
[14] FUNES G J, GOMEZ P L, RESNIK S L, et al. Application of pulsed light to patulin reduction in Mcllvaine buffer and apple products[J]. Food Control, 2013, 30(2): 405-410.
[15] DONG Q, MANNS D C, FENG G, et al. Reduction of patulin in apple cider by UV radiation[J]. Journal of Food Protection, 2010, 73(1): 69-74.
[16] ZHU Yan, KOUTCHMA T, WARRINER K, et al. Kinetics of patulin degradation in model solution, apple cider and apple juice by ultraviolet radiation[J]. Food and Technology International, 2013, 19(4): 291-303.
[17] 李艳玲, 惠伟, 赵政阳, 等. 臭氧对苹果汁中棒曲霉素的降解效果研究[J]. 食品工业科技, 2012, 33(10): 120-123.
[18] 杨其亚, 张红印, 庞水秀, 等. 拮抗酵母菌控制水果及其制品中展青霉素研究进展[J]. 食品科学, 2012, 33(7): 350-353.
[19] SENGUPTA S K, SINGH O P. Contact glow discharge eelectrolysis: a study of its chemical yields in aqueous inert-type electrolytes[J]. Journal of Electroanalytical Chemistry, 1994, 369(1): 113-120.
[20] GAI Ke, QI Huili, ZHANG Yuquan, et al. Degradation of indole in aqueous solution using contact glow discharge plasma[J]. Journal of Applied Electrochemistry, 2010, 40(3): 615-619.
[21] WANG Lei, LIU Yongjun. Enhancement of phenol degradation by electron acceptors in anodic contact glow discharge electrolysis[J]. Plasma Chemistry and Plasma Processing, 2012, 32(4): 715-722.
[22] HONG S M, MIN Z W, MOK C, et al. Aqueous degradation of imidacloprid and fenothiocarb using contact glow discharge electrolysis: degradation behavior and kinetics[J]. Food Science and Biotechnology, 2013, 22(6): 1773-1778.
[23] 宗元元, 李博强, 秦国政, 等. 棒曲霉素对果品质量安全的危害及其研究进展[J]. 中国农业科技导报, 2013, 15(4): 36-41.
[24] LIU Yongjun, JIANG Xuanzhen. Plasma-induced degradation of chlorobenzene in aqueous solution[J]. Plasma Chemistry and Plasma Processing, 2008, 28(1): 15-24.
[25] GAO Jinzhang, WANG Xiaoyan, HU Zhongai, et al. Plasma degradation of dyes in water with contact glow discharge electrolysis[J]. Water Research, 2003, 37(2): 267-272.
[26] 刘媚媚. 固定化石油降解菌修复石油污染的试验研究[D]. 广州: 暨南大学, 2010.
Degradation of Patulin in Aqueous Solution by Glow Discharge Plasma
SUN Yan1, PU Lumei2,*, LONG Haitao2, ZHANG Huixiu2, XUE Huali2, BI Yang1,*
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China; 2. College o f Science, Gansu Agricultural University, Lanzhou 730070, China)
The degradation of patulin in aqueous solution by glow discharge plasma was studied using different acidities and catalysts. The results showed that patulin could be rapidly and effectively degraded by glow discharge plasma at DC voltage of 600 V and in the current range of 145-155 mA. The condition of pH 4.0 was favorable to the degradation. Fe2+and hydrogen peroxide had obvious catalytic effect on the degradation, but nano-zinc oxide slowed down the degradation of patulin.
glow discharge plasma; patulin; degradation
TS201.6
A
1002-6630(2015)19-0029-05
10.7506/spkx1002-6630-201519005
2014-11-03
国家高技术研究发展计划(863计划)项目(2012AA101607);甘肃省自然科学基金项目(1308RJZA280)
孙艳(1990-),女,硕士研究生,研究方向为食品科学。E-mail:1299908717@qq.com
*通信作者:蒲陆梅(1968-),女,教授,博士,研究方向为食品科学。E-mail:pulm@gsau.edu.cn
毕阳(1962-),男,教授,博士,研究方向为果蔬采后生物学与技术。E-mail:biyang@gsau.edu.cn
