3 株葡萄酒非酿酒酵母的生长与发酵特性
2015-12-20粟春燕陈晶瑜
于 洋,粟春燕,陈晶瑜
(中国农业大学食品科学与营养工程学院,北京 100083)
3 株葡萄酒非酿酒酵母的生长与发酵特性
于 洋,粟春燕,陈晶瑜*
(中国农业大学食品科学与营养工程学院,北京 100083)
本实验对筛选自我国特色酿酒葡萄产区的东方伊萨酵母YF-12、发酵毕赤酵母YF-19和季也蒙有孢汉逊酵母YF-28这3 株非酿酒酵母的生长特性和发酵特性进行了研究。结果表明:东方伊萨酵母YF-12和发酵毕赤酵母YF-19具有较好的生长特性;在发酵环境耐受性方面,3 株非酿酒酵母对高质量浓度葡萄糖和SO2都有较好的耐受性,在酒精耐受性上季也蒙有孢汉逊酵母YF-28表现较差;对3 株非酿酒酵母进行纯种发酵实验后测定挥发性物质发现,东方伊萨酵母YF-12和季也蒙有孢汉逊酵母YF-28产生的挥发性物质较多,而发酵毕赤酵母YF-19产生挥发性物质种类很少。上述结果表明,东方伊萨酵母YF-12显示出较好的生长和发酵特性,适合做进一步产业化开发。
非酿酒酵母;生长特性;纯种发酵;挥发性物质
在葡萄酒酿造中,非酿酒酵母(non-Saccharomyces)是有别于酿酒酵母(Saccharomyces cerevisiae)的一大类酵母,主要包括克勒克酵母属(Kloeckera)、有孢汉逊酵母属(Hanseniaspora)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、德巴利酵母属(Debaryomyces)和伊萨酵母属(Issatchenkia)等[1-2]。非酿酒酵母一般在发酵前期生长旺盛,能够产生较高含量的香气物质,但随着酒精体积分数的不断升高其优势逐渐被酿酒酵母所替代[3]。早期研究认为非酿酒酵母能够产生腐败代谢产物对葡萄酒风味产生负面影响而被加以控制,但近年来研究发现,非酿酒酵母能够产生大量的甘油、酯类等代谢产物,并且能够产生一些酶将葡萄酒中的香气前体物质分解从而释放出香气物质,对葡萄酒的风味产生积极影响[4-11]。葡萄酒香气是评价葡萄酒感官质量的重要指标,目前已经鉴定出的香气成分大约有800多种,主要包括醇类、酯类、有机酸类、挥发性酚、内酯、缩醛、芳香酮、萜烯类、脂肪酸和单萜醇氧化物等,不同的香气物质混合在一起就赋予了葡萄酒复杂而独特的风味[12-13]。虽然非酿酒酵母对葡萄酒风味的影响已经引起了广泛的关注,但是其在葡萄酒酿造中的应用则尚处于起步阶段,工业发酵用菌株亟待开发。因此,研究非酿酒酵母的发酵特性并以此为依据,筛选出具有优良性状的非酿酒酵母菌株并将其应用于葡萄酒酿造中就显得非常重要。
本实验以筛选自我国特色酿酒葡萄产区的东方伊萨酵母YF-12、发酵毕赤酵母YF-19和季也蒙有孢汉逊酵母YF-28这3 株非酿酒酵母为研究对象,利用紫外分光光度法测定它们的生长曲线、高糖耐受性、酒精耐受性以及SO2耐受性;同时,采用模拟葡萄汁对3 株非酿酒酵母进行纯种发酵实验,利用顶空固相微萃取和气相色谱-质谱联用法测定发酵液中的挥发性物质。通过以上实验,对3 株非酿酒酵母的生长与发酵特性进行比较,为非酿酒酵母工业发酵菌株的筛选提供依据。
1 材料与方法
1.1 菌株、培养基与仪器
1.1.1 菌株
东方伊萨酵母(Issatchenkia orientalis)YF-12,分离自河北昌黎产区的赤霞珠葡萄;发酵毕赤酵母(Pichia fermentans)YF-19,分离自山东烟台产区的霞多丽葡萄;季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)YF-28,分离自河北沙城产区的美乐葡萄。
1.1.2 培养基
YPD液体培养基(g/L):酵母浸粉10、蛋白胨20、葡萄糖20。
YPDA固体培养基(g/L):酵母浸粉10、蛋白胨20、葡萄糖20、琼脂20。
模拟葡萄汁(model synthetic medium,MSM):可以模拟标准葡萄汁的成分,适用于研究葡萄酒酵母的酿造特性[14]。其成分(g/L)为:葡萄糖100、果糖100、酒石酸3、柠檬酸0.3、L-苹果酸0.3、KH2PO42、MgSO4·7H2O 0.2。氮源(190 mg total N/L):(NH4)2SO40.3 g,天冬酰胺0.6 g。无机盐(mg/L):MnSO4·H2O 4、ZnSO4·7H2O 4、CuSO4·5H2O 1、KI 1、CoCl2·6H2O 0.4、(NH4)6Mo7O24·4H2O 1、H3BO31。维生素(mg/L):肌醇300、生物素0.04、硫酸铵1、吡哆醇1、烟酸1、泛酸1。脂肪酸(mg/L):棕榈酸1、棕榈烯酸0.2、硬脂酸3、油酸0.5、亚油酸0.5、亚麻酸0.2。脂肪酸混合物用吐温-80及无水乙醇溶解,pH值调整为3.3。
1.1.3 仪器与设备
UV2800紫外分光光度计 上海尤尼柯仪器有限公司;Agilent7890A气相色谱和Agilent5975C质谱联用仪美国安捷伦有限公司;PDMS/CAR/DVB固相微萃取头(50/30 μm)和固相微萃取装置 美国Supelco公司。
1.2 方法
1.2.1 种子液培养
将保藏的菌株解冻后,划线培养于YPDA固体培养基上,28 ℃条件下培养24 h后重复活化一次。在YPDA固体培养基上挑取菌落特征明显的非酿酒酵母菌株接种于YPD液体培养基中,于28 ℃、150 r/min条件下培养24 h左右制成种子液。
1.2.2 生长特性实验
1.2.2.1 生长曲线测定
将各非酿酒酵母种子液以1%的接种量接种于YPD液体培养基中,28 ℃条件下培养,每隔2 h取250 μL菌液于96 孔板中,以未接种的YPD培养基作为空白对照,使用酶标仪在630 nm波长处测定菌悬液的OD值,每个样品重复测定3 次。然后根据时间和OD630 nm值绘制生长曲线。
1.2.2.2 糖耐受性测定
将各非酿酒酵母种子液以1%的接种量分别接种于葡萄糖质量浓度分别为100、150、200、250、300 g/L的YPD液体培养基中,28 ℃条件下培养34 h左右,使用酶标仪测定不同糖质量浓度下的非酿酒酵母的OD630 nm值[15]。
1.2.2.3 酒精耐受性测定
将各非酿酒酵母种子液以1%的接种量分别接种于酒精体积分数分别为3%、6%、9%、12%、15%的YPD液体培养基中,28 ℃条件下培养34 h左右,使用酶标仪测定不同酒精体积分数下的非酿酒酵母的OD630 nm值。
1.2.2.4 SO2耐受性测定
将各非酿酒酵母种子液以1%的接种量分别接种于SO2质量浓度分别为50、100、150、200、300 mg/L的YPD液体培养基中,28 ℃条件下培养34 h左右,使用酶标仪测定不同SO2质量浓度下的OD630 nm值。
1.2.3 发酵特性实验
1.2.3.1 纯种发酵实验
将各非酿酒酵母种子液以1%的接种量接种于模拟葡萄汁中,使非酿酒酵母的初始菌液浓度达到105CFU/mL,并于25 ℃、90 r/min条件下培养,每个样品设4 个重复[16]。
1.2.3.2 残糖量测定
参照GB/T 15038-2006《葡萄酒、果酒通用分析方法》中的直接滴定法[17]。
1.2.3.3 挥发性物质提取
顶空固相微萃取方法,取发酵结束的发酵液10 mL,8 000 r/min离心10 min后取上清液5 mL加入15 mL的顶空微萃取样品瓶中,同时加入1 g NaCl和磁力转子,迅速拧紧样品盖后置于恒温磁力搅拌加热平台上。将已活化的萃取头插入样品瓶的顶空部分,萃取头距离液面1 cm。40 ℃条件下吸附30 min,将吸附后的萃取头插入气相色谱进样口,于250 ℃热解析8 min[18]。
1.2.3.4 挥发性物质测定
采用Agilent 5975c/7890a测定挥发性物质,气相色谱柱为DB-5 ms(30 m×250 μm,0.5 μm);载气为高纯氦气,流速为1 mL/min。手动进样,采用不分流模式,进样口温度250 ℃,热解析8 min。柱温箱升温程序:40 ℃保持4 min,然后以3 ℃/min的速率升温到230 ℃,保持2 min。质谱接口温度为250 ℃,离子源温度:230 ℃,电离方式为EI,离子能量70 eV,质量扫描范围:20.0~500.0。
1.3 数据分析
生长特性实验的结果使用Origin Pro 8.5进行处理与分析。
挥发性物质定性定量分析:利用质谱全离子扫描图谱,依据已有标样的色谱保留时间和质谱信息、NIST05标准谱库比对结果对葡萄酒中的香气物质进行定性分析。采用气相色谱峰面积归一化法确定各香气组分的相对含量。
2 结果与分析
2.1 非酿酒酵母菌株的生长曲线
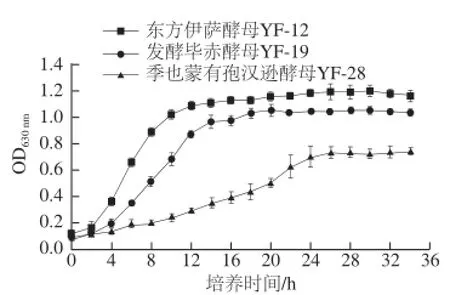
图1 非酿酒酵母菌株在YPD培养基中的生长曲线Fig.1 Growth curves of non-Saccharomyces yeast strains cultivated in YPD medium
对3 株非酿酒酵母菌株在YPD液体培养基中的生长情况进行了测定,其生长曲线如图1所示。东方伊萨酵母YF-12在YPD液体培养基中经历了大约2 h的延滞期后进入了对数生长期,在16 h左右达到稳定期;发酵毕赤酵母YF-19在YPD液体培养基中经历了不到2 h的延滞期后也进入了对数生长期,并于20 h左右达到稳定期;季也蒙有孢汉逊酵母YF-28较之前两株酵母生长有显著差异,其延滞期及对数生长期没有明显分界点,对数生长期曲线较其他两株酵母菌平滑且持续时间较长,在28 h左右达到稳定期。由此可见,东方伊萨酵母YF-12和发酵毕赤酵母YF-19在YPD培养基中的适应能力优于季也蒙有孢汉逊酵母YF-28。
2.2 非酿酒酵母菌株的耐受性
葡萄酒发酵中,非酿酒酵母的生长情况与诸多因素有关,如葡萄汁的营养状况、发酵温度、酒精体积分数和SO2添加量等,非酿酒酵母对高质量浓度葡萄糖、SO2和高体积分数酒精的耐受情况直接影响其发酵活性[19]。因此,根据3 株非酿酒酵母在YPD液体培养基的生长情况,取各非酿酒酵母到达稳定期的时间点,比较了它们对高质量浓度葡萄糖、SO2和高体积分数酒精的耐受情况,同时以在YPD液体培养基中的对应值为对照。
2.2.1 非酿酒酵母对葡萄糖的耐受性
葡萄酒工业中,糖是酒精发酵的基质,也是酵母赖以生活的能源物质。但是高质量浓度的糖会对酵母的生长产生抑制,造成葡萄糖阻遏和葡萄糖抑制作用,同时,高渗透压会导致酵母细胞水分流失,活性降低[20]。3 株非酿酒酵母对不同质量浓度葡萄糖的耐受性情况如图2所示。东方伊萨酵母YF-12的葡萄糖耐受性随着葡萄糖质量浓度的提高呈现先升高再降低的趋势,且当葡萄糖质量浓度达到150 g/L时OD630 nm值最高,之后光密度值略有降低;发酵毕赤酵母YF-19对葡萄糖的耐受性趋势与YF-12基本一致,但在葡萄糖质量浓度高于150 g/L时,光密度值降低速率较快,说明YF-19对糖耐受性较YF-12差;季也蒙有孢汉逊酵母YF-28对葡萄糖耐受性较好,光密度值基本随着葡萄糖质量浓度增加而增加,当葡萄糖质量浓度高于250 g/L时,才开始下降。一般酿酒所用葡萄汁中的糖含量大约在250 g/L左右(按葡萄糖计),本实验所用3 株非酿酒酵母在该葡萄糖质量浓度下生长所受抑制很小,因此,在葡萄酒酿造上有一定的应用潜力。

图2 非酿酒酵母菌株对葡萄糖的耐受性Fig.2 Glucose tolerance of non-Saccharomyces yeast strains
2.2.2 非酿酒酵母对酒精的耐受性
酒精发酵过程中,非酿酒酵母在发酵前期占有绝对优势,但随着发酵产的酒精越来越多,其优势被酿酒酵母所替代[21]。同时,有研究发现,接种非酿酒酵母与酿酒酵母混合发酵能够产生较高体积分数的酒精,这也为筛选出能够耐受较高酒精体积分数的非酿酒酵母提供了一定的依据[22]。由图3可知,3 株非酿酒酵母对乙醇耐受性的趋势大致相同,均是随着酒精体积分数的提高OD630 nm值降低。其中,东方伊萨酵母YF-12在酒精体积分数高于12%时,生长完全受到抑制;发酵毕赤酵母YF-19在酒精体积分数高于9%时,生长完全受到抑制;而季也蒙有孢汉逊酵母YF-28酒精耐受性最差,在酒精体积分数高于6%时,生长完全受到抑制。

图3 非酿酒酵母菌株对酒精的耐受性Fig.3 Ethanol tolerance of non-Saccharomyces yeast strains
2.2.3 非酿酒酵母对SO2的耐受性
葡萄酒生产过程中,需加入适量的SO2达到抑制有害微生物、抗氧化以及护色等作用[23]。由图4可知,3 株非酿酒酵母在SO2质量浓度小于300 mg/L的范围内,能够很好地生长,且在不同质量浓度下的生长情况变化不大。这说明3 株非酿酒酵母对SO2具有很好的耐受性。

图4 非酿酒酵母菌株对SO2的耐受性Fig. 4 SO2tolerance of non-Saccharomyces yeast strains
2.3 纯种发酵实验
2.3.1 非酿酒酵母在纯种发酵期间的生长情况

图5 非酿酒酵母菌株在纯种发酵期间的生长情况Fig.5 Growth curves of non-Saccharomyces yeast strains during single species fermentation
纯种发酵开始时,将非酿酒酵母种子液稀释到OD600 nm=1.0后接种于模拟葡萄汁中,YF-12、YF-19、YF-28的初始接种浓度分别为5.8×105、6.7×105、7.2×105CFU/mL。由图5可知,纯种发酵前2 d,各酵母菌株均大量繁殖,菌落单位数以指数形式快速增加,其中YF-12和YF-19增殖速率较快,仅在发酵第1天就已经达到稳定状态,菌液浓度接近109CFU/mL。而YF-28相对较慢,在第2天才达到稳定状态,且菌液浓度低于YF-12和 YF-19。在之后的发酵时期,3 株非酿酒酵母一直保持较稳定的菌液浓度。
2.3.2 发酵液理化指标
在纯种发酵结束后,使用离心机离去菌体,收集上清液。取上清液分别用直接滴定法和pH计测定发酵液的残糖量和pH值,并用密度瓶法测定酒精体积分数。具体实验结果见表1,3 株非酿酒酵母对糖的利用率不高,但东方伊萨酵母YF-12和发酵毕赤酵母YF-19好于季也蒙有孢汉逊酵母YF-28。

表1 酵母菌株纯种发酵条件下发酵液的理化指标Table 1 Physicochemical properties of the fermentation broths of non-Saccharommyycceess yeast strains
2.3.3 挥发性物质种类及含量
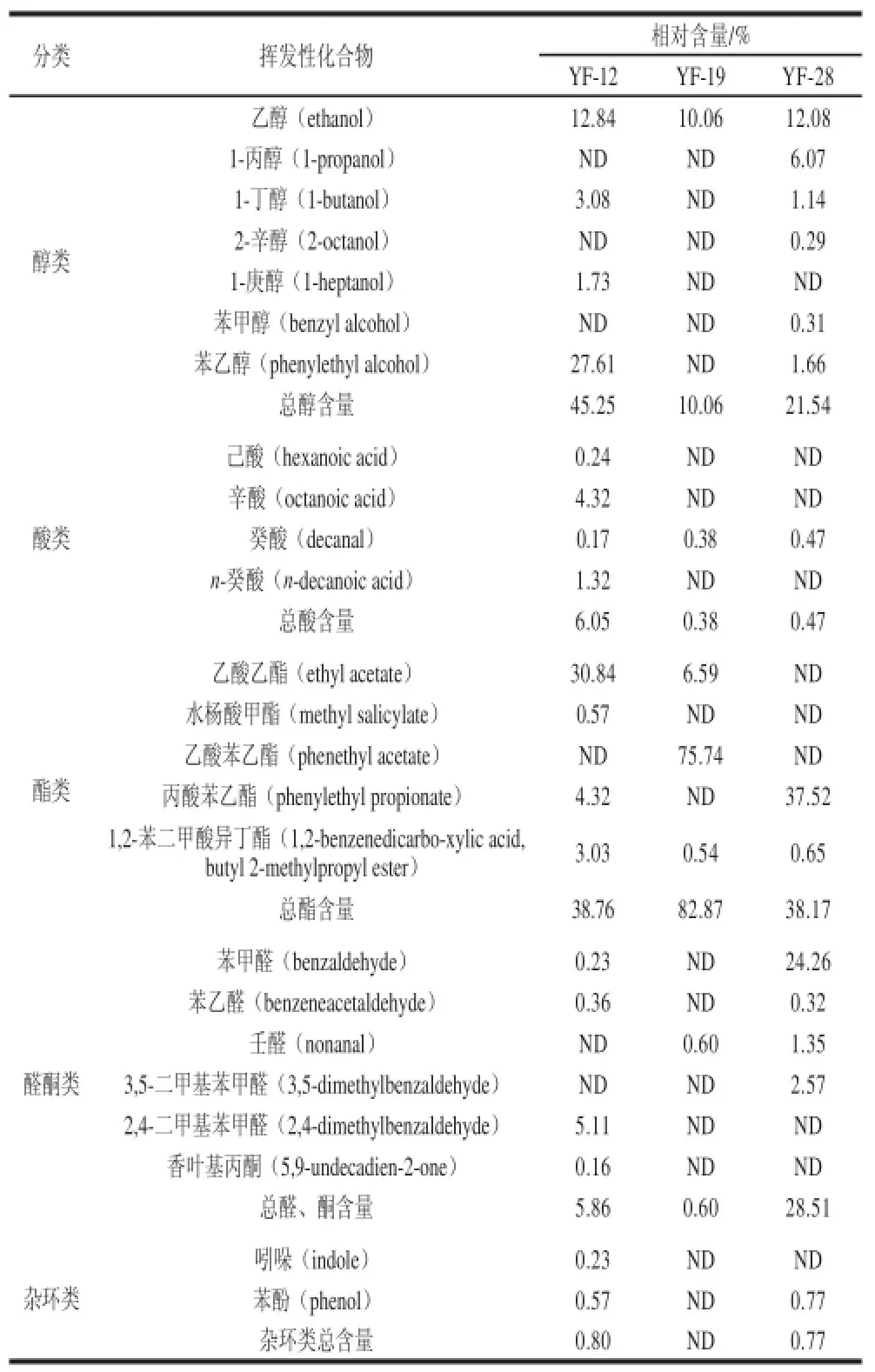
表2 非酿酒酵母菌株纯种发酵产生的挥发性化合物及其含量Table 2 Volatile compounds produced by non-Saccharommyycceess yeaasstt strains during single species fermentation
非酿酒酵母在葡萄酒发酵过程中,不仅能产生多种酶类促进香气物质的产生,其自身也能够代谢产生多种香气物质,从而达到增加葡萄酒香气复杂性的作用[24-25]。本实验使用顶空固相微萃取及气相色谱-质谱联用法测定了3 株非酿酒酵母在模拟葡萄汁中纯种发酵的挥发性物质,结果如表2所示。共有24 种挥发性物质检出,其中醇类物质7 种、酸类物质4 种、酯类物质5 种、醛酮类物质6 种、杂环类物质2 种。东方伊萨酵母YF-12共产生挥发性物质18 种,季也蒙有孢汉酵母YF-28产生15 种,发酵毕赤酵母YF-19仅产生5 种。
醇类化合物是葡萄酒发酵的主要产物,主要包括乙醇以及其他高级醇,适量的高级醇会给葡萄酒带来良好的香气。表2列出了3 株非酿酒酵母纯种发酵产生醇类物质的情况,其中发酵毕赤酵母YF-19代谢产生的醇类物质最少,只能检测到乙醇;东方伊萨酵母YF-12能够产生的醇类物质相对丰富,可以产生较多的乙醇和苯乙醇,且醇类物质含量约占其产生总挥发性物质的50%;季也蒙有孢汉逊酵母YF-28也能够代谢产生多种醇类物质,其中主要为乙醇和1-丙醇。
葡萄酒中含有多种有机酸,除酒石酸、苹果酸和柠檬酸主要来源于葡萄外,其余大部分有微生物发酵生成。如表2所示,3 株非酿酒酵母产生的酸类物质较少,其中YF-12代谢产生的酸类物质种类最多,其中辛酸占其代谢产生的总酸量的71%以上;而YF-19和YF-28对酸类的代谢较差,仅能够在发酵液中检测出较少的癸酸。
葡萄酒中的酯类物质是酵母发酵的产物,它能够赋予葡萄酒特殊的果香香气。如表2所示,非酿酒酵母能够代谢产生大量的酯类物质。其中,发酵毕赤酵母YF-19产生酯类物质的相对含量最多,其代谢乙酸苯乙酯的能力最强;YF-12则能够产生大量的乙酸乙酯,乙酸乙酯是葡萄酒中重要的风味物质,其含量的多少对葡萄酒的风味有很大影响;而季也蒙有孢汉逊酵母YF-28能够产生较多的丙酸苯乙酯。
羰基化合物和酚类物质对葡萄酒香气也有一定的贡献。表2列举了3 株非酿酒酵母纯种发酵条件下产醛酮类物质的情况,发现YF-28能够代谢产生多种醛类物质,并且苯甲醛的相对含量最多,占总醛、酮量的85%以上;而在发酵毕赤酵母YF-19的发酵液中仅能检测出少量的壬醛;YF-12能够产生相对较多的2,4-二甲基苯甲醛。
如表2所示,3 株非酿酒酵母代谢产生的杂环类化合物的量都很少,发酵毕赤酵母YF-19甚至不产生杂环类化合物;东方伊萨酵母YF-12和季也蒙有孢汉逊酵母YF-28都能产生少量的苯酚,且YF-28相对含量较多。
3 结 论
目前大多数葡萄酒酿造采用活性干酵母接种发酵,虽然可以保证葡萄酒成品的品质,但却使葡萄酒酒体单调、缺乏个性,相同或相近产区的葡萄酒风味趋于同质化。因此,利用现代技术筛选出能够酿制出独具特色葡萄酒的酵母菌株具有非常重要的现实意义[26]。本研究通过对季也蒙有孢汉逊酵母YF-28、东方伊萨酵母YF-12和发酵毕赤酵母YF-19这3 株非酿酒酵母的生长特性、对高糖、酒精及SO2的耐受能力、发酵特性进行比较分析,发现相较于发酵毕赤酵母YF-19和季也蒙有孢汉逊酵母YF-28,东方伊萨酵母YF-12在具有良好生长能力及逆境耐受能力的同时,能够产生较为丰富的挥发性物质。说明东方伊萨酵母YF-12在葡萄酒酿造生产中具有丰富产品风味、提高产品质量的优良特性,是一株颇具工业开发潜力的非酿酒酵母菌株。
[1] 张春芝, 江志国. 微生物对葡萄酒香气的影响综述[J]. 中国酿造, 2013, 32(9): 28-31.
[2] 张春晖, 李华. 葡萄酒微生物学[M]. 西安: 陕西人民出版社, 2003: 1-281.
[3] 翟明昌, 朴永哲, 王祥余, 等. 混菌发酵中不同分子量代谢产物对非酿酒酵母胞内蛋白及酒体有机酸的影响[J]. 微生物学通报, 2011, 38(9): 1443-1448.
[4] FERNANDEZ M, UBEDA J F, BRIONES A I. Typing of non-Saccharomyces yeasts with enzymatic activities of interest in winemaking[J]. International Journal of Food Microbiology, 2000, 59(1/2): 29-36.
[5] CHATONNET P, DUBOURDIEU D, BOIDRON J N. The infl uence of Brettanomyces/Dekkera sp. yeasts and lactic acid bacteria on the ethylphenol content of red wines[J]. American Journal Enology Viticulture, 1995, 46: 463-468.
[6] ROMANO P, SUZZI G, COMI G, et al. Higher alcohol and acetic acid production by apiculate wine yeasts[J]. Journal of Applied Microbiology, 1995, 73: 126-130.
[7] FERREIRA A M, CLOMACO M C, FAIA A M. The role of non-Saccharomyces species in releasing glycosidic bound fraction of grape aroma components: a preliminary study[J]. Journal of Applied Microbiology, 2001, 91: 67-71.
[8] VIANA F, GIL J V, GENOVÉS S, et al. Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J]. Food Microbiology, 2008, 25(6): 778-785.
[9] JOHNSON E A. Biotechnology of non-Saccharomyces yeasts: the ascomycetes[J]. Applied Microbiology and Biotechnology, 2013, 97: 503-517.
[10] ASSIS M O, SANTOS A P C, ROSA C A, et al. Impact of a non-Saccharomyces yeast isolated in the equatorial region in the acceptance of wine aroma[J]. Food and Nutrition Sciences, 2014, 5(9): 759-769.
[11] 徐亚男, 刘秋萍, 李琦, 等. GC-MS对非酿 酒酵母菌发酵赤霞珠葡萄酒香气成分的检测[J]. 中国酿造, 2014, 33(6): 135-139.
[12] 刘丽媛, 刘延琳, 李华. 葡萄酒香气化学研究进展[J]. 食品科学, 2011, 32(5): 310-316.
[13] 林文华,游雪燕,冯涛. 对葡萄酒酒香酵母属不良风味抑制的研究进展[J]. 中国酿造, 2013, 32(5): 5-8.
[14] 李慧, 王惠玲, 吴雅琨, 等. 天然葡萄酒酵母菌种的分离, 鉴定和酿造性能评价[J]. 食品与发酵工业, 2010, 36(11): 14-20.
[15] 易弋, 伍时华. 酒精耐受性酵母菌的筛选[J]. 广西工学院学报, 2008, 19(3): 42-46.
[16] MOREIRA N, MENDES F, de PINHO P G, et al. Heavy sulphur compounds, higher alcohols and esters production profile of Hanseniaspora uvarum and Hanseniaspora guilliermondii grown as pure and mixed cultures in grape must[J]. International Journal of Food Microbiology, 2008, 124(3): 231-238.
[17] 全国食品工业标准化技术委员会酿酒分技术委员会. GB/T 15038-2006 葡萄酒、果酒通用分析方法[S]. 北京: 中国标准出版社, 2007.
[18] 李双石, 李浡, 吴志明, 等. 不同酵母发酵对葡萄酒香气成分的影响[J].食品研究与开发, 2012, 33(11): 14-18.
[19] 娜日苏, 苏亚拉图, 高凤芹. 耐高温耐酸耐酒精酵母的筛选与鉴定[J].草叶科学, 2013, 30(10): 1625-1632.
[20] 薛军侠, 徐艳文, 杨莹, 等. 野生酿酒酵母耐受性分析[J]. 酿酒科技, 2007(6): 45-47.
[21] PINA C, SANTOS C, COUTO J A, et al. Ethanol tolerance of non-Saccharomyces wine yeasts in comparison with a strain of Saccharomyces cerevisiae-infl uence of different culture conditions[J]. Food Microbiology, 2004, 21: 439-447.
[22] ROJAS V, GIL J, PIŇAGA F, et al. Acetate ester formation in wine by mixed cultures in laboratory fermentations[J]. International Journal of Food Microbiology, 2003, 86: 181-188.
[23] 苑伟, 王学锋, 刘延琳. 优选酿酒酵母菌株发酵性能研究[J]. 中国酿造, 2010, 29(9): 48-52.
[24] VILLENA M A, IRANZO J F U, PÉREZ A I B. β-Glucosidase activity in wine yeasts: application in enology[J]. Enzyme and Microbial Technology, 2007, 40(3): 420-425.
[25] ROMANO P, FIORE C, PARAGGIO M, et al. Function of yeast species and strains in wine flavor[J]. International Journal of Food Microbiology, 2003, 86: 169-180.
[26] DOMIZIO P, ROMANI C, COMITINI F, et al. Potential spoilage non-Saccharomyces yeasts in mixed cultures with Saccharomyces cerevisiae[J]. Annals of Microbiology, 2011, 61: 137-144.
Growth and Fermentation Characteristics of Three Non-Saccharomyces Wine Yeasts
YU Yang, SU Chunyan, CHEN Jingyu*(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Non-Saccharomyces wine yeasts, widely present on grapes and winemaking equipment, have important effects on wine composition, aroma and flavor. To develop non-Saccharomyces yeasts for industrial winemaking, the growth and fermentation characteristics of three indigenous non-Saccharomyces strains, Issatchenkia orientalis YF-12, Pichia fermentans YF-19 and Hanseniaspora guilliermondii YF-28, were evaluated. The results showed that I. orientalis YF-12 and P. fermentans YF-19 grew better. All of the three strains revealed a certain tolerance to high concentrations of glucose and SO2. H. guilliermondii YF-28 had poorer tolerance to ethanol. The volatile compound analysis was performed after single species fermentation. The results showed that I. orientalis YF-12 and H. guilliermondii YF-28 produced more volatile compounds than P. fermentans YF-19. Our present study shows the potential of I. orientalis YF-12 as a promising candidate for winemaking.
non-Saccharomyces; growth characteristics; pure culture fermentation; volatile compounds
Q939.9
A
1002-6630(2015)19-0106-06
10.7506/spkx1002-6630-201519019
2014-11-03
国家自然科学基金青年科学基金项目(31101237);国家现代农业(葡萄)产业技术体系建设专项(nycytx-30-ch-03)
于洋(1987-),男,硕士研究生,研究方向为发酵工程。E-mail:yuyangcarrot@163.com
*通信作者:陈晶瑜(1978-),女,副教授,博士,研究方向为食品微生物学。E-mail:chenjy@cau.edu.cn
