鱼类加工制品蛋白质氧化程度分析
2015-12-20陆玉芹颜明月陈德慰陈良元马旦梅
陆玉芹,颜明月,陈德慰,*,陈良元,马旦梅
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.百洋水产集团股份有限公司,广西 南宁 530007)
鱼类加工制品蛋白质氧化程度分析
陆玉芹1,颜明月1,陈德慰1,*,陈良元2,马旦梅2
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.百洋水产集团股份有限公司,广西 南宁 530007)
本实验以市场上常见的几种鱼类加工制品为研究对象,测定其羰基含量、巯基含量、二硫键含量及蛋白质疏水性等指标,并进行相关性分析。结果表明:经过不同方式加工后,鱼制品蛋白中羰基、巯基、二硫键含量及疏水性都有显著差异(P<0.05)。冰鲜类产品的羰基含量较低(0~1 nmol/mg),盐渍类产品的羰基含量最高(6~10 nmol/mg);冰鲜类产品的巯基含量较高(70~100 nmol/mg),而二硫键含量最低(0.1~0.2 nmol/mg);其余样品的巯基含量均为30~70 nmol/mg,二硫键含量为1~5 nmol/mg;羰基含量与蛋白质疏水性存在极显著相关性(r=0.84,P<0.01),巯基含量与二硫键含量存在显著相关性(r=-0.59,P<0.05)。由实验结果可看出,香烤、盐制类产品蛋白质氧化程度较高,淡干类产品次之,冻鲜类产品蛋白质氧化程度较低。
蛋白质氧化;鱼制品;羰基;巯基;蛋白质疏水性
氧化是影响新鲜肉以及肉制品产品质量及保质期的一个主要原因,蛋白质氧化和脂质氧化都可导致肉的酸败和结构的改变,例如氨基酸残基的侧链氧化形成羰基衍生物(醛基和酮基)、巯醇基(RSH)氧化形成二硫键(RSSR)[1]。与脂质氧化的研究相比,关于蛋白质氧化的研究起步较晚,并且在前期的研究中主要是在集中在临床医药方向,食品体系中的蛋白质氧化及其影响的相关研究仍处于初步阶段[2]。
蛋白质氧化可导致蛋白质功能损失,失去必需氨基酸、降低消化率[3-4]。还可导致蛋白质疏水性、构象、溶解性及对蛋白质水解酶敏感性的改变[5-6]。Andersen等[7]研究了盐腌鲱鱼在成熟过程中蛋白质氧化变化,研究表明氧化程度越高,盐腌鲱鱼的贮藏品质越差。Kouti na等[8]研究发现Pama火腿腌制过程的初期蛋白质氧化反应加速。Sun Weizheng等[9]的研究发现在广式腊肠生产过程的0~80 h内蛋白质巯基发生明显的氧化反应。
本实验选取市场上普遍销售且具有代表性的几类鱼类制品,以此为研究对象,测定其蛋白质中羰基含量、巯基含量、二硫键含量及蛋白质疏水性等指标,以此评价蛋白质的氧化程度,分析不同加工工艺对鱼制品蛋白质氧化影响的程度,为从蛋白质氧化角度防止鱼制品在贮藏过程中品质下降提供参考。
1 材料与方法
1.1 材料
原料均购于百货超市,选取常见并具有代表性的香烤、盐渍、干制、冰鲜几类鱼加工品,分别为:香烤鳕鱼、鳗鱼、鱿鱼;盐渍鳗鱼、角鱼、沙丁鱼;淡干鱿鱼、黄花鱼、白帆鱼、红三鱼;冰鲜鳗鱼、鱿鱼。产品信息见表1。

表1 各产品货架期、已保存期、保藏温度及基本配方Table 1 Shelf life, preservation temperature and main ingredients of fi sh products
1.2 仪器与设备
料理机 九阳有限公司;离心机 长沙平凡仪器仪表有限公司;电子天平 诸暨市超泽衡器设备有限公司;冰箱 广东容声冰箱有限公司;均质机 上海标本模型厂;分光光度计 上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参考Koutina等[8]的方法并稍作修改。取5 g样品,打碎后加入10 倍体积的20 mmol/L的磷酸钠缓冲溶液(pH 7.0、0.1 mol/L NaCl、2 mmol/L MgCl2、1.0 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),混匀均质后经4 500 r/min低温离心15 min,取沉淀物;加入8 倍体积的上述缓冲溶液,混匀、均质、4 500 r/min低温离心15 min,取沉淀物,重复3 次,最后一次清洗后用4 层纱布过滤。所得滤液经4 500 r/min离心15 min后弃去上清液,沉淀即为肌原纤维提取物。
取一定量罗非鱼肌原纤维蛋白提取物溶于50 mmol/L pH 7.5磷酸盐缓冲液,静置30 min后取上清液,用双缩脲法测定肌原纤维蛋白含量。将肌原纤维蛋白溶液稀释至2 mg/mL及5 mg/mL待用。
1.3.2 肌动球蛋白的提取
参考Tanaka等[10]的方法。称量3 g样品,加入0.6 mol/L KCl溶液,搅拌均质后经4 500 r/min离心30 min,取上清液,加入3 倍体积已预冷的蒸馏水,离心20 min后取出沉淀,加入4 ℃,pH 7.0,1 mol/L KCl溶液20 mL,置于4 ℃条件下30 min,并不时搅拌。随后离心30 min,上清液即为肌动球蛋白溶液,保存于4 ℃条件下备用。
1.3.3 肌原纤维蛋白羰基含量测定
参考Koutina等[8]的方法并作改动。取1 mL 2 mg/mL肌原纤维蛋白溶液,加入1 mL 10 mmol/L 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),空白组加入1 mL 2 mol/L HCl。37 ℃水浴1 h(每15 min漩涡振荡一次),加1 mL 20% 三氯乙酸(trichloroacetic acid,TCA),振荡30 s,冰浴10 min,4 500 r/min离心15 min,弃去上清液,用1 mL乙醇-乙酸乙酯(1∶1,V/V)洗沉淀3 次,除去未反应的试剂,加入3 mL 6 mol/L盐酸胍溶液溶解沉淀,37 ℃水浴30 min,4 500 r/min离心15 min除去沉淀,取上清液进行检测,在370 nm波长处测定吸光度。使用摩尔吸光系数22 000 L/(mol·cm)计算羰基含量,羰基含量用每毫克蛋白质中羰基的物质的量(nmol)来表示。
1.3.4 肌原纤维蛋白巯基含量测定
根据Koutina等[8]的方法稍作改动对巯基含量进行测定。取0.1 g各样品肌原纤维蛋白沉淀物溶于10 mL 0.1 mol/L Tris缓冲溶液(pH 8.0、含质量分数5%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)),混匀,置于80 ℃水浴2 h。水浴后取出,4 500 r/min离心15 min。取0.5 mL悬浮液,加入2 mL 5% SDS/Tris缓冲溶液,混匀,在412 nm波长处测定其吸光度,记录为A1。随后加入0.5 mL 10 mmol/L 5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)(溶于上述缓冲溶液)溶液,混匀后避光反应30 min,在412 nm波长处测定吸光度,记录为A2。样品在412 nm波长处吸光度为:A=A2-A1-A空白。其中摩尔吸光系数为13 600 L/(mol·cm),所用蛋白质浓度用双缩脲法测定。巯基含量用每毫克蛋白质中巯基的物质的量(nmol)来表示。
1.3.5 肌动球蛋白二硫键含量测定
根据Benjakul等[11]的方法对样品的二硫键含量进行测定。准确称取100 mg Ellment试剂溶解到10 mL 1 mol/L的亚硫酸钠溶液中,在38 ℃条件下通入氧气直到亮红色溶液变成淡黄色NTSB溶液。取0.5 mL肌动球蛋白溶液(1 mg/mL)加入3.0 mL NTSB溶液(pH 9.5),在室温暗处放置25 min。在412 nm波长处测定吸光度。其中摩尔吸光系数为13 900 L/(mol·cm),所用蛋白质浓度利用双缩脲法测定。二硫键含量用每毫克蛋白质中二硫键的物质的量(nmol)来表示。
1.3.6 样品蛋白质疏水性测定
根据 Chelh等[12]的方法,测定各个样品肌原纤维蛋白的蛋白质疏水性。取1 mL 5 mg/mL蛋白溶液,加入0.2 mL 1 mg/mL 溴酚蓝溶液,空白组为1 mL磷酸盐缓冲溶液(pH 7.0)中加入0.2 mL 1 mg/mL溴酚蓝溶液。将实验组和空白组置于室温静止10 min,4 500 r/min离心15 min后取上清液稀释10 倍,在595 nm波长处测吸光度。表面疏水性以溴酚蓝可结合的最终暴露出埋藏在蛋白质构象内部的疏水性氨基酸残基的量(μg)来表示,用下式计算溴酚蓝结合量。

1.4 数据分析
数据的统计分析有效性全部采用Excel以及SPSS软件进行单因素方差分析(one-way analysis of variance,oneway ANOVA)(α=0.05)。结果采用±s形式表示,并用Pearson相关检验对数据进行相关性分析。
2 结果与分析
2.1 不同样品的羰基含量

图1 不同种类样品的羰基含量Fig.1 Carbonyl group contents of different samples
由图1可知,不同种鱼制品所测得的羰基含量具有显著差异,其中盐渍类产品羰基含量高于香烤类产品,淡干类产品次之,冰鲜类产品最低。
羰基的形成是蛋白质氧化的一个显著变化,蛋白质侧链上带有NH-或NH2-基团的氨基酸对自由基非常敏感,在蛋白氧化过程中,这些基团可被转化成羰基基团。活性氧会导致蛋白质肽链断裂,在断裂处可能形成羰基[13]。肌原纤维蛋白是肉的肌原纤维中主要的蛋白质,占全蛋白质含量的60%~70%,肌原纤维蛋白中羰基含量是评价肉制品蛋白质氧化程度的有力指标[14-15]。在蛋白质氧化过程中,羰基含量越大,表明鱼制品蛋白质氧化程度越大。冰鲜鳗鱼、冰鲜鱿鱼的羰基含量分别低至0.718、0.177 nmol/mg,其蛋白质氧化程度低,处于较轻氧化水平,鱼肉品质佳。肉制品盐渍及香烤(加热)过程中蛋白质羰基含量都有所升高,较高的离子强度及温度对蛋白质氧化有促进作用[16-18]。
2.2 巯基含量

图2 不同种类样品的巯基含量Fig.2 Sulfydryl group contents of different samples
由图2可知,各类产品的巯基含量值间都具有显著差异。巯基含量较低的产品主要为香烤与盐渍类产品,巯基含量在30~70 nmol/mg之间;而冰鲜类产品的巯基含量较高,在70~100 nmol/mg之间。巯基含量最小的盐渍鳗鱼比巯基含量最大的冻鲜鱿鱼含量少67.43%;同时,香烤鱿鱼的巯基含量比冻鲜鱿鱼的巯基含量少61.82%,而盐渍鳗鱼比冻鲜鳗鱼的巯基含量少55.49%,香烤鳗鱼的巯基含量比冻鲜鳗鱼少56.19%。不同鱼肉相同加工类型的样品巯基含量也有显著差异,其中香烤类产品中鳕鱼的巯基含量最高,盐渍产品中角鱼的巯基含量最高,淡干类产品中黄金花鱼的巯基含量最高。这可能是由于不同的鱼肉的肌原纤维蛋白对氧化反应的敏感程度有一定的差异,巯基氧化的难易程度不同所致[10]。
研究表明,巯基是蛋白质分子中具有较高反应活性的一个基团,蛋白质巯基上的硫外层具有很多的孤对电子,具有很强的亲核性[19]。巯基对氧化反应比较敏感,巯基的含量变化可显示出蛋白质的变性程度。本实验的结果表明,香烤与盐渍后的产品巯基含量较低。香烤、盐渍处理后,高温加热、盐分的入侵破坏了鱼肉蛋白质的静电平衡,肌原纤维蛋白的空间结构遭到破坏,蛋白质分子展开使在内部的巯基暴露出来,更易被氧化,从而导致巯基含量下降[2]。由实验结果可知,在经过香烤以及盐渍加工后,鱼肉蛋白质的巯基含量显著下降,蛋白质变性程度更高。
2.3 二硫键含量

图3 不同种类样品的二硫键含量Fig.3 Disulfi de bond contents of different samples
由图3可知,各组样品间二硫键含量具有较大差距。香烤及淡干类产品的二硫键含量最高,在1~5 nmol/mg之间;盐渍类产品次之,二硫键含量在1~3 nmol/mg之间;冰鲜类产品的二硫键含量最低,在0.1~0.2 nmol/mg之间。
二硫键一般是蛋白质多肽链的两个半胱氨酸之间的共价键,它的形成是蛋白质折叠过程中的重要步骤。对产品进行加热处理,鱼肉中的肌球蛋白分子会发生解折叠过程,分子内的游离巯基被暴露,疏水性基团增多。随着产品的加热温度升高、加热时间延长,肌球蛋白分子逐渐发生变性聚集,随后分子间和分子内形成二硫键,于是二硫键含量增加。Reed等[20]研究发现鲑鱼的肌动球蛋白在50~55 ℃时二硫键开始形成。Liu Ru等[21]研究发现鱼肉肌动球蛋白在40 ℃以上开始形成新的二硫键,而离子强度对肌动球蛋白的溶解度有较大影响,对二硫键的形成影响较小。本实验的香烤类与淡干类产品在经过加热的生产过程后,蛋白质二硫键含量较高,更易发生折叠交联;盐渍类产品的二硫键含量次之,与Liu Ru等[21]的研究结论相一致。
2.4 蛋白质疏水性
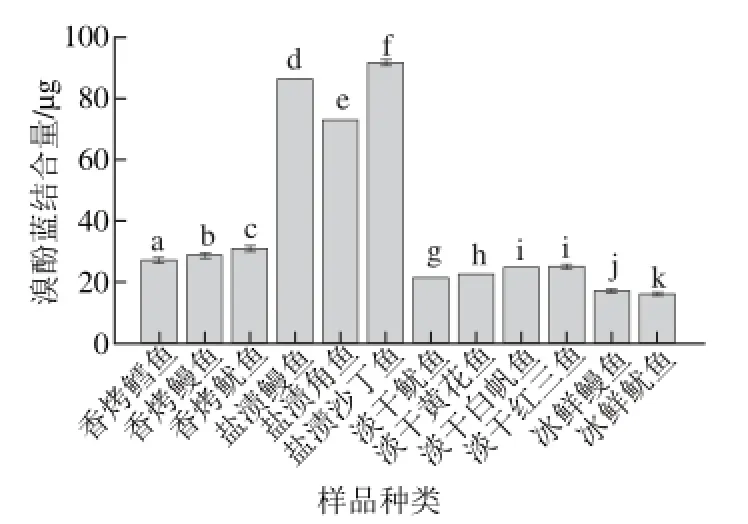
图4 不同种类样品的溴酚蓝结合量Fig.4 Bromphenol blue (BPB) binding capacity of different samples
由图4可知,各组样品间疏水性具有较大差距。盐渍类产品的疏水性最大,盐渍角鱼溴酚蓝结合量为72.82 μg,盐渍鳗鱼为86.31 μg,盐渍沙丁鱼为91.77 μg。香烤类产品溴酚蓝结合量范围为26.90~30.69 μg、淡干类产品21.38~25.05 μg、冰鲜类产品16.25~17.05 μg。
蛋白质的表面疏水性反映的是蛋白质分子表面疏水性氨基酸的相对含量,以溴酚蓝可结合的最终暴露出埋藏在蛋白质构象内部的疏水性氨基酸残基的量来表示。在许多关于氧化的研究中,蛋白质疏水性已经成为一个广泛的指标[22]。新鲜鲤鱼脊背肉的表面疏水性为10.12 μg,随着贮藏时间的延长,鲤鱼肌原纤维蛋白表面疏水性不断增大。与香烤、淡干、冰鲜处理相比,盐渍鱼制品中高浓度的离子使更多埋藏在蛋白天然构象内部的疏水性氨基酸残基暴露出来,表面疏水基团暴露得越多,肌原纤维蛋白的表面疏水性越大,结合的溴酚蓝的量就越大[23]。
2.5 相关性分析

表2 样品羰基含量、巯基含量、疏水性、二硫键含量的Pearson相关系数Table 2 Pearson s correlation coeffi cients among carbonyl, thiol and disulfi de bond contents and hydrophobicity in samples
由表2可知,蛋白质疏水性随着羰基含量增大而增大,羰基含量与蛋白质疏水性存在极显著的相关性(r=0.84,P<0.01)。Kong Baohua等[24]研究鲤鱼在冷冻解冻循环过程中蛋白质氧化以及结构变化时得出疏水性随着羰基含量增大而变大的结论;Li Yanqing等[25]对自由基氧化体系对鲤鱼肌原纤维蛋白结构的影响研究表明氧化程度越高,羰基含量越大,表面疏水性越大。这表明蛋白质氧化可改变蛋白质的功能特性,原因可能是蛋白质氧化改变了肌原纤维蛋白的结构进而改变其疏水性,最终影响到鱼制品的质量品质,氧化程度越高,鱼制品品质越差,价值降低。
样品巯基含量与二硫键含量成负相关(r=-0.59,P<0.05),半胱氨酸中的巯基对氧化反应非常敏感,能直接参与氧化还原反应。游离的巯基易被氧化,多肽内部或多肽间形成二硫键,二硫键随巯基的氧化而形成。这样可造成蛋白质分子内部或蛋白质分子间发生交联,使得肌原纤维结构更加紧密,导致肌肉组织的韧性增加、鱼制品的咀嚼性升高,同时还会使蛋白质的溶解性、消化率及营养品质下降,这些过程都不利于肉类品质。
3 结 论
通过测定经不同加工过程的鱼制品蛋白质氧化指标(蛋白质羰基含量及巯基含量等)确定其蛋白质氧化程度,结果表明不同方式加工,鱼制品的蛋白质氧化程度均有显著差异。蛋白质氧化指标中的羰基含量与蛋白质疏水性存在极显著正相关(r=0.84,P<0.01),巯基含量与二硫键含量存在显著负相关(r=-0.59,P<0.05)。盐渍类产品的羰基含量和疏水性均明显高于香烤类、淡干类、冰鲜类产品,而巯基含量较低,二硫键含量较高,说明盐渍类产品蛋白质氧化程度最高,香烤类、淡干类产品次之。而冰鲜类产品的巯基含量较高,二硫键含量明显较低,说明冰鲜类产品蛋白质氧化程度较低。盐渍类产品和淡干类产品在加工过程中经历的高盐和高温环境对蛋白质的结构破坏较大,促进了蛋白质氧化的发生,进而影响产品的品质。
[1] WINTERBOURN C C, METODIEWA D. Reactivity of biologically important thiol compounds with superoxide and hydrogen peroxide[J]. Free Radical Biology & Medicine,1999, 27(3/4): 322-328.
[2] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition & Food Research, 2011, 55(1): 83-95.
[3] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibil ity of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543.
[4] SANTÉ-LHOUTE LLIER V, ENGEL E, AUBRY L, et al. Effect of animal (lamb) diet and meat storage on myofi brillar protein oxidation and in vitro digestibility[J]. Meat Science, 2008, 79(4): 777-783.
[5] BARON C P, HYLDIG G, JACOBSEN C. Does feed composition affect oxidation of rainbow trout (Oncorhynchus mykiss) during frozen storage?[J]. Journal of A gricultural and Food Chemistry, 2009, 57(10): 4185-4194.
[6] 陈茜茜, 王俊, 黄峰, 等. 蛋白质氧化对肉类成熟的影响研究进展[J].食品科学, 2013, 34(3): 285-289.
[7] ANDERSEN E, ANDERSEN M L, BARON C P. Characteri zation of oxidative changes in salted herring (Clupea harengus) during ripening[J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9545-9553.
[8] KOUTINA G, JONGBERG S, SKIBSTED L H. Prot ein and lipid oxidation in Parma ham during production[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9737-9745.
[9] SUN Weizheng, CUI Chun, ZHAO Mouming, et al. Effects of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry, 2011, 124(1): 336-341.
[10] TANAKA M, THONGKAEW C, VISESSANGUAN W, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish durin g frozen storage[J]. Food Research International, 2003, 36(8): 787-795.
[11] BENJAKUL S, SEYMOUR T A, MO RRISSEY M T, et al. Physicochemical changes in pacific whiting muscle proteins during iced storage[J]. Journal of Food Science, 1997, 62(4): 729-733.
[12] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681- 683.
[13] ESTÉVEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279.
[14] ETEMADIAN Y, SHABANPOUR B. Changes in physicochemical properties and shelf life ability of kutum (Rutilus frisii Kutum) slices during packaging and storage in ice[J]. Journal of Food Processing and Preservation, 2014, 38(1): 159-168.
[15] EYMARD S, BARON C P, JACOBSEN C. Oxidation of lip id and protein in horse mackerel (Trachurus trachurus) mince and washed minces during processing and storage[J]. Food Chemistry, 2009, 114(1): 57-65.
[16] VENTANAS S, VENT ANAS J, TOVAR J, et al. Extensive feeding versus oleic acid and tocopherol enriched mixed diets for th e production of Iberian dry-cured hams: effect on chemical composition, oxidative status and sensory traits[J]. Meat Science, 2007, 77(2): 246-256.
[17] WANG Zhengyu, XU Yansheng, ZHANG Jihong, et al. Proteolysis, protein oxidation and pr otease activity in dry-cured Xuanwei ham during the salting stages[J]. International Journal of Food Science & Technology, 2011, 46(7): 1370-1377.
[18] 戴妍. 欧姆加热对猪肉蛋白质降解、氧化以及凝胶特性的影响[D].北京: 中国农业大学, 2014.
[19] 黄楚森, 朱维平, 徐玉芳, 等. 蛋白质巯基及其氧化性修饰的化学检测方法[J]. 药学学报, 2012, 47(3): 280-290.
[20] REED Z H, PARK J W. Rheological and biochemical bharacterization of salmon myosin as affected by constant heating rate[J]. Journal of Food Science, 2011, 76(2): 343-349.
[21] LIU Ru, ZHAO Simi ng, YANG Hong, et al. Comparative study on the stability of fi sh actomyosin and pork actomyosin[J]. Meat Science, 2011, 88(2): 234-240.
[22] 李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13): 70-74.
[23] 何雪莹. 冰温保鲜对鲤鱼鱼肉品质特性及其理化特性影响的研究[D].哈尔滨: 东北农业大学, 2012.
[24] KONG Baohua, GUO Yuanyuan, XIA Xiufang, et al. Cryoprotectants reduce protein oxidation and structure deterioration induced by freezethaw cycles in common carp (Cyprinus carpio) surimi[J]. Food Biophysics, 2013, 8(2): 104-111.
[25] LI Yanqing, KONG Baohua, XIA Xiufang, et al. Structural changes of the myofibrillar proteins in common carp (Cyprinus carpio) muscle exposed to a hydroxyl radical-generating system[J]. Process Biochemistry, 2013, 48(5/6): 863-870.
Protein Oxidation of Processed Fish Products
LU Yuqin1, YAN Mingyue1, CHEN Dewei1,*, CHEN Liangyuan2, MA Danmei2
(1. Institute of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China; 2. Baiyang Aquatic Group, Nanning 530007, China)
Common processed fi sh products in the market were investigated in this study to determine and correlate the con tents of carbonyl gro up, thiol group and disulfi de bond, as well as protein hydrophobicity. The results showed that different processed fi sh products exhibited signifi cant differences in the contents of carbonyl group, thiol group and disulfi de bond, as well as protein hydrophobicity (P < 0.05). The carbonyl content of cold fresh products was low (0-1 nmol/mg), while the carbonyl content of salted products was the highest (6-10 nmol/mg). The thiol group content of frozen fresh products was higher (70-100 nmol/mg), and the disulfide bond content was the lowest (0.1-0.2 nmol/mg). In other process ed fish products, the thiol group content was 30-70 nmol/mg, and the disulfi de bond content was 1-5 nmol/mg. Correlation analysis revealed that there was a signifi cant correlation between carbonyl content and protein hydrophobicity (r = 0.84, P < 0.01). A signifi cant relationship existed between thiol group content and disulfi de bond content (r = -0.59, P < 0.05). Our experimental results showed that the degree of protein oxidation was higher in roasted and salted products than dried products; the lowest degree of protein oxidation was found in frozen fresh products.
protein oxidation; fi sh products; carbonyl group; thiol group; protein hydrophobicity
TS254.4
A
1002-6630(2015)19-0055-05
10.7506/spkx1002-6630-201519010
2014-12-03
2012年度国家星火计划项目(2012GA790003);南宁市科技攻关项目(20142306);
广西高校“广西特色农产品精深加工及安全控制”重点实验室项目
陆玉芹(1990-),女,硕士研究生,研究方向为水产品加工与贮藏。E-mail:luyuqin5@163.com
*通信作者:陈德慰(1975-),男,教授,博士,研究方向为水产品加工与保鲜。E-mail:chendw@gxu.edu.cn
