QuEChERS—UPLC—MS/MS法同时测定羊奶中8种β-内酰胺类抗生素
2015-12-20王帅帅郑小平孟瑾何亚斌
王帅帅郑小平孟 瑾何亚斌
(1.上海海洋大学食品学院,上海 201306;2.上海必诺检测技术服务有限公司,上海 200436)
羊奶营养丰富、易于吸收,其蛋白质和脂肪含量均高于牛奶,被国际营养学界称为“奶中之王”[1]。在中国奶类产量中,山羊奶是第二大奶类,中国已成为饲养奶山羊最多的国家[2]。β-内酰胺类抗生素可以治疗奶羊乳腺炎、心包炎等疾病,在奶羊养殖过程中,由于缺乏科学用药的知识,或受经济利益的驱使,不合理用药现象仍很严重[3]。长期食用含有β-内酰胺类抗生素的羊乳会引起疾病,如过敏反应、致畸反应以及增加细菌的耐药性[4]。
目前,国内外关于羊奶中β-内酰胺类抗生素的检测报道较少[5],牛奶中β-内酰胺类抗生素的测定多采用传统的固相萃取法(SPE)净化样品[6-9],与传统的固相萃取净化法相比,QuEChERS净化法具有样品前处理时间短、节省溶剂、降低检测成本等优点。本研究拟在参考牛奶中β-内酰胺类抗生素检测 方 法[10-13]的 基 础 上,用 改进 的 QuEChERS 净 化法[14],结合超高效液相色谱串联质谱法(UPLC—MS/MS)测定羊奶中8种β-内酰胺类抗生素。试验以乙腈为提取试剂,C18和PSA吸附剂净化处理,具体考察提取试剂、吸附剂类别和用量等条件对回收率的影响。以期为羊奶中β-内酰胺类抗生素的检测提供一种快速、可靠的检测方法,同时对相关标准的制定亦具有指导意义。羊奶中蛋白质和脂肪的含量与牛奶中相差不大,本方法也适用于牛奶中β-内酰胺类抗生素的测定。
1 材料与方法
1.1 仪器与试剂
超高效液相色谱—串联质谱仪:Waters XEVO TQ型,ESI源,美国沃特世公司;
高速冷冻离心机:Heraeus Multifuge X1R型,美国热电公司;
氮吹仪:ANPEL DC12型,上海安谱科学仪器有限公司;
超声波仪:TH型,上海安谱科学仪器有限公司。
乙腈:色谱纯,德国Merck公司;
甲酸:分析纯,美国Sigma公司;
C18粉、PSA吸附剂:天津博纳艾杰尔科技有限公司;
标准品:阿莫西林、头孢喹肟、头孢氨苄、氨苄西林、头孢噻呋、青霉素G、苯唑西林、氯唑西林,纯度>98.5%,德国Dr.Ehrenstorfer公司;
羊奶:市售。
1.2 标准溶液配制
(1)标准储备溶液:分别准确称取8种标准品各10mg,用50%乙腈水溶液溶解并定容至10mL,即得1.0mg/mL的标准储备液,低温储存备用。
(2)混合标准储备液:吸取8种标准储备液各100μL,用50%乙腈水溶液溶解并定容至10mL,即得10μg/mL的混合标准储备液。
(3)标准工作溶液:用50%乙腈水溶液逐级稀释混合标准储备液。
1.3 样品前处理
1.3.1 提取 称取5.00g羊奶于50mL离心管中,加入乙腈10mL,涡旋振荡1min,超声提取10min,8 000r/min离心5min,上清液待净化。
1.3.2 净化 取1.3.1中上清液8mL转移至15mL离心管中(管中预先加入150mg C18和150mg PSA),涡旋混匀1 min,5 000r/min离心3min,取6mL上清液氮气吹干,残渣用1mL 10%乙腈水溶液复溶,过0.22μm有机相滤膜,上机分析。
1.4 分析条件
1.4.1 液相色谱条件 色谱柱:Waters ACQUITY UPLCTM C18(2.1mm×50mm,1.7μm);流动相:A为0.1%甲酸水溶液,B为乙腈;柱温30℃;流动相梯度洗脱程序:0~1min,95%A,1~4min,95%~50%A,4~6min,50%A,6~7min,50%~95%A,7~8min,95%A,进样量:5 μL,流速:0.3mL/min。
1.4.2 质谱条件 离子源:电喷雾离子源;扫描方式:正离子扫描;毛细管电压:1.60kV;离子源温度:150℃;去溶剂温度:500℃;去溶剂气流:氮气,800L/h;碰撞气:氩气;多反映监测模式(MRM)采集。8种β-内酰胺类抗生素的保留时间、母离子、子离子以及对应的碰撞能量见表1。
2 结果与讨论
2.1 流动相的选择
测定牛奶中β-内酰胺类抗生素时通常使用甲醇/0.1%甲酸水溶液或乙腈/0.1%甲酸水溶液作流动相,本试验比较了这两种流动相对8种β-内酰胺类抗生素色谱行为的影响。结果表明,以甲醇/0.1%甲酸水溶液为流动相时,5种青霉素类化合物响应值较低,峰形较差,以乙腈/0.1%甲酸—水溶液为流动相时,8种目标化合物分离完全,且峰形较好,故选用乙腈/0.1%甲酸水溶液为流动相,8种β-内酰胺类抗生素的总离子流图见图1。

表1 8种β-内酰胺类抗生素质谱条件Table 1 MS parameters of 8β-lactams
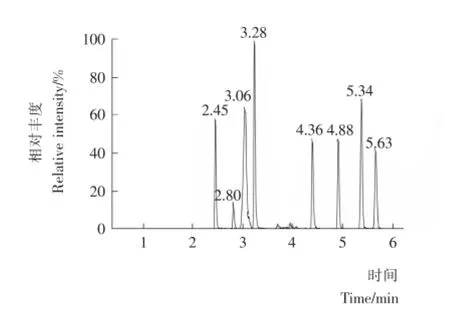
图1 8种β-内酰胺类抗生素总离子流图Figure 1 Total ion chromatogram (TIC)of 8β-lactams
2.2 样品处理条件的选择与优化
2.2.1 提取试剂的选择 试验比较了甲醇、乙腈、1%甲酸乙腈3种提取试剂对待测组分回收率的影响,结果见图2。由图2可知,乙腈去蛋白的能力较强,提取效果最好,甲醇中的羟基会加速青霉素的分解,酸性条件下,头孢类抗生素的提取效果比青霉素类抗生素好,综合考虑,选择乙腈作为提取试剂。
2.2.2 吸附剂对净化效果的影响 试验比较了C18、PSA和C18+PSA(1+1)3种净化方式对回收率的影响,结果见图3。由图3可知,C18+PSA(1+1)混合使用比单独使用净化效果好,这是由于C18主要吸附样品中的脂肪和蛋白,PSA主要吸附样品中的脂肪酸和糖类杂质,单独使用C18或PSA时,样品中脂肪和蛋白吸附不完全,存在较大的基质效应,综合考虑,选择C18+PSA净化方式净化样品。
2.2.3 C18+PSA(1+1)吸附剂用量对净化效果的影响 试验优化了C18+PSA(1+1)吸附方式的不同用量对8种β-内酰胺类抗生素的净化效果,结果见图4。由图4可知,当C18+PSA吸附剂为300mg时,各组分的回收率最高。吸附剂用量为100mg时,样品中蛋白和脂肪吸附不完全,吸附剂用量为500mg时,吸附剂会吸附样品中目标化合物,导致回收率降低,综合考虑,选择吸附剂用量为300mg。
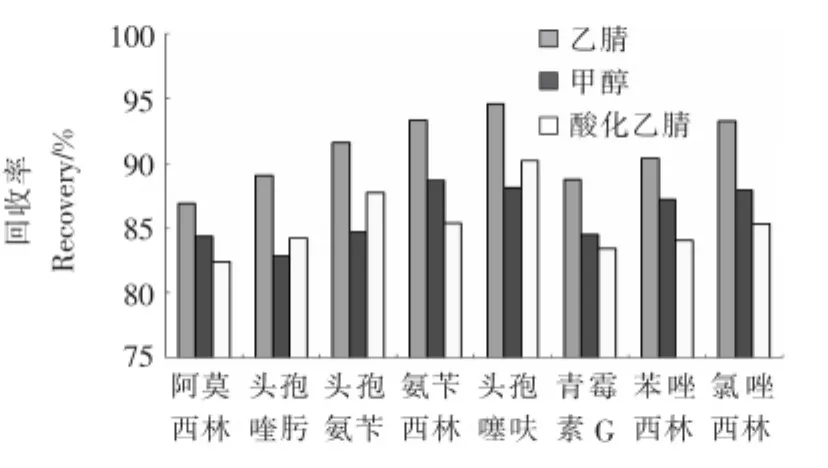
图2 提取试剂对提取效果的影响Figure 2 Effect of extraction reagent on extraction efficiency
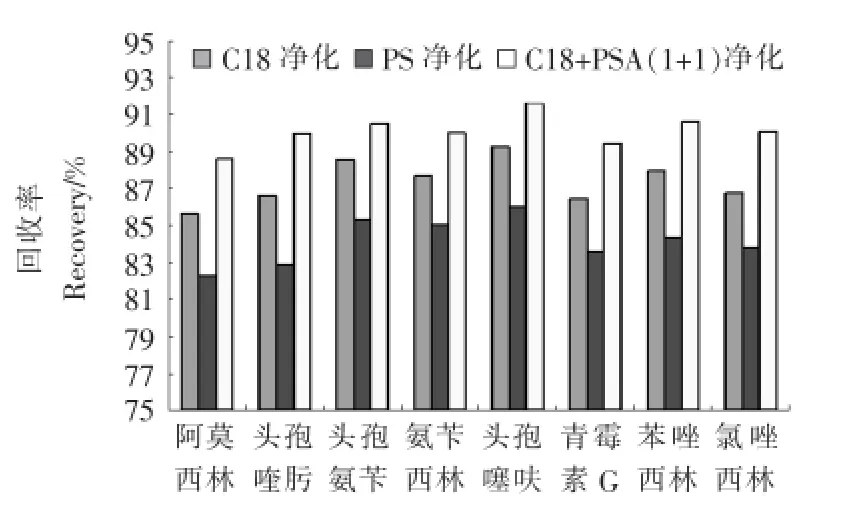
图3 吸附剂对净化效果的影响Figure 3 Effect of different sorbents on extraction efficiency
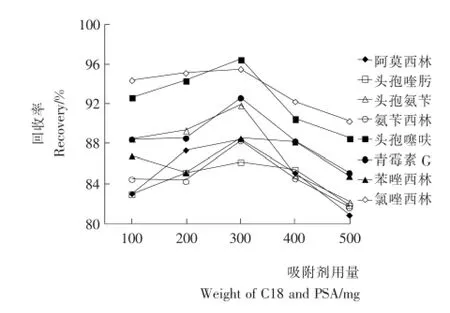
图4 C18+PSA用量对净化效果的影响Figure 4 Effect of weight of C18and PSA on extraction efficiency
2.3 线性范围和方法检出限
用空白样品提取液配制系列标准曲线,标准曲线浓度分别为1.0,5.0,10.0,25.0,50.0μg/kg。按1.3的方法处理测定,测定后以各组分的峰面积(Y)为纵坐标,质量浓度(X,μg/kg)为横坐标,绘制标准曲线,以信噪比S/N≥3确定方法的检出限(LOD),以信噪比S/N≥10确定方法的定量限(LOQ),8种β-内酰胺类抗生素的方法检出限为0.25~1.00μg/kg,定量限为1.0~2.0μg/kg。在1.0~50.0μg/kg浓度范围内,8种目标化合物的线性方程、相关系数、方法检出限和定量限见表2。
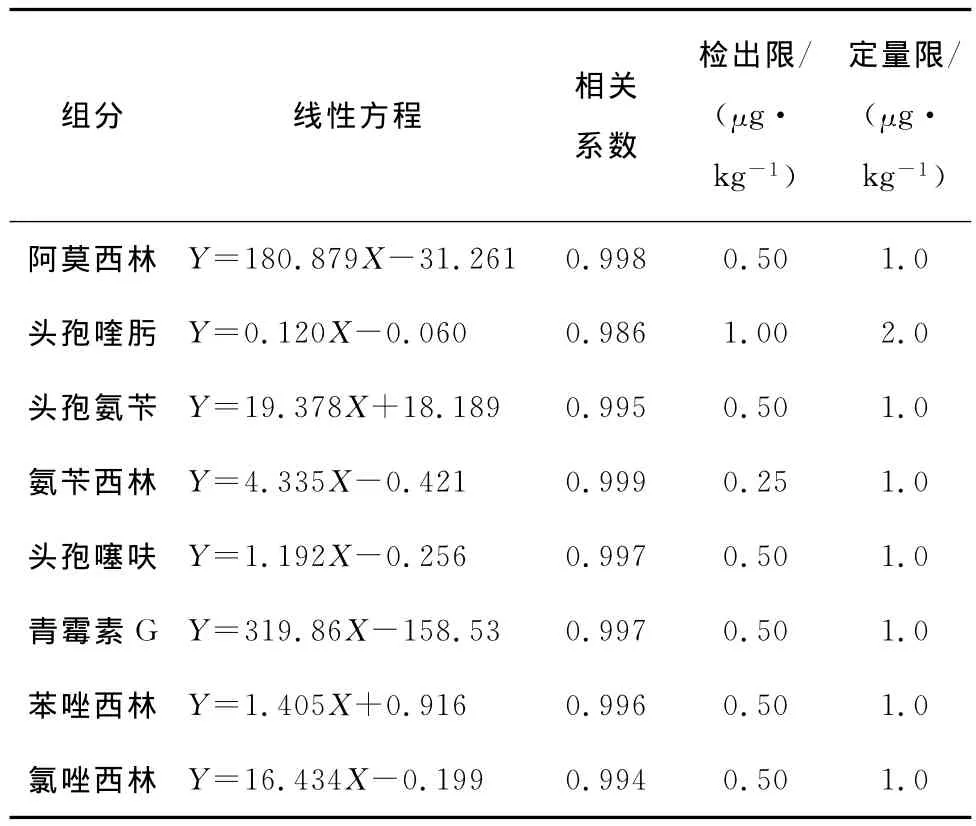
表2 各化合物的线性方程及方法检出限Table 2 Linear equations and correlation coefficients
2.4 方法回收率和精密度
用同一空白羊奶样品做加标回收试验,8种β-内酰胺类抗生素的添加水平分别设定为5.0,10.0,25.0μg/kg。按照1.3的方法进行测定,每个添加水平做6个平行样,结果见表3。

表3 8种β-内酰胺类抗生素的回收率和精密度Table 3 Recoveries and relative standard deviations(RSD)of 8β-lactams in spiked milk samples(n=6)
2.5 实际样品的测定
应用本方法对15份市售的羊奶进行检测,按1.3中样品处理方法操作,各样品中均未检测到8种β-内酰胺类抗生素的残留,说明测定的15份羊奶质量较好。
3 结语
本试验建立了QuEChERS净化法结合超高效液相色谱串联质谱法测定羊奶中8种β-内酰胺类抗生素的方法,该方法使用吸附剂直接净化样品,与传统固相萃取净化相比,该方法样品前处理简单快速、提高了检测效率,同时也具有较好的回收率和较低的检出限,方法实用性较强,为羊奶及其他奶制品中β-内酰胺类抗生素的残留检测提供了可靠的方法,对相关标准的制定也具有指导性意义。
1 王逸斌,徐莎,侯艳梅,等.山羊奶的营养成分研究进展[J].中国食物与营养,2012,18(10):67~71.
2 任洪辉,张鹏,王永.我国奶羊产业发展的前景问题和对策[J].江苏农业科学,2013,41(11):230~232.
3 赵善仓,李增梅,董燕婕,等.我国奶羊产业发展与羊乳质量安全现状及对策研究[J].农产品质量与安全刊,2014(6):12~14.
4 Kantiani Lina,FarréMarinella,BarcelóDamiá,et al.Analytical methodologies for the detection ofβ-lactam antibiotics in milk and feed samples[J].Journal of TrAC Trends in Analytical Chemistry,2009,28(6):729~744.
5 Camara M,Gallego A,Garcinuno R M,et al.An HPLC—DAD method for the simultaneous determination of nineβ-lactam antibiotics in ewe milk[J].Journal of Food Chemistry,2013(141):829~834.
6 Kukusamude Chunyapuk,Burakham Rodjana,Chailapakul Orawon,et al.High performance liquid chromato-graphy for the simultaneous analysis of penicillin residues in beef and milk using ion-paired extraction and binary water-acetonitrile mixture [J].Talanta,2012,92:38~44.
7 Li Na-si,Feng Feng,Yang Bing-cheng,et al.Simultaneous determination of beta-lactam antibiotics and beta-lactamase inhibitors in bovine milk by ultra performance liquid chromatographytandem mass spectrometry [J].Journal of Chromatography B,2014,110(4):945~946.
8 刘洪斌,文一,刘勇军,等.LC—MS/MS法检测牛奶中14种β-内酰胺类抗生素残留[J].分析实验室,2014,33(2):221~224.
9 张秀尧,蔡欣欣.超高效液相色谱5三重四极杆质谱法快速同时测定牛奶中53种β-内酰胺类抗生素及其代谢产物的残留[J].色谱,2014,32(7):693~701.
10 陈瑞春,贾海涛,艾连中,等.高效液相色谱—串联质谱法测定牛奶和奶粉中9种青霉素类药物残留量[J].食品科学,2011,32(18):249~252.
11 黄百芬,吴丹青,蔡增轩,等.超高效液相色谱—串联质谱法同时测定牛奶中19种β-内酰胺类抗生素[J].中国卫生检验杂志,2010,20(1):1~6.
12 Shiu-Hsieh Huan,His-Ya Huang,Szetsen Lee.Determination of eight penicillin antibiotics in pharmaceuticals,milk and porcine tissues by nano-liquid chromatography[J].Journal of Chromatography A,2009,1 216(43):7 186~7 194.
13 李欣楠,韩镌竹,苏葳艺.超高效液相色谱—串联质谱法同时测定生鲜乳中7类β-内酰胺类抗生素残留[J].现代畜牧兽医,2013(11):40~45.
14 R Perez-Burgos,E M Grzelak,J Saurina,et al.Quechers methodologies as an alternative to solid phase extraction(SPE)for the determination and characterization of residues of cephalosporins in beef muscle using LC—MS/MS[J].Journal of Chromatography B,2012(899):57~65.
