苦苦菜发酵过程中主要发酵菌种及滋味物质的变化
2015-12-20罗瑞明王万银
张 婷 杨 波 罗瑞明 王万银
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021;3.平罗县农副产品流通服务中心,宁夏 石嘴山 753400)
苦苦菜,属菊科菊苣族,又名苦苣菜、苣荬菜等,在中药中称之为败酱草,是一种药食兼具的无毒野生植物,属一年生或两年生草本植物。苦苦菜具有明目和胃、破瘀活血、消炎利尿、益气养阳、排脓去淤消肿的功效,对预防心脏病、恢复脑细胞功能和预防癌症均具有一定疗效。
对食品发酵后微生物菌群和风味物质变化的研究有助于实现该发酵食品的工业化生产,如对糟鱼[1]、香肠[2]、冬瓜[3]等发酵后的研究,但尚未发现有对发酵苦苦菜及其发酵菌种和滋味物质的研究。本试验着重研究苦苦菜自然发酵过程中,主要菌群和典型发酵菌株的变化,并对其发酵过程中的总酸、pH值和腌制液盐浓度进行了动态检测。此外,评价山野菜腌制后的风味主要从质地、颜色、香气、滋味等方面。氨基酸是一种高含量呈味物质,其含量与类型是影响风味很重要的因素[4],不同的氨基酸呈现的味道不同[5]。本试验测定了苦苦菜发酵过程中游离氨基酸含量的变化,按其呈味分类,检测各类呈味氨基酸含量随发酵时间的变化,分析其变化规律,为苦苦菜的开发利用和产业发展提供依据。
1 材料与方法
1.1 试验材料
苦苦菜、食盐、辣椒、生姜、茴香、花椒等:市售;
MRS琼脂培养基:在MRS液体培养基中加入1.5%~2.0%的琼脂,121℃灭菌20min;
MRS分离培养基:在MRS培养基的基础上加入2~5g无水碳酸钙,121℃灭菌20min,用于乳酸菌的分离与鉴定。
1.2 主要仪器与试剂
氨基酸自动分析仪:L-8900型,上海仁特检测仪器有限公司;
手动控制压力蒸汽灭菌器:GMSX-280,北京市永光明医疗仪器有限公司;
精密pH计:PHS-3C型,上海精密科学仪器有限公司;
生化培养箱:LRH系列,上海一恒科技有限公司;
恒温干燥箱:101-3型,上海东星建材试验设备有限公司;
葡萄糖、牛肉膏、琼脂粉、胰蛋白胨、酵母浸粉:生化试剂,国药集团化学试剂有限公司;
乙醇:分析纯,浙江双林有限公司;
氢氧化钠:分析纯,天津化学试剂三厂;
硝酸银:分析纯,国药集团化学试剂有限公司。
1.3 试验方法
1.3.1 腌制工艺流程

食盐放入量5%,菜放入量70%,香辛料(辣椒∶生姜∶茴香=6∶3∶1)放入量4%(均为占菜水总重百分比),花椒水中花椒放入量为所用水3‰~4‰。
1.3.2 发酵过程指标检测
(1)菌落总数计数:采用平板培养计数法。
(2)酵母菌、霉菌菌落总数:采用平板培养计数法。
(3)乳酸菌总数:采用液体培养法和平板培养计数法。
(4)pH值的测定:采用pH计测定。
(5)总酸含量(以乳酸计)测定:采用直接滴定法,按GB/T 12456—90执行。
(6)腌制液盐浓度的测定:硝酸银溶液滴定法[6]。
(7)感官评价:请10位有经验的评定人员对苦苣菜腌制期间的色泽、外观组织、香气、质地、滋味、口感等计分(满分100分),取平均值。评比计分标准见表1。
1.3.3 游离氨基酸样品前处理 参照文献[5]。
1.3.4 乳酸菌的分离及纯化 分别取0,3,7,14,21,28d的苦苦菜自然发酵菜汁,按10倍稀释到合适梯度,涂布于用MRS分离培养基平板,在生化培养箱中于30℃培养48h,挑取长势好且有明显较大钙溶圈的菌落,在MRS琼脂培养基平板上反复划线分离至纯菌落,然后进行革兰氏染色和接触酶反应,挑选出革兰氏阳性、接触酶阴性的菌株[7],转移至MRS斜面培养基上,编号并于4℃保存,待鉴定用。

表1 感官评分标准Table 1 Standard of sensory evaluation
1.3.5 乳酸菌菌体的鉴定 乳酸菌按常规接种方法培养,挑取典型菌落革兰氏染色,油镜下观察。生理生化鉴定具体包括[8,9]:① 过氧化氢酶试验;② 吲哚试验;③ 明胶液化试验;④ 硫化氢产生试验;⑤ 糖发酵产酸试验;⑥ 运动性检查。
1.4 数据处理
试验结果数据统计分析采用软件SPSS 19.0和Excel 2007。
2 结果与分析
2.1 微生物学指标测定结果
2.1.1 主要微生物菌落总数的变化 由图1可知,苦苦菜发酵液中细菌总数随发酵天数的增加呈现出先上升后下降再缓慢上升的趋势,第3天左右达到最大值后迅速下降,到第20天左右数量又开始上升。发酵液中乳酸菌总数在0~3 d就出现了增长的高峰,随之增长平缓,6~14d乳酸菌总数维持在最大值范围,之后随着发酵的进行缓慢降低,整个发酵过程中乳酸菌生长情况较好,菌落总数基本维持在107CFU/mL以上。酵母菌数量在发酵刚开始时较少,随着腌制的进行在发酵初期较大量繁殖后又减少,发酵14d左右总数趋于稳定。
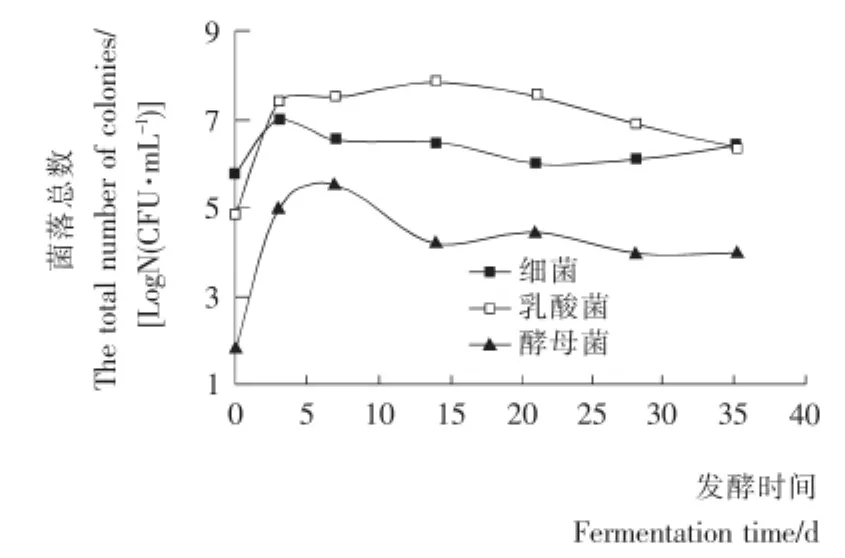
图1 细菌、乳酸菌和酵母菌总数随发酵时间的变化Figure 1 The total number of bacteria,lactic acid bacteria and yeast changes along with the fermentation time
2.1.2 霉菌的检测 图2为苦苦菜腌制前进行烫漂和不烫漂处理,腌制后感官品质的对比,以及不烫漂的情况下霉菌生长情况。由图2可知,随着发酵天数的增加,苦苦菜烫漂和不烫漂处理后的感官品质虽均有所下降,但整体上烫漂后苦苦菜的色泽、香气、滋味等品质要高于不烫漂处理,并且下降趋势平缓,发酵第30天感官品质仍保持在80分左右,这主要是因为烫漂温度达到95℃时,会导致苦苦菜中的叶绿素酶失活,时间适当延长,苦苦菜的变色程度越轻,但考虑到菜要腌制,对苦苦菜进行10s左右的烫漂处理,这样的处理不仅可以获得很好的护色效果,还能祛除苦涩味[10],提高腌菜品质。此外,苦苦菜在腌制时极易出现霉变问题,腌制前将菜烫漂还能有效地减少苦苦菜自然发酵前的杂菌,烫漂处理过的苦苦菜中未检测出霉菌的出现,未烫漂苦苦菜中霉菌总数检测见图2,并伴有不良气味。
2.2 乳酸菌的分离及鉴定
2.2.1 自然发酵苦苦菜中乳酸菌的分离 自然发酵苦苦菜汁中乳酸菌经培养、分离纯化后,一共挑出10株可疑菌株进行液体发酵,利用酸碱滴定法测定发酵液中的产酸量,最终共筛选出4株产酸较多的菌株,分别记为L1、L2、L3和L4。
2.2.2 乳酸菌的鉴定 对4株产酸量高的乳酸菌(L1、L2、L3、L4)进行进一步的菌种鉴定,对菌株进行形态学分析和生化特征鉴定等,结果见图3和表2、3。通过运动性检查结果显示4菌株均无运动性。
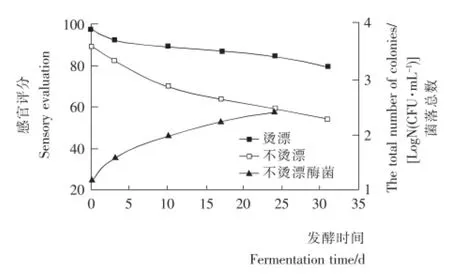
图2 预处理方式对苦苦菜腌制品品质的影响Figure 2 The influence of different treatments on quality of dandelion before pickled processing
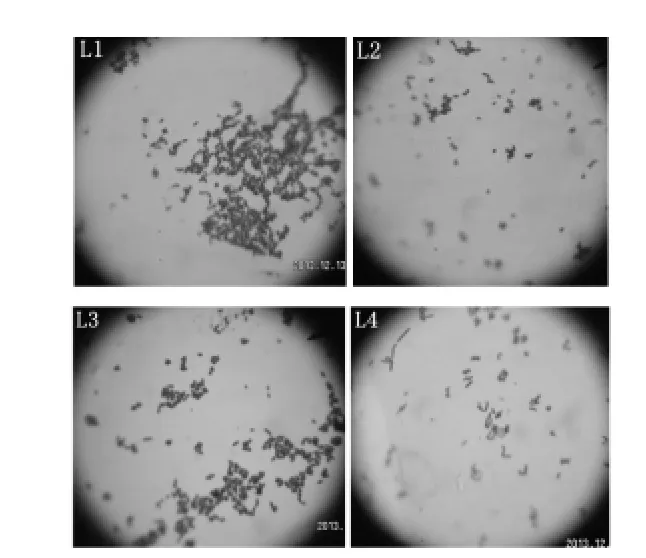
图3 菌株L1、L2、L3、L4的革兰氏染色结果Figure 3 Gram staining results of strain L1,L2,L3and L4
表2 生化鉴定结果Table 2 The biochemical test results
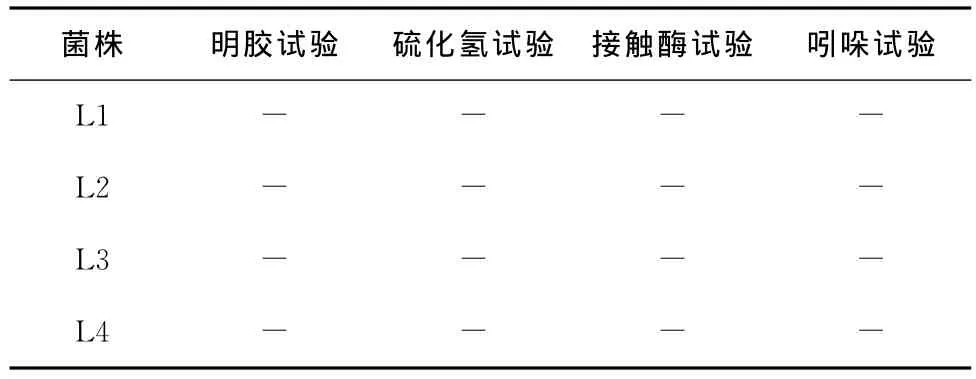
表2 生化鉴定结果Table 2 The biochemical test results
“-”为阴性反应。
菌株 明胶试验 硫化氢试验 接触酶试验 吲哚试验L1----L2----L3----L4----
表3 糖发酵试验结果Table 3 The result of sugar fermentation
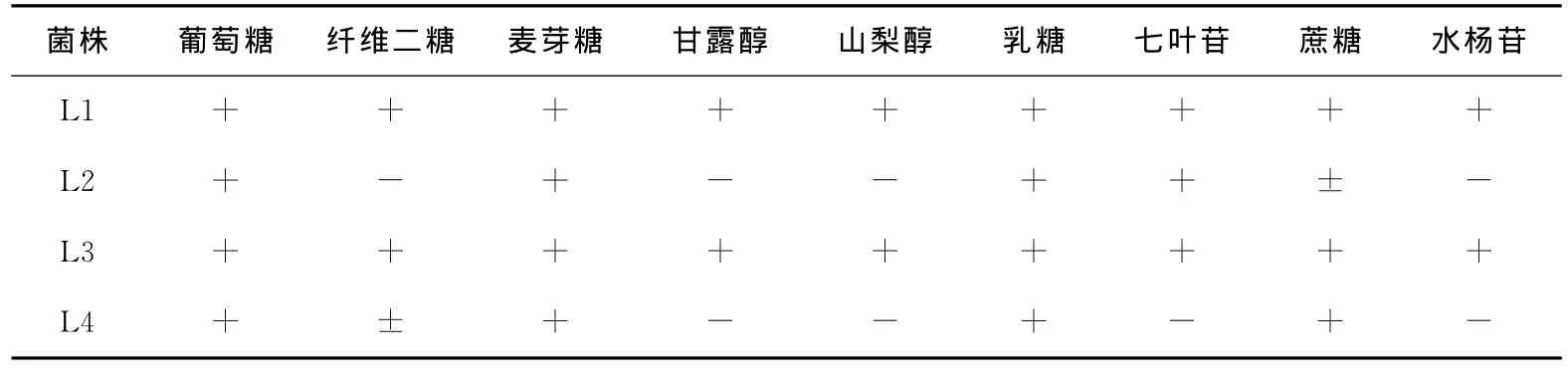
表3 糖发酵试验结果Table 3 The result of sugar fermentation
“+”为阳性反应,“-”为阴性反应,“±”为不确定性反应。
菌株 葡萄糖 纤维二糖 麦芽糖 甘露醇 山梨醇 乳糖 七叶苷 蔗糖 水杨苷L1+++++++++L2+-+--++±-L3+++++++++L4+±+--+-+-
由图3和表2、3可知,这4株菌均为革兰氏阳性,氧化酶阴性,接触酶阴性杆菌,根据《伯杰氏细菌学手册》[11],这4株菌都属于乳酸杆菌Lactobacillus。在这4株菌中,L1和L3菌落圆形突起,表面光滑呈白色,边缘整齐不透明,菌体形态为短杆或圆端直杆,单个或成对或呈链状排列,两者的生理生化试验结果也基本相同,试验用的糖、醇都能进行发酵,可以判断这两株菌均为植物乳杆菌(Lactobacillusplantarum)。菌株L2圆形边缘整齐,表面粗糙呈灰白色,菌体形态为短杆,单个或成对存在,糖醇发酵试验结果表示其不能利用纤维二糖、甘露醇、山梨醇和水杨苷,可判定为短乳杆菌(Lactobacillusbreris)。L4菌株呈白色圆形,边缘整齐,表面光滑半透明,菌体形态为杆状,单生或短链,对比其生化鉴定结果可判定该菌为发酵乳杆菌(Lactobacillusfermentum)。
L1、L2、L3和L4随苦苦菜发酵天数变化的生长曲线如图4所示。蔬菜的发酵主要有发酵初期、中期和后期3个阶段[6]。由图4可知,发酵初期0~3d,苦苦菜发酵液中的3种乳酸菌均快速地增长,其中主要以植物乳杆菌为优势乳酸菌,短乳杆菌和发酵乳杆菌的数量不多,随着发酵时间的延长,植物乳杆菌仍较快地增长,而短乳杆菌和发酵乳杆菌呈现出缓慢的增长趋势。7~14d进入主发酵阶段,由于初期发酵进行一段时间后,酸度增加pH下降,一些不抗酸的微生物不能存活,各种乳酸菌数量则不断增长,这时植物乳杆菌仍占优势,短乳杆菌菌落总数在这个阶段迅速地增长,植物乳杆菌和短乳杆菌分别达到各自增长的最大值,而发酵乳杆菌的数量仍增长缓慢。乳酸菌的大量繁殖,发酵后期15d后发酵液中乳酸含量猛增开始反馈抑制乳酸菌的生长,植物乳杆菌和短乳杆菌菌落总数开始不断减少,发酵乳杆菌的数量继续增加后也开始减少,为苦苦菜发酵后期的优势乳酸菌。
2.3 理化指标测定结果
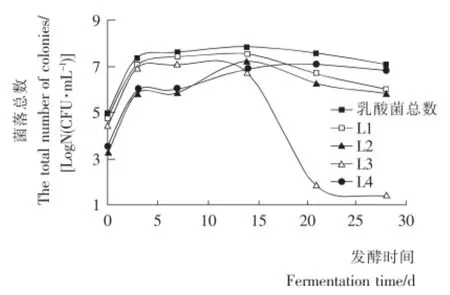
图4 L1、L2、L3和L4菌株生长曲线Figure 4 Growth curve of L1、L2、L3and L4
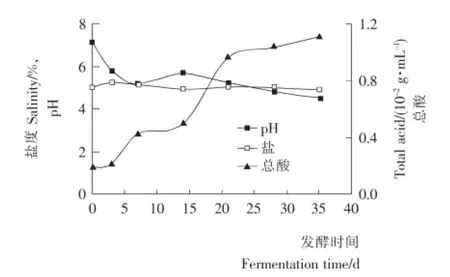
图5 发酵过程中pH、总酸和盐度变化曲线Figure 5 Changes curve of pH,total acid and salinity during fermentation
由图5可知,前3d苦苦菜启动发酵,发酵初期随着异型乳酸菌发酵的进行,生成的乳酸、醋酸等物质使苦苦菜发酵液的总酸含量不断增加,同时导致发酵液的pH值迅速下降,苦苦菜在前3dpH值下降最快。主发酵期间随着乳酸菌的大量繁殖,总酸度增长最快,pH值呈现出不断下降的趋势。发酵后期体系进入过酸阶段,可发酵碳水化合物耗尽,乳酸菌群受到抑制,这种反馈抑制使总酸含量的增长趋于平稳,pH值也趋于稳定。此外随着发酵天数的增加,苦苦菜发酵液中的盐度经历先上升后下降的趋势,在发酵初期盐度比初始盐度高,因为在发酵初期会产生使盐度上升的亚硝酸盐,但亚硝酸盐会随着发酵液pH的降低逐渐消失,整个发酵过程中,盐度变化浮动在0.3%以内。
2.4 苦苦菜中呈味氨基酸随发酵时间的变化
食品中所含的游离氨基酸对食品的滋味贡献大,所以测定游离氨基酸的组成与含量是研究氨基酸对食品滋味的影响时十分必要的内容。氨基酸分为D-型氨基酸和L-型氨基酸,主要按照其侧链基团分类,同时也影响了氨基酸的口味感官。甜味氨基酸大多为D-型氨基酸;L-型氨基酸中,呈苦味的主要为侧基较大并带碱基的氨基酸;当侧基很小时一般为甜感,当侧基带有芳香基团时通常具有香味[12]。按照味觉强度,可以大致把氨基酸分为甜味、苦味、鲜味和芳香族氨基酸(甜味:丝氨酸Ser、甘氨酸Gly、苏氨酸Thr、丙氨酸Ala、脯氨酸Pro、组氨酸His;苦味:缬氨酸Val、亮氨酸Leu、异亮氨酸Ile、精氨酸Arg、蛋氨酸Met、色氨酸Trp;鲜味:谷氨酸Glu、赖氨酸Lys、天冬氨酸Asp;芳香族:酪氨酸Tyr、苯丙氨酸Phe、半胱氨酸Cys)。苦苦菜腌制发酵各个时期呈味氨基酸随发酵时间的变化见图6。
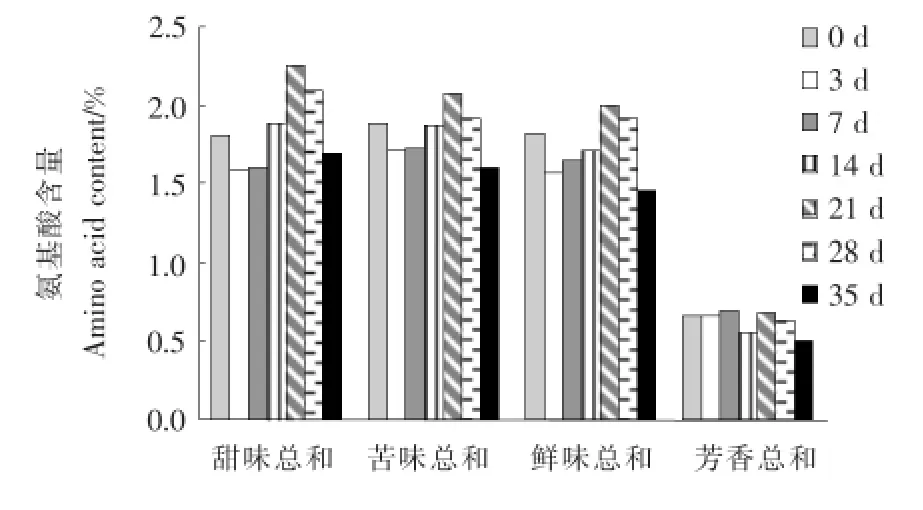
图6 苦苦菜中呈味氨基酸随发酵时间的变化Figure 6 Flavor amino acids in dandelion change along with the fermentation time
由图6可知,整个发酵过程中苦苦菜的氨基酸含量变化明显。甜味、苦味、鲜味氨基酸含量相差不大,变化的平均值分别为1.84%,1.82%,1.72%,变化趋势也基本一致,都呈现出先减少后增加再减少的变化,芳香族氨基酸含量变化的平均值为0.63%,仅约为其他呈味氨基酸的1/3。除芳香族氨基酸外,甜味、苦味、鲜味的氨基酸含量的变化为:发酵中期含量减少,发酵中后期含量增加,发酵末期含量减少,并均在发酵中后期20d左右达到最高值,含量分别为2.24%,2.08%,1.99%。从发酵时间看各呈味氨基酸含量的变化,发酵初期苦苦菜中氨基酸以苦味氨基酸居多,含量为1.88%,高于甜味1.80%和鲜味1.82%,同时由于苦苦菜中含有许多具有生物活性的倍半萜、三萜及黄酮类化合物[13],萜类化合物一般以含有内酯、内氢键、内缩醛、糖苷基等能形成螯合物的结构而具有苦味,所以这个阶段的苦苦菜发酵滋味一般。随着发酵的进行苦味氨基酸含量逐渐减少,甜味和鲜味氨基酸的含量逐渐增加。苦味氨基酸的减少与乳酸菌的代谢有关,如Liu等[14]研究发现精氨酸(Arg)可以被发酵乳杆菌、短乳杆菌等乳酸杆菌代谢。
此外,感官试验表明,主发酵期间的苦苦菜苦味、咸味、酸味都比较均衡,滋味最好。发酵后期苦味氨基酸含量为1.91%,低于甜味氨基酸2.09%和鲜味氨基酸1.92%的含量,发酵乳杆菌逐渐成为优势乳酸菌,可代谢氨基酸的乳酸菌中短乳杆菌和发酵乳杆菌代谢氨基酸能力强,除了可以利用精氨酸(Arg)外,还可以利用丝氨酸(Ser)、谷氨酸(Glu)、天门冬氨酸(Asp)和支链氨基酸[14],各种呈味氨基酸的含量都逐渐减少。整个发酵过程中芳香族氨基酸的含量变化不大,只出现平均为0.08%小幅度的增减。
乳酸菌在自然生长环境中有完善的蛋白代谢系统,因其不能同化无机氮源,所以必须通过降解蛋白质和多肽来满足细胞合成代谢对氨基酸的需要。苦苦菜在整个发酵过程中菜中的蛋白质会被蛋白酶降解形成氨基酸,形成的氨基酸渗透进入发酵液中,有些氨基酸又会被微生物生长繁殖利用,各氨基酸含量的增减也与苦苦菜原料本身所含可溶性蛋白质的含量及种类都有关系。
3 结论
苦苦菜在自然发酵过程中,6~14d乳酸菌总数维持在最大值范围,整个发酵过程中乳酸菌生长情况较好,菌落总数基本维持在107CFU/mL以上,发酵初期和主发酵期以植物乳杆菌为优势乳酸菌,发酵后期以发酵乳杆菌为优势菌。发酵初期,总酸增长缓慢,呈味氨基酸中尤以苦味氨基酸含量较多,主发酵期,总酸含量快速上升,苦味氨基酸含量逐渐减少,甜味和鲜味氨基酸的含量逐渐增加,发酵后期,总酸含量趋于稳定,苦味氨基酸含量低于甜味和鲜味氨基酸,发酵中后期7~20d苦苦菜的滋味最好。
苦苦菜的发酵风味除了添加的辅料的作用外,还有微生物酶降解碳水化合物、蛋白质等形成的风味物质,以及苦苦菜中各种呈味物质与氨基酸通过拮抗、协同或掩盖[15]等作用下共同产生的结果,限于本文篇幅与研究重点,此问题有待进一步研究。
1 李改燕.糟鱼发酵过程中微生物菌群和风味变化的研究[D].宁波:宁波大学,2009.
2 许继春.发酵香肠中风味物质的研究[J].中国食品,2011(23):31~33.
3 袁晓阳,陆胜民,郁志芳.自然发酵腌制冬瓜主要发酵菌种及风味物质鉴定[J].中国食品学报,2009,9(1):219~225.
4 Yvon M,Rijnen L.Cheese flavour formation by amino acid catabolism[J].International Dairy Journal,2001,11(4/7):185~201.
5 苏丹,朱伟伟,王齐,等.云南会泽引种玛卡中氨基酸组成与含量对营养与风味的影响[J].天然产物研究与开发,2013(7):940~944.
6 陈希.蔬菜低盐腌制微生物群落多样性的分析[D].宁波:宁波大学,2011.
7 James Owusu-Kwarteng,Fortune Akabanda,Dennis S Nielsen,et al.Identification of lactic acid bacteria isolated during traditional fura processing in ghana[J].Food Microbiology,2012,32(1):72~78.
8 Sneath P H A,Mair N S,Sharpe M E,et al.Manual of systematic bacteriology vol(2)[M].Baltimore:Williams and Wilkins,1986:1 209~1 234.
9 巨晓英,韩烨,周志江.自然发酵泡菜中乳酸菌的分离鉴定[J].食品与机械,2008,24(5):29~31.
10 胡望资,谭兴和,王锋,等.芋头叶柄泡菜泡制过程中主要成分的变化研究[J].食品与机械,2012,28(4):1~8.
11 布坎南R E.伯杰氏细菌鉴定手册[M].第8版.北京:科学出版社,1984:696~810.
12 Bassoli A,Borgonovo G,Caremoli F,et al.The taste of D-and L-amino acids:in vitro binding assays with cloned human bitter(TAS2Rs)and sweet(TAS1R2/TAS1R3)receptors[J].Food Chemistry,2014,150(13):27~33.
13 蒋雷,王国荣,姚庆强.苦苣菜属植物化学成分及药理活性研究进展[J].齐鲁药事,2007,26(11):670~671.
14 Liu S-Q,Holland R,Crow V L.The potential of dairy lactic acid bacteria to metabolise amino acids via non-transaminating reactions and endogenous transamination[J].International Journal of Food Microbiology,2003,86(3):257~269.
15 Labuda I.Flavor compounds[M].Encyclopedia of Microbiology(Third Edition).USA:Academic Press,2009:305~320.
