发酵全脂大豆粉提取油和蛋白的研究
2015-12-20吴海波齐宝坤江连洲张雅娜赵彩虹
吴海波 齐宝坤 江连洲 张雅娜 赵彩虹 杨 冬
(东北农业大学国家大豆工程技术研究中心1,哈尔滨 150028)(东北农业大学食品学院2,哈尔滨 150030)
发酵全脂大豆粉提取油和蛋白的研究
吴海波1,2齐宝坤2江连洲2张雅娜2赵彩虹2杨 冬1
(东北农业大学国家大豆工程技术研究中心1,哈尔滨 150028)(东北农业大学食品学院2,哈尔滨 150030)
采用发酵工艺分别联合磨碎和挤压膨化前处理技术制取大豆油和蛋白,通过油和蛋白得率及其品质评估工艺的可行性。结果显示发酵全脂豆粉联合挤压膨化能够显著提高油和蛋白提取率,总油和总蛋白得率分别为95.1%和87.12%,与水酶法得率相近,显著高于磨碎前处理工艺。磨碎豆粉与膨化豆粉经发酵提取油的品质和脂肪酸组成相似,均优于溶剂浸提油;磨碎与膨化豆粉发酵所得分离蛋白(FE-SPI和FGSPI)分子质量主要分布在10 000 u以下,FE-SPI的功能性优于或接近于FG-SPI,二者的溶解性、持水性显著优于碱溶酸沉制取的分离蛋白(W-SPI),但疏水性、持油性、乳化性、发泡性能及黏度均低于W-SPI。研究证实发酵联合挤压膨化提取大豆油作为一项环境友好制油技术具有良好的应用前景。
发酵 挤压膨化 大豆粉
大豆油的制取通常采用溶剂浸提法,虽然能保证较高的出油率,但易造成有机溶剂残留,污染环境,而且还给生产带来安全隐患。因此科研学者都在急切地寻找可替的绿色环保制油技术。水相提取法是人们较早采用的以水为提取介质的绿色制油方法,其原理是利用水油不相溶及二者的密度差,借助水将油从植物细胞中分离出来,这一方法在高含油率油料作物中取得了较好的效果,但对于大豆含油率较低的油料作物,水相法提油率较低从而限制了进一步的应用[1-3]。水相酶法是在水相提取油脂过程中辅助添加具有高度专一活性的酶类,目前常用的酶有:纤维素酶、半纤维素酶、果胶酶和蛋白酶。这些酶破坏了植物的细胞壁,将油和蛋白从致密的细胞结构中暴露出来,增加与水的接触机会[4-6],或者破坏包裹在油脂周围的脂蛋白,提高蛋白的溶解性,使油从脂蛋白和脂多糖的束缚中释放出来[7],水相酶法显著地提高了油和蛋白的提取率,因此备受观注,其中以蛋白酶效果最好,由此成为近几年水相酶法使用频率最高的酶类[8-11]。水相酶法提油率虽高,但由于酶的价格高,导致该技术成本增加,且酶易失活,给存贮和运输带来不便。
挤压膨化利用物料在挤压机腔体内受到的高温、高压、高剪切作用使纤维分子间化学键裂解,当物料经腔体末端模孔挤出时,压力骤然降低,物料内部过热水分瞬间汽化,巨大的膨胀力致使细胞爆破,胞内蛋白等物质充分暴露出来,从而更易遭到酶的攻击,因而有利于油和蛋白的提取,相比单纯的水相酶法提取,挤压膨化机械处理联合水相酶法进一步提高了油和蛋白得率[12],已成为近几年水酶法提油的必备前处理选择[13-15]。
枯草芽孢杆菌是目前公认的少数人类可食用菌株,而且相应菌株是高产活性蛋白酶菌种,工业上常接种于豆粕发酵生产所需的各种(酸、中、碱)蛋白酶。如果辅以一定的物料前处理技术,将枯草芽孢杆菌接种于全脂豆粉溶液中,利用其发酵所产蛋白酶水解蛋白,同时释放油脂,既保证了较高的油和蛋白得率,同时又节省了购买酶的成本。
目前采用微生物发酵方法从大豆中提取油和蛋白的报导较少,在前期研究基础上[16],探讨发酵联合各机械前处理技术制油工艺中:1)油和蛋白的得率;2)重点研究与鉴定所得油和蛋白的品质,综合两方面效果确定一种可行的微生物发酵提取大豆油和蛋白工艺。
1 材料与方法
1.1 主要材料
1.1.1 菌种
枯草芽孢杆菌:中国工业微生物菌种保藏中心(ATCC 20524)。
1.1.2 原料
低温豆粕:哈尔滨高科大豆食品有限责任公司;大豆:垦农22。
1.1.3 培养基
斜面保藏培养基:蛋白胨1%,牛肉膏0.5%,氯化钠0.5%,琼脂1.5%,pH 7.5,121℃灭菌20 min。
种子培养基:蛋白胨1%,牛肉膏0.5%,氯化钠0.5%,pH7.2~7.4,121℃灭菌20 min。
1.2 主要仪器
HZQ-XIOO型振荡培养箱:中国哈尔滨东联电子技术开发有限公司;剖分式双螺杆挤压机:江苏牧羊集团;Z36HK型高速恒温离心机:德国HERMLE Labortechnik GmbH公司;KDN-04Ш 型蛋白质测定仪:上海纤检仪器有限公司;Master流变仪:英国马尔文公司;TU-1901型双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;日立F4500荧光分光光度计:日本日立公司;AKTApurifier100蛋白质纯化系统:瑞典安砝码尼亚公司。
1.3 试验方法
1.3.1 原料的前处理
磨碎豆粉:原料大豆经粉碎机粉碎后,过100目筛,含油率为22.3%,蛋白含量为32.7%。
挤压膨化豆粉:全脂豆粉含水率14%,在挤压膨化机套筒温度90℃,模孔孔径18 mm,螺杆转速100 r/min的情况下膨化;膨化后的物料经粉碎机粉碎,过100目筛子;其中含油率为22.1%,蛋白含量为32.8%。
全脂豆粉发酵培养基的制备为:7.4%经各种预处理的全脂豆粉,0.09%KH2PO4,0.5%Tween80,起始pH 8.4,基于前期研究结果,灭菌条件选择80℃加热灭菌30 min。
1.3.2 发酵全脂豆粉提取油和蛋白工艺
1.3.2.1 发酵菌种的活化
取1~2环斜面保存菌种接入装有50 mL种子培养基的250 mL三角瓶中,37℃下160 r/min振荡培养20~24 h,使菌体浓度达到108CFU/mL。
1.3.2.2 枯草芽孢杆菌接种发酵全脂豆粉提取油和蛋白工艺
按前期研究的发酵最佳提油工艺条件进行[16],具体操作流程:将活化后的种子培养液按5.4%的比例分别接种于由膨化全脂豆粉、磨碎全脂豆粉组成的培养基中,37℃条件下160 r/min振荡发酵36 h。具体工艺见图1。
发酵结束后,4 500 r/min离心样品20 min,各样品呈三相分布,分别为乳状液、游离油、水解液、残渣。将水解液调节至pH 4.5附近,4℃冰箱过夜,3 000 r/min离心15 min,所得沉淀用水清洗2次后调节至pH 7,冷冻干燥制得分离蛋白。
所得乳状液放入烧杯中并置于80℃的水浴锅中加热 30 min,5 000 r/min离心 15 min,回收游离油。
所得残渣清洗2次后放入电热干燥箱中70℃烘干至恒重,测定残渣中的油脂含量。
油脂含量采用索氏抽提法测定,蛋白含量采用凯氏定氮法测量,总油和总蛋白提取率按下列公式进行计算:
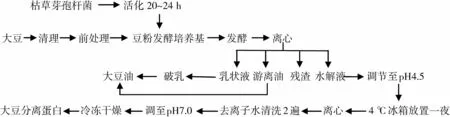
图1 枯草芽孢杆菌发酵全脂豆粉提取油和蛋白的工艺流程

1.3.3 溶剂浸提法制取大豆油
大豆经粉碎机破碎后,用正已烷索氏抽提6 h,将抽提油真空浓缩至无溶剂蒸出,再用氮气吹干残余溶剂,所得油保存待用。
1.3.4 碱溶酸沉法制备大豆分离蛋白
称取适量的低温脱脂豆粕置于烧杯中,加入去离子水至料液比为1∶10,放入60℃水浴中,同时用电动搅拌器搅拌,当料液温度达60℃后,用NaOH调至pH 8.5,保持30 min,其后高速离心30 min,收集上清液用HCL调至pH 4.5后,再次高速离心收集沉淀,并将其pH调节至7,冷冻干燥制得分离蛋白。
1.3.5 油的品质鉴定
油的酸值、碘值、过氧化值、皂化值及色泽按GB 1535—2003方法测定。
油的脂肪酸组成采用气相色谱仪检测,具体按GB 1535—2003执行。
1.3.6 分离蛋白的品质鉴定
1.3.6.1 大豆分离蛋白分子质量分布情况
将各提取方法所得大豆分离蛋白,采用pH 7.2的0.02 molTris-HCL缓冲溶液配成浓度为10 mg/3 mL的样品,选用Sephadex G-75凝胶层析柱,样品经滤膜过滤后上样,在样品流速为0.5 mL/min,紫外波长280 nm下检测流出层析柱样品的吸光值。
1.3.6.2 蛋白溶解度的测定
将分离蛋白用去离子水配成质量浓度10mg/mL的溶液,在室温下搅拌1 h;将 pH调至7,25℃下10 000 r/min离心10 min;上清液的含氮量用凯氏定氮方法测量,溶解度为上清液的蛋白含量与起始蛋白含量的百分数。
1.3.6.3 蛋白疏水性的测定
将分离蛋白用去离子水配成质量浓度10mg/mL的溶液,在室温下搅拌1 h;将 pH调至7,25℃下10 000 r/min离心10 min,所得各样品的上清液用0.01 mol/L,pH7.0磷酸盐缓冲溶液稀释至3.66~100μg/mL范围内几个浓度,疏水性用荧光探测剂ANS法测定。
1.3.6.4 持水力的测定
将各分离蛋白用0.01 mol/L,pH 7.0磷酸盐缓冲溶液配成质量浓度50 mg/mL的蛋白溶液,在室温条件下搅拌20 min;25℃条件下1 000 r/min离心30 min;上清液去除后,测剩余物中的含水量;持水力用1 g不溶蛋白(干基)中所持有的水量来表示[17]。
1.3.6.5 持油力的测定
将分离蛋白沉浸在大豆油中,按50 mg/mL质量浓度配制,室温条件下搅拌20 min;然后在25℃条件下1 000 r/min离心30 min;将上清油液去除后,测剩余物中的含油量;持油力用1 g不溶蛋白(干基)中所持有的油量来表示[17]。
1.3.6.6 乳化活性指数和乳化稳定性
乳化性以样品的乳化活性指数(EAI)表示,以乳化液刚形成后(0 min)的浊度计算[18]。
乳化稳定性(ESI)的测定方法:将分离蛋白用0.05 mol/L Tris-HCl缓冲液(pH 7.0)配制成质量浓度为10 mg/mL的溶液。量取3 mL样液,加入1 mL大豆油,均质1 min,在0 min时从底部取出50 μL,静置30 min后再从底部取出50μL,分别用25 mL质量浓度1 mg/mL的十二烷基硫酸钠(SDS)溶液稀释,在500 nm光处的吸光度值A500,以1 mg/mL的SDS溶液作空白。按Pearce等[18]方法计算乳化稳定性。
1.3.6.7 起泡性和泡沫稳定性
将分离蛋白溶于0.05 mol/L Tris-HCl缓冲液(pH 7.0)中,配制成质量浓度为10 mg/mL的溶液150 mL,在高速组织捣碎机中以12 000 r/min搅打2 min。迅速倒入量筒中,记录泡沫体积H0,以H0作为评价起泡能力大小(FC)的指标。
样品在室温下放置30 min后,测量终止泡沫体积,记为H30。以H30/H0作为评价泡沫稳定性大小(FS)的指标[19]。
1.3.6.8 流变性
将分离蛋白用去离子水配成质量浓度为100 mg/mL的溶液,在pH 7条件下,搅拌20 min。选用60 mm的模具,在剪切速率1~1 000 s-1范围内,25℃条件下测量分离蛋白的流变性。试验流变曲线遵循能量定律模式 δ=K(r)n,式中:δ为剪切应力(Pa);K为黏度系数;r为剪切速率(s-1);n为流体指数。
1.4 数据处理
每个试验数据至少进行3次测定,采用 SAS9.0统计软件单因素方差分析(Oneway ANOVA)进行组间差异性比较,显著性水平为P<0.05。
2 结果与分析
2.1 发酵全脂豆粉的总油和总蛋白提取率
发酵结束后,按SB/T 10317—1999方法测定磨碎豆粉与膨化豆粉发酵液中的碱性蛋白酶活分别为318 U/mL、337 U/mL,说明枯草芽孢杆菌在豆粉培养基生长过程中产生蛋白酶,这有益于豆粉中蛋白的水解和油脂的释放。
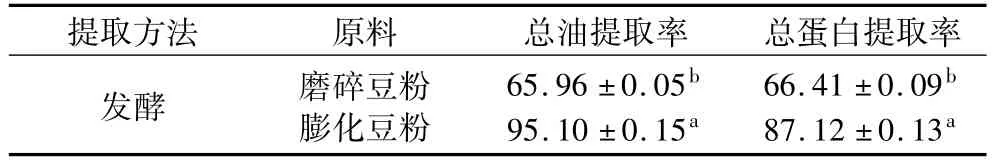
表1 总油、总蛋白提取率/%
表1显示采用发酵法提取大豆油和蛋白,原料的预处理方式对油和蛋白得率有着极大的影响,经普通磨碎处理的豆粉发酵后总油与总蛋白提取率较低,与水相提取大豆油和蛋白工艺得率相似[1-3],说明单纯采用发酵法来增进油和蛋白得率效果不明显,而发酵联合挤压膨化前处理技术显著增加了油和蛋白得率(P<0.05),分别达到 95.1%和87.12%,远高于未膨化的。由于豆粉膨化后暴露了较多胞内物质,因此更有利于发酵所产酶对作用位点的攻击,将包围在油脂外围的蛋白水解,释放出油脂,同时提升蛋白溶解性,最终导致总油和总蛋白提取率的增加。
2.2 大豆油的品质
2.2.1 油的理化指标
表2显示发酵磨碎豆粉和发酵膨化豆粉提取的油各理化指标相似,但二者与溶剂浸出油的品质存在一定差异。发酵法制取的油在酸值、碘值、过氧化值、皂化值方面均低于浸出油,且色泽比浸出油浅,说明发酵提取的油具有更好的品质,而且发酵制取的油未经精炼,几项重要的理化指标已达国家三级油的标准。粗酶提取的大豆油品质也有相似的结果[20]。
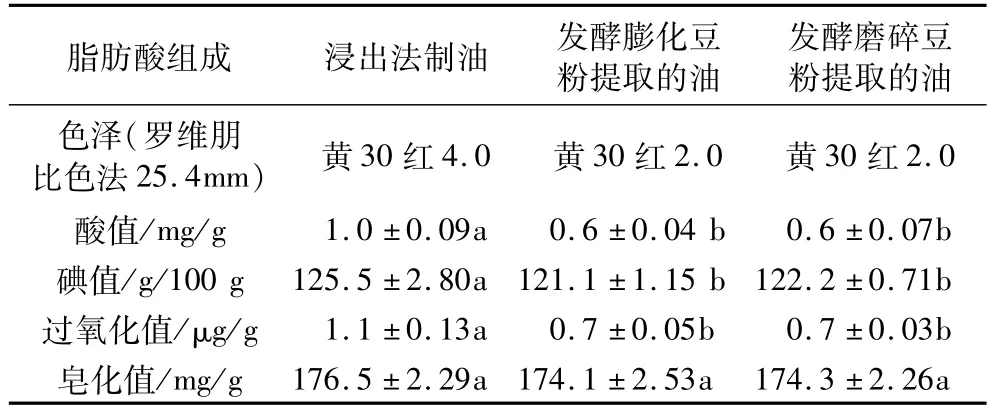
表2 各提取工艺所得大豆油的理化指标
酸价是油脂精炼程度和品质好坏的重要标志之一。发酵提油工艺中由于在发酵前对豆粉培养基的加热灭菌降低了脂肪酶的活性,减少了脂肪酶分解脂肪生成脂肪酸的机会,因此发酵提取的油酸值较低。这是溶剂浸提工艺所不具备的优势。
发酵制取的油碘值和过氧化值显著低于溶剂浸提油(P<0.05),说明油中易氧化变质的物质含量低,油的性质更稳定,品质更新鲜。
发酵法提取的油皂化值低于溶剂浸提油,说明油中游离脂肪酸和甘油酯的含量较低,这与SajidLatif等[21]的研究结果一致。
2.2.2 油的脂肪酸组成
表3显示发酵制取的大豆油与溶剂浸提油的脂肪酸组成基本一致,符合国际食品法典委员会标准CODEX STAN 210—1999。其油中主要成分为不饱和脂肪酸,含量占84%以上,其中亚油酸含量高达54%以上,亚麻酸在10.5%以上,油酸含量19.5%以上,这使所得油具有优良的营养保健作用。
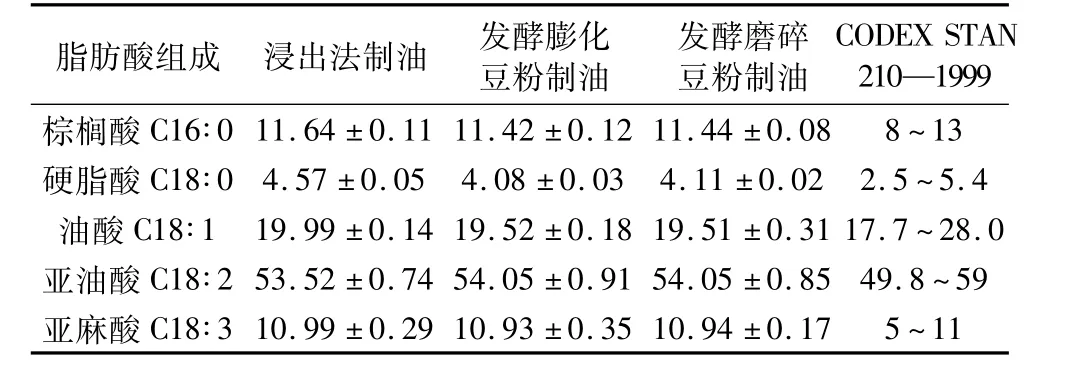
表3 各提取工艺所得大豆油的脂肪酸组成/%
与传统溶剂浸提工艺相比,发酵法制油不仅避免了有机溶剂的使用,且工艺操作条件温和,所得油具有更加良好的食用品质。
2.3 分离蛋白的性质
2.3.1 分离蛋白中粗蛋白的含量
发酵磨碎与发酵膨化全脂豆粉所得分离蛋白(FG-SPI和FE-SPI)的粗蛋白含量显著低于采用碱溶酸沉法所得分离蛋白(W-SPI)的粗蛋白含量(P<0.05),由于发酵水解豆粉过程中释放的部分游离油溶解在溶液中,因此所回收的分离蛋白中含有少量油脂,造成FE-SPI和FG-SPI粗蛋白含量低。
2.3.2 大豆分离蛋白的分子质量分布情况
凝胶层析结果显示已知分子质量的标准品牛血清白蛋白(66 000 u)的出峰时间为10.03 min,卵白蛋白(44 000 u)的出峰时间为11.12 min,胰蛋白酶(21 000 u)的出峰时间为12.97 min,溶菌酶(14 000 u)的出峰时间为14.63 min,胰岛素(5 500 u)的出峰时间为16.35 min,由此可根据各分离蛋白组分的出峰时间推测出其分子质量的分布情况。
图3为各提取方法所得大豆分离蛋白的凝胶层析图谱。
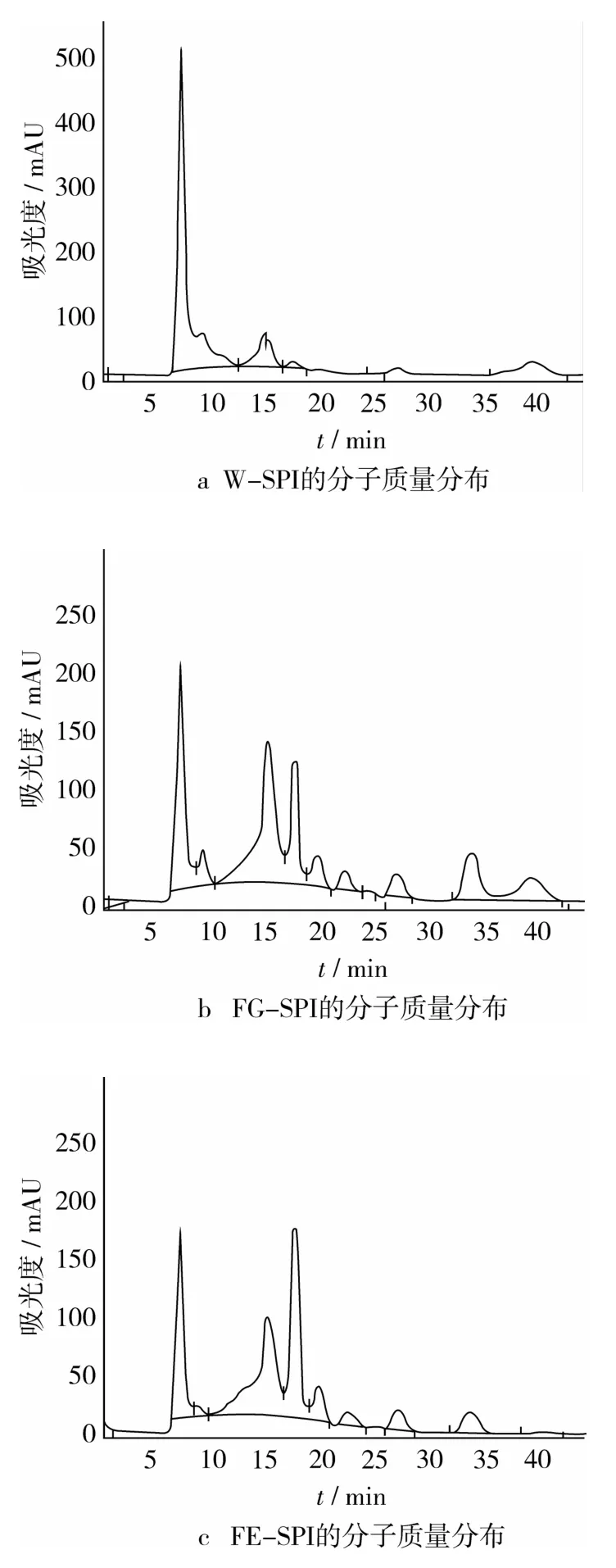
图3 分离蛋白的凝胶层析图
W-SPI的洗脱峰主要出现在洗脱时间5~10 min内,即大约75%左右的蛋白分子质量集中分布于66 000 u以上(图3a),而小分子质量的多肽含量较低。
图3b显示发酵磨碎豆粉所得分离蛋白具有较大峰面积的洗脱峰主要出现在洗脱时间15~35 min,说明FG-SPI分子质量主要分布在10 000 u以下,其中分子质量在5 500 u以下的蛋白含量最多,达38%,分子质量在10 000~5 500 u之间的蛋白含量在32%左右。由于发酵过程中产生的蛋白酶将大豆蛋白水解成小分子的多肽,因此造成发酵制取的大豆分离蛋白分子质量较小。
发酵膨化豆粉制取的分离蛋白的洗脱峰出现位置与FG-SPI相似(图3c),但在洗脱15~35 min间的洗脱峰面积更大,其中分子质量5 500 u以下的蛋白含量最多,达46%,分子质量在10 000~5 500 u之间的含量为30%。由于豆粉膨化后更有利于发酵水解的进行,因此相较于FG-SPI,FE-SPI的分子质量分布于较低区域的比例更高。
2.3.3 溶解性能与持水、持油性
表4显示发酵提取工艺所得各分离蛋白的溶解性均显著优于W-SPI(P<0.05),由于发酵水解作用,豆粉中长链大分子蛋白被降解生成短链的小分子肽,提高了蛋白在溶液体系中的分散性,这与前人大量报道的大豆水解产物具有更好的溶解性结论是一致的[22-23]。
FE-SPI的溶解性显著优于FG-SPI。豆粉膨化后,胞内蛋白充分暴露,更有利于酶的水解,因此提高了蛋白在溶液体系中的分散性。

表4 分离蛋白的溶解性、疏水性及持水、持油性
发酵提取工艺所得各分离蛋白的表面疏水性显著低于W-SPI,FE-SPI的表面疏水性比W-SPI低83%。发酵时,由于受到酶的攻击,蛋白空间构象发生改变,造成疏水小区分布位置的变化。FE-SPI的表面疏水性低于FG-SPI,但差异并不显著(P>0.05)。
发酵所得各分离蛋白的持水性均显著优于WSPI(P<0.05)(见表 4)。蛋白的吸水能力与其构象、包含的极性基团数量和类型有关[17]。发酵提取大豆油和蛋白时,在所产酶的作用下,蛋白被水解成较多的带电残基短肽,同时大量亲水基团外露,从而增强了对水分子的吸附作用。FE-SPI的持水性显著低于FG-SPI,由于膨化工艺导致豆粉中蛋白结构的重新排布,从而影响了FE-SPI的吸水性能。
发酵提取的各分离蛋白持油力均显著低于WSPI;虽然FE-SPI的持油力明显低于FG-SPI,但从实际数值来看相差并不大。
通常认为蛋白的吸油性是由于蛋白对油具有物理截留和吸附作用[24]。发酵和膨化工艺导致蛋白中暴露的疏水基团减少,降低了分离蛋白与油的结合能力;同时水解作用造成蛋白分子质量的降低难于形成凝胶质阻止油脂移动,截留作用下降,因此发酵所得分离蛋白持油性下降。
2.3.4 乳化性能与起泡能力
发酵所得各分离蛋白的乳化性均显著低于WSPI(P<0.05),FE-SPI的乳化能力低于 FG-SPI,但差异不显著(P>0.05)(见表5)。
McWatters等[25]认为乳化性受溶解性影响,一般溶解性良好的蛋白具有更好的乳化性。但对于水解产物来说,蛋白在轻度水解时(一般为<5%)乳化性会上升,但是较深水解度的多肽产物乳化性会下降[26-27]。深度水解产生的肽链较短,分子质量较小,这样的短肽不利于在油/水界面的扩散和吸附,以及形成适宜厚度的蛋白膜,因此乳化性下降。本试验发酵提油是在较深水解度下进行的,凝胶层析图显示FESPI和FG-SPI主要由分子质量10 000 u以下的短肽组成(见图3),因此乳化性较低。
一般认为具有大分子质量的长链肽蛋白乳化稳定性更高,而来自深度水解的短链肽不利于提高乳化稳定性,因此FE-SPI和 FG-SPI的乳化稳定性低于W-SPI。

表5 分离蛋白的乳化性与起泡性
发泡能力是大豆蛋白的一个重要功能特性,包括起泡性和泡沫稳定性。
表5显示碱溶酸沉法制备的分离蛋白具有良好的起泡性和泡沫稳定性,FE-SPI和FG-SPI的起泡能力和泡沫稳定性均显著低于W-SPI,FE-SPI的起泡能力和泡沫稳定性低于FG-SPI,但差异不显著。
起泡能力是蛋白表面活性功能的一种体现,因此通过提高蛋白的溶解性可达到改善发泡性能的目的[22-23]。Jung等[22]和 Lamsal等[23]的研究显示水解后的蛋白具有较高的起泡性和泡沫稳定性,且高于未水解前的母体,这与本研究结果相反。因为前者的研究是在水解度较低(水解度4%左右)情况下进行的,水解后蛋白分子质量主要分布在44 000 u至14 000 u区间,而本试验所得FE-SPI和FG-SPI分子质量均在10 000 u以下,分子质量较小,因此虽然FE-SPI和 FG-SPI具有较高的溶解度(见2.3.3),有利于泡沫的形成,但过低分子质量的短肽使蛋白黏度降低(见2.3.5),致使泡沫液膜强度低,牢固性差;且较小的蛋白易从液膜上解吸,致使液膜蛋白含量低,引起泡沫的聚合、破裂和坍塌[28],导致泡沫不稳定。因此 FG-SPI和FE-SPI的泡沫稳定性显著下降。
2.3.5 流体性质
FG-SPI和FE-SPI的表观黏度明显低于WSPI,其中FE-SPI的表观黏度最低(见图4)。
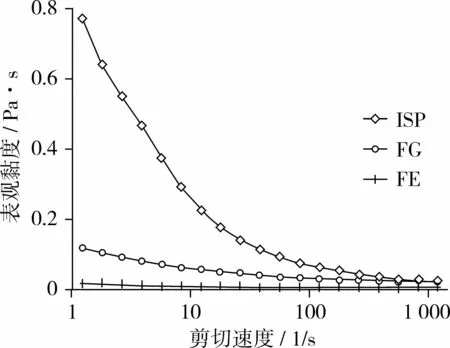
图4 分离蛋白的表观黏度
W-SPI在剪切速率1 s-1时的表观黏度明显高于剪切速率1 000 s-1时的黏度,呈典型的剪切变稀特性。
FG-SPI和 FE-SPI在剪切速率1 s-1和1 000 s-1时的黏度差异不大,黏度变化曲线接近于直线,剪切变稀的现象不明显,表现出接近牛顿流体的特性。
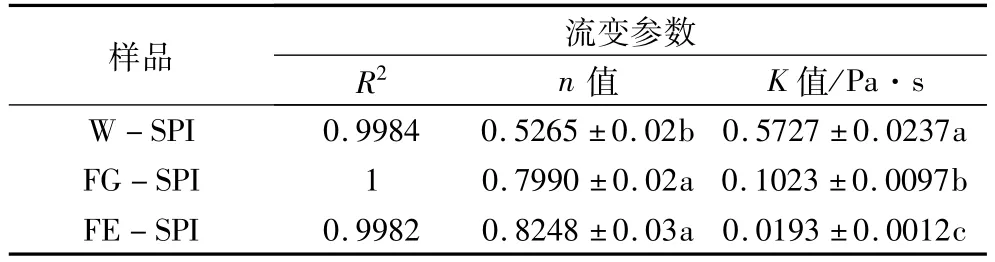
表6 分离蛋白溶液(10%)的流体行为参数
W-SPI的流变指数n小于1,明显小于FGSPI和FE-SPI的n值,呈典型的假塑性流体(表6)。而FG-SPI和FE-SPI的n值都较大,特别是FE-SPI的n值接近于1,即接近牛顿流体,这与图4结果一致。
K值代表蛋白的黏度程度,各分离蛋白的K值大小与在剪切速率1~1 000 s-1范围内所体现的表观黏度(图4)规律一致。FE-SPI和 FG-SPI的K值均显著低于W-SPI,FE-SPI的K值显著低于FG-SPI。由于发酵使豆粉中大分子蛋白降解生成小分子的短肽,所得FE-SPI和 FG-SPI的溶解性提高,因此黏度降低[29]。
3 结论
通过接种发酵全脂大豆粉提取油和蛋白,结果显示经磨碎前处理豆粉的总油和总蛋白得率较低,与水相提取油和蛋白得率相似;而发酵挤压膨化全脂豆粉,显著提高了油和蛋白提取率,分别达到95.1%和87.12%。
发酵全脂豆粉提取油的理化性质优于溶剂浸出油;脂肪酸组成与溶剂浸提油相似,符合国际食品法典委员会标准CODEX STAN 210—1999。
发酵全脂大豆粉所得分离蛋白(FG-SPI和FE-SPI)的粗蛋白含量和分子质量均低于碱溶酸沉法制得的分离蛋白,二者分子质量主要分布在10 000 u以下,其溶解性、持水性优于W-SPI,而疏水性、持油性、乳化性和乳化稳定性、起泡性和泡沫稳定性及黏度等均低于W-SPI,这与水相酶法所得蛋白的性质相似[30-31]。FE-SPI的功能性好于或接近于FG-SPI,因此采用发酵法提取大豆油时联合挤压膨化前处理技术是一个更好的选择。
[1]Rosenthal A,Pyle DL,Niranjan K.Simultaneous aqueous extraction of oil and protein from soybean:mechanisms for academic process and design[J].Food and Bioproducts Processing,1998,76(4):224-230
[2]Lamsal B P,Johnson L A.Separating oil from aqueous extraction fractions of soybean[J].Journal of the American Oil Chemists'Society,2007,84(8):78-792
[3]Jung S.Aqueous extraction of oil and protein from soybean and lupin:A comparative study[J].Journal of Food Processing and Preservation,2009,33(4):547-559
[4]Bouvier F,Entressangles B.Utilization of cellulose and pectinase in the extract of palm oil[J].Revue Francaide de Corps,1992,39(10):245-252
[5]Kwaku Tano-Debrah,Yoshiyuki Ohta.Enzyme-assisted aqueous extraction of sheafat:A rural approach[J].Journal of the American Oil Chemists'Society,1995,72(2):251-256
[6]Che Man Y B,Suhardiyono A B,Asbi A B,et al.Aqueous enzymatic extraction of coconutoil[J].Journal of the American Oil Chemists'Society,1996,73(6):683-686
[7]Rosenthal A,Pyle DL,Niranjan K.Aqueous and enzymatic processes for edible oil extraction[J].Enzyme and Microbial Technology,1996,19:403-429
[8]Abdulkarim SM,Lai OM,Muhammad SKS,et al.Use of enzymes to enhance oil recovery during aqueous extraction of Moringaoleifera seed oil[J].Journal of Food Lipids,2006,13(2):113-130
[9]Ramón Morales Chabrand,Charles E Glatz.Destabilization of the emulsion formed during the enzyme-assisted aqueous extraction ofoil from soybean flour[J].Enzyme and Microbial Technology,2009,45(1):28-35
[10]de Moura,JM LN,Campbell K,de Almeida N M,et al.Protein extraction andmembrane recovery in enzyme-assisted aqueous extraction processing of soybeans[J].Journal of the American Oil Chemists'Society,2011,88:877-889
[11]Raghavendra SN,Raghavarao K SM S.Aqueous extraction and enzymatic destabilization of coconut milk emulsions[J].Journal of the American Oil Chemists'Society,2011,88:481-487
[12]Lamsal B P,Murphy PA,Johnson L A.Flaking and extrusion asmechanical treatments for enzyme-assisted aqueous extraction of oil from soybeans[J].Journal of the American Oil Chemists'Society,2006,83:973-979
[13]Caetano M F,Couri S,Freitas SP.Enzymatic aqueous extraction of sunflower oil from extruded kernels[J].La Rivista Italiana Delle Sostanze Grasse,2002,79:165-169
[14]Wu,J,Johnson,L A,Jung,S.Demulsification of oilrich emulsion from enzyme-assisted aqueous extraction of extruded soybean flakes[J].Bioresource Technology,2009,100:527-533
[15]de Moura JM LN,de Almeida NM,Jung S,etal.Flaking as a pretreatment for enzyme-assisted aqueous extraction processing of soybeans[J].Journal of the American Oil Chemists'Society,2010,87:1507-1515
[16]HaiboWu,Lianzhou Jiang,Xiuqing Zhu,et al.Microbial fermentation simultaneous extraction processing of oil and protein from soybean[J].Advanced Materials Research,2011,2:1059-1068
[17]Hutton C W,Campbell A M.Water and fat absorption[C]//In:Cherry JP(ed)Protein functionality in foods.ACS symposium series,1981:177-200
[18]Pearce K N,Kinsella JE.Emulsifying properties of proteins:evaluation of a turbidme-tric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723
[19]Lin M J Y,Humbert E S.Certain functional properties of sun flourmeal products[J].Food Science,1974,(39):368-701
[20]吴海波,江连洲,程建军,等.粗酶水解全脂豆粉提取油脂与蛋白[J].农业工程学报,2011,4(27):376-382
[21]Sajid Latif,Farooq Anwar.Effect of aqueous enzymatic processes on sunflower oil quality[J].Journal of the American Oil Chemists'Society,2009,86(4):393-400
[22]Jung S,Murphy P A,Johnson,L A.Physicochemical and functional properties of soy protein substrates modified by low levels of protease hydrolysis[J].Food Science,2005,70:180-186
[23]Lamsal B P,Reitmeier C,Murphy PA.Enzymatic hydrolysis of extruded-expelled soy flour and resulting functional properties[J].Journalof the American Oil Chemists'Society,2006,83(8):731-737
[24]Zayas J F.Functionality of proteins in food[M].New York:Springer-Verlag Berlin and Heidelberg GmbH&Co.K,1997:228
[25]McWatters K H,Holmes,M R.Influence of pH and salt concentration on nitrogen solubility and emulsification properties of soy flour[J].Food Science,1979,44:770-773,781
[26]Mahmoud M I.Physicochemical and functional properties of protein hydrolysates in nutritional products[J].Food Technology,1994,48:89-95
[27]Surowka K D,Zmudzinski,J.Enzymic modification of extruded soy protein concentrates as amethod ofobtaining new functional food components[J].Innovative Food Science&Emerging Technology,2004,15:153-160
[28]Adebowale K O,Lawal O S.Foaming,gelation and electrophoretic characteristics of mucuna bean(mucunapruriens)protein concentrates[J].Food Chemistry,2003,83(3):237-246
[29]Lamsal B P,Jung S,Johnson L A.Rheological properties of soy protein hydrolysates obtained from limited enzymatic hydrolysis[J].LWT-Food Science and Technology,2007,40(7):1215-1223
[30]Stephanie J,Abdullah A,Mahfuz.Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J].Food Chemistry,2009,144:947-954
[31]de Almeida NM,de Moura JLM N,Johnson LA.Functional properties of protein produced by two-state aqueous countercurrent enzyme-assisted aqueous extraction[J].American Oil Chemists’Society Annual Meeting 2010,Phoenix,AZ.
Oil and Protein from Fermentation-Assistant Aqueous Extraction of Full Fat Soybean Powder
Wu Haibo1,2Qi Baokun2Jiang Lianzhou2Zhang Yana2Zhao Chaihong2Yang Dong1
(The National Research Center of Soybean Engineering and Technology,Northeast Agricultural University1,Haerbin 150028)(College of Food Science,Northeast Agricultural University2,Haerbin 150030)
Fermentation-assistant aqueous extraction processed with full fat soybean powder in combination with grind and extrusion pretreatmenthas been separately evaluated for the feasibility based on the yield and quality of oil and protein.From fermentation extraction processing in combination with extrusion,total oil and total protein extraction yields were 95.1%,87.12%,respectively,higher than that of fermentation with grind pretreatment,and closed to that produced from enzyme-assistant aqueous extraction process.Quality of oil extracted from ground soy flours was similar to that from extruded flours.Compared to solventextraction,fermentation extraction oil had the better quality even no significant difference in the fatacid compositions.Soybean protein isolate extracted from extrusion flours(FE-SPI)had the better function/similar to isolate that extracted from ground flours(FG-SPI);further,both of themolecularweightswere below 10 000 u.Both FE-SPIand FG-SPIwere better than soybean protein isolate obtained by isoelectric pointmethod(W-SPI)in the aspects of solubility,water-holding capacity,butmore inferior in surface hydrophobicity,fat-holding capacity,emulsifiability,foamability,viscosity.As an environmentally-friendly technology alternative to solvent extraction of soybean oil,fermentation-assistant aqueous extraction processing combined with extrusion pretreatment had better application perspective.
fermentation,extrusion,soybean Power
TS224.4
A
1003-0174(2015)08-0024-08
中国博士后科学基金第54批面上资助(2013M541333),黑龙江省博士后资助项目(LBH-Z12053)
2014-03-13
吴海波,女,1975年出生,副研究员,粮食、油脂与植物蛋白工程
江连洲,男,1960年出生,教授,粮食、油脂与植物蛋白工程
