大豆分离蛋白结构特性与表面疏水性的关系
2015-12-20齐宝坤赵青山张晓松江连洲
许 晶 齐宝坤 赵青山 金 花 张晓松 江连洲
(东北农业大学理学院1,哈尔滨 150030)(东北农业大学食品学院2,哈尔滨 150030)
大豆分离蛋白结构特性与表面疏水性的关系
许 晶1齐宝坤2赵青山1金 花1张晓松1江连洲2
(东北农业大学理学院1,哈尔滨 150030)(东北农业大学食品学院2,哈尔滨 150030)
对不同品种大豆分离蛋白溶解性、表面疏水性、巯基含量进行测定,同时采用拉曼光谱法对蛋白质二级结构及氨基酸侧链进行分析,探讨大豆分离蛋白结构特性与表面疏水性关系。结果表明:不同品种大豆分离蛋白表面疏水性由大到小顺序依次为:东农46(743.87)>皖豆24(730.14)>黑农46(717.54)>五星4(625.22)>中黄13(613.38)>冀NF58(600.61),并与溶解性呈负相关,与巯基含量呈正相关。不同品种大豆分离蛋白具有不同的二级结构,当α-螺旋含量降低、无规卷曲含量升高时,蛋白分子结构变的松散,使包埋在分子内部的疏水性残基更多的暴露出来,导致表面疏水性增加。
大豆分离蛋白 结构特性 表面疏水性
大豆分离蛋白(SPI)是一种重要的植物蛋白产品,不仅营养价值丰富,还具有如溶解性、凝胶性、乳化性、起泡性和表面性质等功能特性。蛋白质的疏水作用是一种配位体间非共价键相互作用,对蛋白质的稳定性,构想和蛋白质功能具有重大意义。蛋白质的疏水性可被分为2类:1)表面疏水性,与疏水基在蛋白质表面暴露的程度有关;2)蛋白质氨基酸残基的平均疏水性,取决于氨基酸残基从水相转移到有机物相的自由能[1]。蛋白质的表面疏水性不仅与加工条件、加工方法有关,而且与蛋白质的理化性质和结构特性等密切相关[2],并且随着大豆品种和产地的不同而有所差异。
拉曼光谱是一种与分子或晶格振动相关的光子非弹性散射光谱。利用物质的拉曼光谱特异性,以散射光的强度随拉曼位移的变化表示,通过峰的位置和强度,反映功能团或化学键的特征振动频率及分子结构[3]。拉曼光谱可以用于蛋白质二级结构、巯基和二硫键以及氨基酸侧链等结构的分析。
本试验对不同品种大豆分离蛋白溶解性、表面疏水性、巯基含量进行测定,并采用拉曼光谱法对蛋白质二级结构及氨基酸侧链进行分析,进而探讨大豆分离蛋白结构特性与表面疏水性关系,为改善大豆分离蛋白的功能性质和拓展其应用范围奠定基础,以期为大豆精深加工及高值化应用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
大豆品种:东农46;东北农业大学大豆研究所;皖豆24:安徽省农业科学院作物研究所;黑农46:黑龙江省农业科学院大豆研究所;中黄13:中国农业科学院作物育种栽培研究所;冀NF58、五星4:河北省农林科学院粮油作物研究所。
SDS、Tris、甘氨酸、5,5′-二硫双 -2-硝基苯甲酸(DTNB)、8-苯胺基 -1-萘磺酸(ANS):美国Sigma公司;蛋白 Marker(SM0431):Fermentas life sciences公司。
PerkinElmer Raman Station 400拉曼光谱仪:美国PE公司。
1.2 方法
1.2.1 大豆分离蛋白的制备
原料大豆经去皮、粉碎后过60目筛,然后在40℃条件下采用正己烷萃取以制备脱脂豆粕。将脱脂豆粕按1∶15的质量比与水混合,用2 mol/L NaOH调pH至8.0,搅拌l.5 h后,将其悬浮液在4℃条件下7 500 r/min离心 30 min,取上清液用 2 mol/L HCl调pH至4.5。静置后在4℃条件下4 500 r/min离心30 min,取蛋白沉淀水洗2次,最后取沉淀分散于水中并用2 mol/L NaOH调 pH至7.0。再在4℃条件下7 500 r/min离心30 min,除去少量的不溶物,将其蛋白溶液冷冻干燥后粉碎即得粉末状大豆分离蛋白。蛋白质含量的测定:凯氏定氮法(GB/T 5009.5—2010)。
1.2.2 蛋白质溶解性的测定
蛋白质溶解性的测定参考Samoto等[4]的方法。称取100 mg蛋白样品分散于10 mL的去离子水中,磁力搅拌30 min,20℃、9 000 r/min离心20min。上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度以上清液中蛋白含量占总蛋白含量的质量浓度(mg/g)来表示。
1.2.3 蛋白质表面疏水性的测定
根据Kato等[5]采用的ANS荧光探针法对蛋白质表面疏水性进行测定。分别称取0.025 g不同品种蛋白样品溶于50 mL磷酸盐缓冲液(0.01 mol/L,pH 7.0)中,在室温条件下搅拌1.0 h,然后在7 500 r/min离心30 min,取上清液用Lowry法测定蛋白浓度,并用同一磷酸盐缓冲液依次稀释(浓度在0.005~0.5 mol/mL之间)后,取不同浓度样品的溶液4 mL,分别加入40μL浓度为8 mmol/L的ANS溶液(用0.01 mol/L,pH 7.0的磷酸盐缓冲液配制),经振荡后静置3 min,再测定样品的荧光强度(FI)。试验中激发波长λex=370 nm,发射波长λem=490 nm,夹缝为5 nm。以荧光强度对蛋白质浓度作图,初始段斜率即为蛋白质分子的表面疏水性(H0)。
1.2.4 蛋白质巯基含量的测定
蛋白质巯基含量的测定参考Shimada等[6]改进的Ellman试剂法,并做适当的调整。
游离巯基的测定:取2 mL大豆分离蛋白溶液,加入5 mL Tris-甘氨酸缓冲液(0.086 mol/L Tris-0.09 mol/L甘氨酸 -4 mmol/L Na2EDTA,pH 8.0)中,再加入4 mg/mL DTNB的Ellman试剂0.1 mL,测定时溶液经漩涡迅速混合后在25℃下保温反应15 min,用分光光度计测定其在412 nm处吸光度值(A412),以不加Ellman试剂的溶液作为对照,每组样品测定3次取平均值。
总巯基的测定:取2 mL大豆分离蛋白溶液,加入5 mL Tris-甘氨酸-8MUrea-0.5%SDS溶液中,再加入4 mg/mL DTNB的Ellman试剂0.1 mL,测定时溶液经漩涡迅速混合后在25℃下保温反应15 min,用分光光度计测定其在412 nm处吸光度值(A412),以不加Ellman试剂的溶液作为对照,每组样品测定3次取平均值。
巯基含量计算公式如下:

式中:A412为加Ellman试剂时样品的吸光度与不加Ellman试剂时样品的吸光度的差值;D为样品稀释系数;C为样品的蛋白质最终浓度/mg/mL。
1.2.5 拉曼光谱测定
参考张萍等[7]方法。将大豆分离蛋白分散于相应的pH缓冲液中配制成100 mg/mL样品溶液进行拉曼光谱测定,激发光波长为785 nm,发射功率为300 mW,拉曼光谱扫描范围为400~2 000 cm-1,每个样品都重复扫描3次,各样品的拉曼谱图都由计算机作信号累加平均并绘图输出,峰位误差小于±3 cm-1。以苯丙氨酸的 1 003 cm-1作为归一化因子,以此作为各拉曼峰强度变化的依据,得到大豆分离蛋白的拉曼光谱图。蛋白质的二级结构及氨基酸侧链数据由计算机软件拟合输出,用于蛋白质的结构分析。
1.2.6 统计分析
每个试验重复3次,结果表示为平均数x±s。数据统计分析采用SPSS V17.0软件对数据进行ANOVA差异显著性分析,P<0.05为显著性差异,采用Origin8.0软件作图。
2 结果与分析
2.1 不同品种大豆分离蛋白的蛋白质含量测定
不同品种大豆分离蛋白的蛋白质含量采用凯氏定氮法进行测定,见表1。由表1可知,不同品种大豆分离蛋白的蛋白质含量较接近,且均大于90%,纯度较高,达到了蛋白质结构和性质测定的标准。

表1 不同品种大豆分离蛋白的蛋白质含量
2.2 不同品种大豆分离蛋白的溶解性和表面疏水性分析
不同品种大豆分离蛋白的溶解性和表面疏水性见表2。由表2可以看出,不同大豆分离蛋白种类对溶解性和表面疏水性有一定的影响。对于溶解性来说,由大到小顺序依次为:冀NF58>中黄13>五星4>皖豆24>黑农46>东农46;而表面疏水性与溶解性大致相反,由大到小顺序依次为:东农46>皖豆24>黑农46>五星4>中黄13>冀NF58。这表明表面疏水性与溶解性呈负相关,这一结果与Paraman等[8]研究的大米蛋白表面疏水性与溶解性呈负相关的结果相一致。分析原因可能是由于蛋白质表面疏水性主要取决于暴露于蛋白质分子表面的疏水性残基,当疏水性残基暴露在分子表面时,则表现为一定的疏水性,而暴露在蛋白分子表面的疏水性残基广泛的参与分子间作用,使得蛋白质的溶解性降低;此外,溶解性较好的蛋白质表面存在着较少的疏水性残基[9],这也有可能导致蛋白质具有较好溶解性的同时,其表面疏水性较差。

表2 不同品种大豆分离蛋白的溶解性和表面疏水性
2.3 不同品种大豆分离蛋白的巯基含量分析
不同品种大豆分离蛋白的游离巯基含量、总巯基含量及游离巯基与总巯基的比值见图1。如图1所示,6种大豆分离蛋白的游离巯基含量、总巯基含量及游离巯基与总巯基的比值与其相应表面疏水性数值(表2)的变化规律相似,由大到小顺序依次为:东农46>皖豆24>黑农46>五星4>中黄13>冀NF58,说明具有较高的游离巯基含量、总巯基含量及游离巯基与总巯基比值的大豆分离蛋白品种同时具有较高的表面疏水性。游离巯基与总巯基的比值反应蛋白质三级结构的解折叠程度,游离巯基与总巯基的比值越大,大豆分离蛋白的解折叠程度越强,分子结构越趋于暴露式,疏水性残基的暴露使得表面疏水性增强[10],这表明品种差异对大豆分离蛋白的结构影响较大,同时这种结构的变化也会引起表面疏水性的改变。Gu等[11]研究表明表面疏水性与游离巯基含量呈线性正相关,蛋白质的解折叠和疏水性残基的暴露是表面疏水性增大的原因;Krause等[12]认为改性蛋白表面疏水性的增加也是由于蛋白质的解折叠和疏水性残基的暴露引起的,这些研究均与本研究结果相一致。
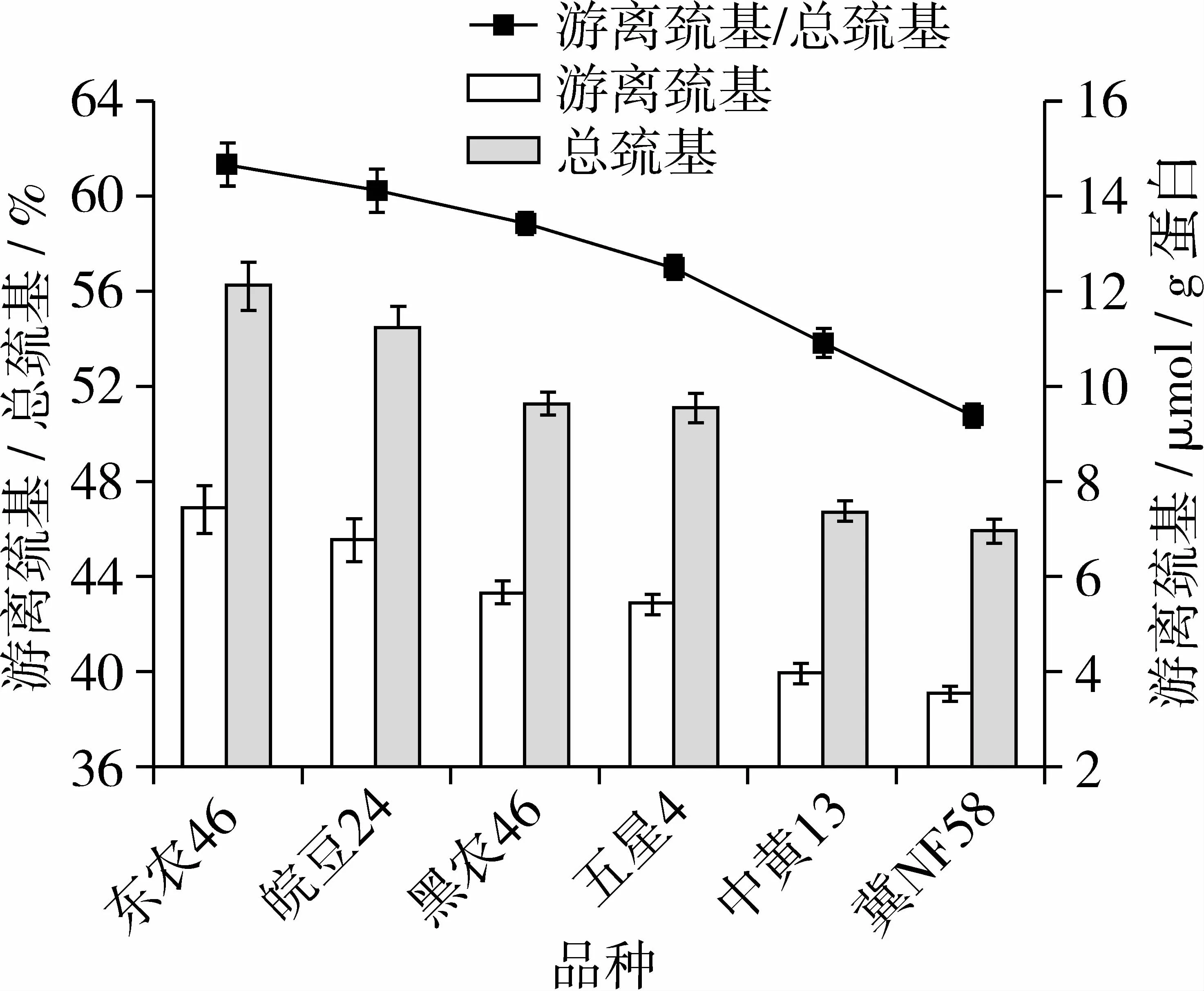
图1 不同品种大豆分离蛋白的巯基含量
2.4 不同品种大豆分离蛋白的拉曼光谱分析
采用拉曼光谱对蛋白质的结构进行分析,通过拉曼光谱吸收峰位置和强度的变化,可以得到蛋白质二级结构信息以及氨基酸侧链构象信息的变化情况[13]。图2为6种大豆分离蛋白的拉曼光谱图,在对拉曼光谱进行分析中,大豆分离蛋白结构变化的定量信息,可以根据其分子结构所指认吸收峰的相对强度来表示,采用特定软件可对蛋白质二级结构含量和氨基酸侧链信息进行拟合分析。
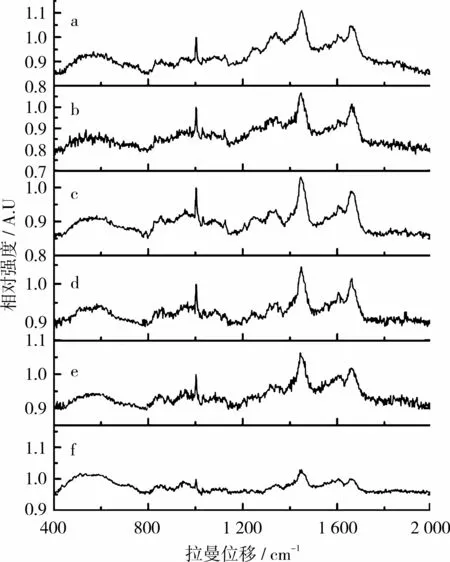
图2 不同品种大豆分离蛋白的拉曼光谱图
2.4.1 蛋白质二级结构的分析
蛋白质的二级结构主要由酰胺Ⅰ带(AmideⅠbands)和酰胺Ⅲ带(AmideⅢ bands)的拉曼特征峰确定。酰胺Ⅰ带拉曼特征峰位置为:α-螺旋为1 645~1 660 cm-1,β-折叠为 1 665~1 680 cm-1,β-转角为1 680~1 690 cm-1,无规卷曲为1 660~1 670 cm-1。酰胺Ⅲ带拉曼特征峰位置为:α-螺旋为1 265~1 300 cm-1,β-折叠为 1 230~1 240 cm-1,β-转角为 1305 cm-1,无规卷曲为 1 240~1 260 cm-1[14]。本研究中采用 Raman Spectral Analysis Package Version 2.1软件对大豆分离蛋白的拉曼图谱二级结构进行定量计算,结果见表3。

表3 酰胺Ⅰ带、酰胺Ⅲ带拟合不同品种大豆分离蛋白二级结构/%
结合表面疏水性(表2)的分析,由表3可以看出,在酰胺I带处,α-螺旋含量越小,无规卷曲含量越大,表面疏水性越高。线性相关性分析表明,表面疏水性与α-螺旋含量呈显著的负相关(相关系数为-0.936),与无规卷曲含量呈显著的正相关(相关系数为0.991),与β-折叠含量和β-转角含量之间不存在显著的线性关系。这与酰胺Ⅲ带得到的结果相似,虽然酰胺Ⅰ带和酰胺Ⅲ带拟合得出的大豆蛋白二级结构含量在数值上存在一定差异,但与表面疏水性的相关性上相一致。综合酰胺Ⅰ带和酰胺Ⅲ带拟合的蛋白质二级结构分析可知,不同品种大豆分离蛋白的二级结构具有一定差异,当蛋白质二级结构中α-螺旋含量降低,无规卷曲含量升高,即二级结构由α-螺旋结构向无规卷曲结构转变时,使分子结构变的松散,包埋在分子内部的疏水性残基更多的暴露出来,导致表面疏水性的增加[15]。本研究结果与王辰等[16]采用红外光谱法研究大豆分离蛋白表面疏水性与α-螺旋含量呈负相关且与无规卷曲含量呈正相关的结果相一致。
2.4.2 蛋白质氨基酸侧链的分析
由酪氨酸的苯环呼吸振动和苯环平面外弯曲振动倍频之间的费米共振引起850 cm-1和830 cm-1左右的特征峰随侧链微环境而变,利用这2条谱线的强度比可以分析蛋白质分子中的酪氨酸残基的暴露与埋藏[17]。当 I850/I830的比值为 1.25~1.40时,表明酪氨酸残基完全暴露于分子表面;当I850/I830的比值为0.3~0.5时,酪氨酸残基完全埋藏于分子内部;当比值为0.7时,酪氨酸残基为电离状态。根据I850/I830还可以进一步计算出暴露于分子表面和包埋在分子内部的酪氨酸残基的分子数N[18]。
由表4可以看出,6种大豆分离蛋白I850/I830的比值更接近1.25~1.40,说明酪氨酸残基趋向于“暴露式”。结合酪氨酸残基暴露与包埋分子数可以看出,不同品种大豆分离蛋白酪氨酸残基暴露分子数(N暴:N包)的大小顺序为:东农46>皖豆24>黑农46>五星4>中黄13>冀NF58,而这与表面疏水性(表2)的变化趋势相一致,这表明不同品种大豆分离蛋白酪氨酸残基的暴露程度不同,蛋白质的酪氨酸残基较多暴露于分子表面会使蛋白质的表面疏水性升高。

表4 不同品种大豆分离蛋白酪氨酸费米共振线I850/I830以及残基暴露/包埋分子数
756 cm-1处的拉曼谱带归属为色氨酸侧链,不同品种大豆分离蛋白756 cm-1处的拉曼强度分别为0.964(东农46)、0.941(皖豆 24)、0.930(黑农 46)、0.895(五星 4)、0.889(中黄 13)、0.834(冀 NF58),大小顺序依次为:东农46>皖豆24>黑农46>五星4>中黄13>冀NF58。大豆分离蛋白的色氨酸谱带的强度越大,表明色氨酸残基由埋藏在蛋白分子内部向蛋白分子的表面暴露。结合表面疏水性(表2)分析可知,不同品种大豆分离蛋白色氨酸残基的暴露程度不同,较多的色氨酸残基暴露于蛋白质分子表面会引起表面疏水性的增加。
埋藏在非极性侧链氨基酸残基暴露到蛋白质分子表面,很可能是导致蛋白质表面疏水性增加的一个重要原因。
3 结论
不同品种大豆分离蛋白表面疏水性由大到小顺序依次为:东农46(743.87)>皖豆24(730.14)>黑农46(717.54)>五星 4(625.22)>中黄 13(613.38)>冀 NF58(600.61),并与溶解性呈负相关,与巯基含量呈正相关。不同品种大豆分离蛋白的二级结构具有一定差异,当蛋白质二级结构中α-螺旋含量降低、无规卷曲含量升高时,蛋白表面疏水性的增加。
[1]黄曼,卞科.蛋白质疏水性测定方法研究进展[J].粮油食品科技,2004,12(2):31-34
[2]Huang Weining,Sun Xiuzhi.Adhesive properties of soy proteinmodified by sodium dodecyl sulfate and sodium dodecyl benzenz sulfonate[J].Journal of the American Oil Chemists'Society,2000,77(7):705-708
[3]Wood BR,McNaughton D.Raman excitation wavelength investigation of single red blood cells in vivo[J].Raman Spectrosc,2002,33:517-523
[4]Samoto M,Maebuchi M,Miyazaki C,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1):317-322
[5]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probemethods and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta,1980,624:13-20
[6]Shimada K,Cheftel JC.Determination of sulfhydryl groups and disulfide bonds in heat-induced gels of soy protein isolate[J].Journal of Agricultural and Food Chemistry,1988,36:147-153
[7]张萍,郑大威,刘晶,等.基于表面增强拉曼光谱技术的豆芽6-BA残留快速检测方法[J].光谱学与光谱分析,2012(5):1266-1269
[8]Paraman I,Hettiarachchy N S,Schaefer C,etal.Hydrophobicity,solubility and emulsifying properties of enzyme-modified rice endosperm protein[J].Cereal Chemistry,2007,84(4):343-349
[9]Moure A,Sineiro J,Dominguez H,et al.Functionality of oilseed protein products:a review[J].Food Research International,2006,39(9):945-963
[10]BoatrightW L,Ettiarachchy N S.Soy protein isolate solubility and surface hydrophobicity as affected by antioxidants[J].Journal of Food Science,1995,60(4):798-800
[11]Gu X,Campbell L J,Euston SR.Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J].Food Hydrocolloids,2009,23:314-326
[12]Krause JP,Mothes R,Schwenke K D.Some physicochemical and interfacial properties of native and acetylated legumin from faba beans(Vicia faba L)[J].Journalof Agricultural and Food Chemistry,1996,44(2):429-437
[13]伍林,欧阳兆辉,曹淑超,等.拉曼光谱技术的应用及研究进展[J].光散射学报,2005,17(2):180-186
[14]Tu A T.Advances in spectroscopy[M]//Clark R J H,Hester R E,Spectroscopy of biological systems.New York:John Wiley&Sons Chichester,1986:65-116
[15]Liu Ru,Zhao Siming,Xiong Shanbai,et al.Role of secondary structure in the gelation of porcinemyosin at different pH values[J].Meat Science,2008,80(3):632-639
[16]王辰,江连洲,魏冬旭,等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学,2012,33(9):54-57
[17]Ellepolaa SW,Choib SM,Phillipsc D L,et al.Raman spectroscopic study of rice globulin[J].Journal of Cereal Science,2006,43(1):85-93
[18]Kalapathy U,Hettiarachchy N S,Rhee K C.Effect of dryingmethods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J].Journal of the A-merican Oil Chemists'Society,1997,74(3):195-199.
Relationship Between Structural Properties and Surface Hydrophobicity of Soybean Protein Isolate
Xu Jing1Qi Baokun2Zhao Qingshan1Jin Hua1Zhang Xiaosong1Jiang Lianzhou2
(College of Science,Northeast Agricultural University1,Haerbin 150030)(College of Food Science,Northeast Agricultural University2,Haerbin 150030)
The solubility,surface hydrophobicity and sulfhydryl content of different varieties of soybean protein isolate weremeasured.The secondary structure and amino acid side chains of protein were analyzed by Raman spectrum method at the same time.Relationship between structural properties and surface hydrophobicity of soybean protein isolate was discussed.The results showed that the order for surface hydrophobicity of different varieties of soybean protein isolate from big to smallwas Dongnong 46(743.87)>Wandou 24(730.14)>Heinong 46
(717.54)>Wuxing 4(625.22)>Zhonghuang 13(613.38)>JiNF 58(600.61),which was negatively correlated with solubility and positively correlated with sulfhydryl content.Different varieties of soybean protein isolate had different secondary structures.When alpha helix contentwas lower and random coil content increased,molecular structure of protein became loose.The hydrophobic residues embeddingwithin themoleculeweremore exposed,which led to the increase of surface hydrophobicity.
soybean protein isolate,structure properties,surface hydrophobicity
TS201
A
1003-0174(2015)08-0032-06
时间:2015-05-05 07:38
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20150505.0738.009.html
中国博士后特别资助(2014T70306),国家自然科学基金(31301600),东北农业大学博士启动基金(2012 RCB17)
2014-10-09
许晶,女,1979年出生,博士,植物蛋白工程
江连洲,男,1960年出生,教授,粮食、油脂及植物蛋白工程
