直肠癌治疗进展
2015-12-20朱耀明
刘 超,朱耀明
直肠癌治疗进展
刘超,朱耀明
手术技巧的改进和新辅助治疗方案的引进使直肠癌的局部控制得到显著改善,但仍没有充分解决直肠癌术后复发的问题。强化新辅助治疗是通过在放化疗开始之前或等待手术期间的化学疗法(可以加入靶向药物),为患者提供改善总体生存期的可能。未来,分子遗传学标志物及创新的成像技术,将提供更好的治疗方案。通过不断的努力,未来将建立可切除直肠癌理想的个体化治疗方案。
直肠癌;手术方式;放射疗法;化疗
在过去几十年,直肠癌的治疗取得了显著的进步。曾经被认为是不治之症,而今与治疗相关的死亡率已经下降到不足5%[1]。近期肿瘤预后观察的结果显示,直肠癌的长期生存率要好于结肠癌[2]。这可能得益于手术技巧的重视以及手术前后综合治疗方案的完善。然而,新辅助治疗存在不确定因素,如手术技术以及辅助治疗方式的选择等。本文重点介绍治疗过程中几个公认的治疗标准,提出一些不明确或有争议的问题,及一些重要的临床研究方向,期待未来得以解决。
1 分期
直肠癌分期的目的是制定局部治疗的方案,判定全身转移情况,识别高危复发患者及判定预后。一般的分期方法包括癌胚抗原(carcinoembryonic Antigen,CEA)的测定和胸腹CT扫描,骨扫描。局部分期方法主要包括超声内镜和MRI。超声内镜是现有低廉的能对早期癌症准确局部分期的方法。超声内镜对T1和T2期肿瘤的敏感性和特异性分别>90%和85%,对直肠系膜淋巴结评估的准确率达70%~80%[3]。
薄层、T2加权MRI对骨盆软组织有较好的分辨率。欧洲多中心研究组通过比对影像学资料和手术切除标本的病理组织学分析,发现MRI具有判断浸润层次的能力。通过对295例患者的分析,发现MRI获得的浸润深度与病理组织学获得的平均差异仅仅为0.05 mm(95%可信区间0.4~0.49)。对淋巴结转移的预测精度可达到85%[4]。
2 外科治疗
在过去几年,直肠癌局部复发率显著降低,首先是得益于外科技术的进步。全直肠系膜切除术(total mesorectal excision,TME)的基本原则有二:第一,直肠系膜筋膜脏层与壁层之间的锐性剥离;第二,盆底中低位直肠癌的全直肠系膜切除。有研究发现,远端肠管切除距肿瘤边缘小于1 cm仍然安全,结合新的手术策略,如经内外括约肌间切除直肠后行结肠肛管吻合术,致保肛手术率明显增加。低位直肠癌进行直肠切除,局部复发率远高于中高位直肠癌。事实上,当直肠系膜被解剖至盆底,不可避免地会非常接近位于齿状线附近的肿瘤,那里的直肠系膜非常薄,完整切除有很大困难。来自荷兰的直肠癌研究表明,相比于直肠前切除,腹会阴联合切除有更高的切缘复发率(26.5%与12.6%,P<0.001),以及更低的生存率[5]。在直肠癌中,保存完好的直肠系膜是至关重要的。对于大多数低位肿瘤的患者,如何避免永久性结肠造口是一个问题。长期新辅助放化疗后肿瘤缩小的情况下,可允许保留肛门括约肌。与此同时,括约肌间切除术、结肠脱出、结肠肛管吻合术的技术已经得以普及。
3 新辅助放疗和综合治疗
手术治疗结合术前或术后放疗,使得晚期直肠癌的局部复发率显著下降。最近公布的一项meta分析显示,术前放疗减少46%局部复发风险(P=0.000 01),术后放疗则减少37%(P=0.002)。然而,总生存期则只有轻微改善(63%与62%,P=0.04)。从理论角度来看,术前放疗对比于术后放疗有几大优势:(1)在外科不干扰的情况下,放疗效果更好。(2)只有术前可达到降期和减瘤的效果。(3)术后放疗可能受到术后依从性问题的阻碍,并且可能增加小肠的辐射损伤。一项来自德国的直肠癌试验论证了术前放化疗的优势,指出术前放疗可以降低局部复发率,而且毒性更小,但总生存率无明显差异[6]。来自荷兰的随机试验表明,直肠癌术前标准短期放疗是有效的,局部复发率显著降低(术前放疗加手术组降至5%,单纯手术组为11%,P<0.0001)[7]。
有健全的理论观点支持放化疗相结合:(1)化疗药物可作为放疗增敏剂,并提高放疗的疗效。(2)早期开始化疗可以减少肿瘤的全身转移。相比于单纯放疗,术前放化疗能降低局部复发率,但治疗相关毒性更明显。
术前化疗方案中额外加入化疗药物,旨在进一步提高病理缓解率,且可能改善整体生存率,推测是一个可行的方案。一些III期临床试验已经开始结合奥沙利铂用于新辅助化疗。表1中列举了几项术前放化疗方案结合奥沙利铂的随机试验的结果。可以得出,通过在新辅助放化疗方案中增加奥沙利铂并没有取得更多的病理学缓解。仅在德国的cao/ARO/aio-04试验中,加用奥沙利铂取得了显著的病理学缓解[8]。
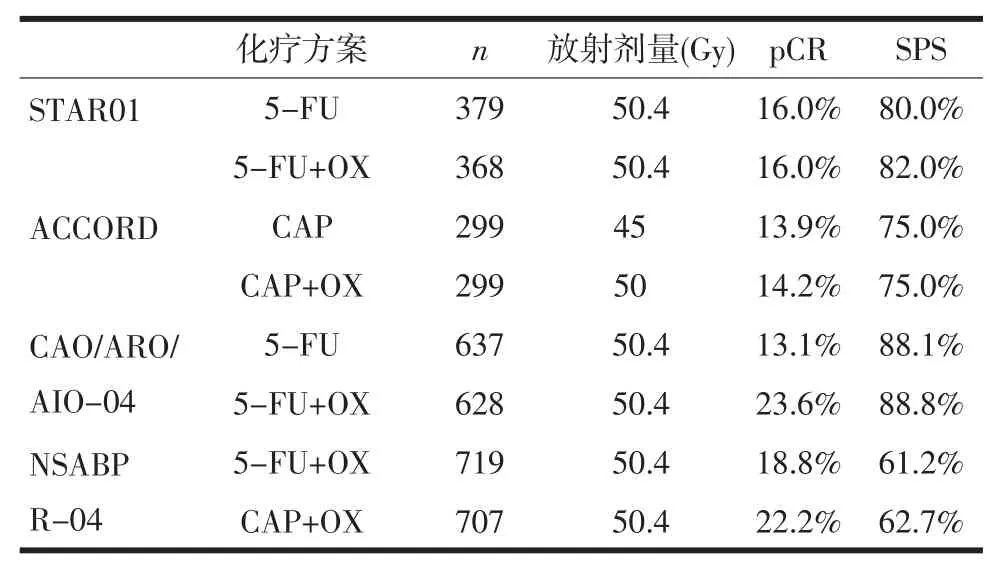
表1 术前放化疗方案结合奥沙利铂的随机试验结果
新辅助放疗中靶向药物的使用是,在术前放疗中结合使用已获准在转移性结直肠癌中使用的靶向药物如西妥昔单抗、帕尼单抗、贝伐单抗。表皮生长因子受体(epidermal growth factor receptor,EGFR)与细胞增殖、侵袭和转移密切相关[9]。几个参数表明,放疗(radiotherapy,RT)和EGFR抑制剂之间存在协同效应。(1)在肿瘤细胞中,表皮生长因子受体酪氨酸激酶活性增加可以对抗RT,在体外加入外源性的EGF可以诱导肿瘤细胞抗辐射。(2)在直肠癌患者中,EGFR表达水平的升高是一个独立的不良预后因素。大量的I/II期临床试验已经研究了术前放疗与西妥昔单抗的结合,初步结果显示,病理变化没有达到预期效果[10]。但有趣的是,KRAS基因突变是EGFR抑制剂治疗转移性结直肠癌患者的一个不良预后标志物,这种基因突变在直肠癌中减少,提示术前放疗与西妥昔单抗的结合可能有效[11]。
4 新的化疗策略
无数的新辅助放疗试验得出一致的结论是,并没有在提高总生存期上取得显著进展。因此,研究策略转向在早期治疗中提供更有效的全身治疗。这些策略包括诱导化疗后行适形放射治疗(conformal radiation therapy,CRT)和CRT后手术等待期内行巩固化疗。现有几个II期临床试验已经得出了新辅助化疗后再进行放化疗的结果(表2)。虽然生存数据显得很有前景,但两个比较CRT与新辅助化疗后CRT的随机II期临床试验,未证明能提高病理学缓解率和R0切除率[12]。
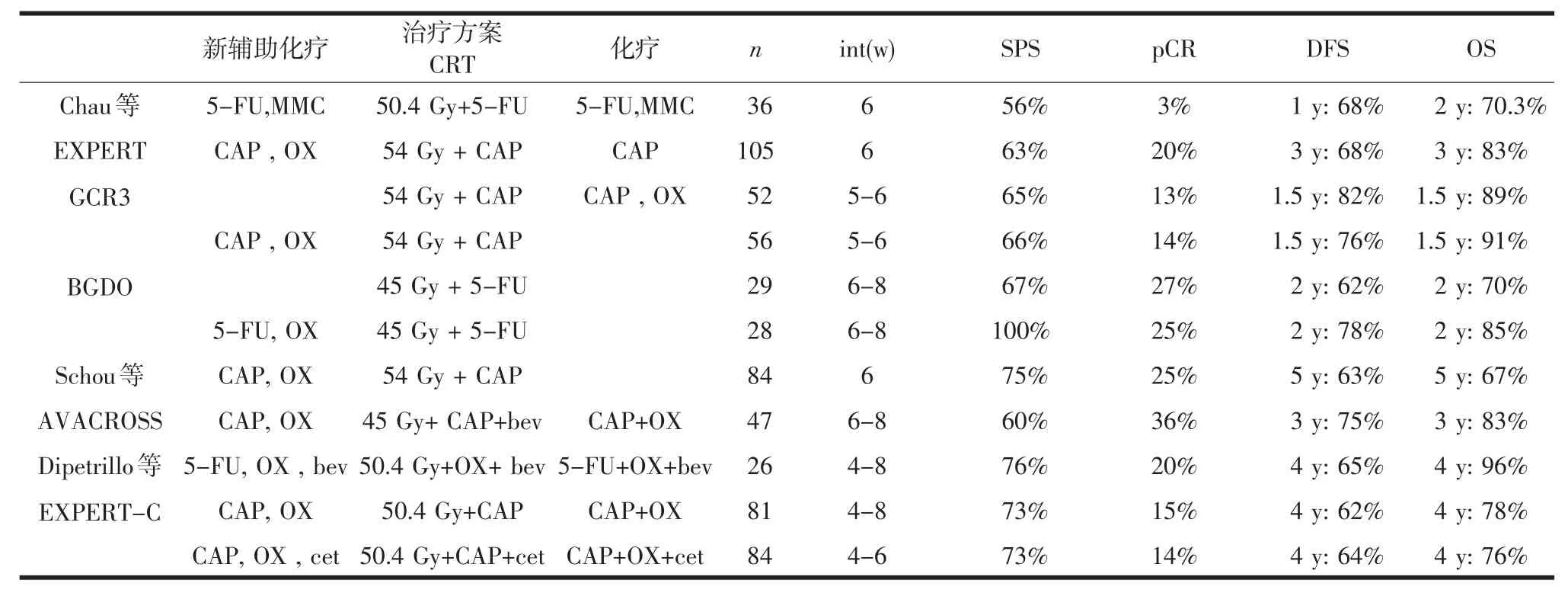
表2 新辅助化疗后放化疗在进展期直肠癌中的表现
另一种方法是,在手术等待期间行“巩固”化疗。Habr-Gama等人得出的初步数据,在直肠癌患者中,先给予54 Gy的RT和5-FU,随后行3个周期的5-FU化疗,临床疗效在CRT完成的10周后评估。14/29(48%)的患者被发现有完整的临床反应,另外有17%进行了局部切除达到T0期。Garcia-Aguilar等[13]在非随机II期临床试验中,将5-FU为主的新辅助CRT和另一种治疗方案(CRT4周后有临床反应的患者中加入两个周期的FOLFOX方案)相对比,发现后者的病理完全缓解(pathological complete remission,pCR)率更高(25%vs 18%)。
目前,还不清楚接受了新辅助化疗联合治疗的患者如何选择辅助化疗。最近一份Meta分析表明,直肠癌根治性切除后,以5-FU为基础的辅助化疗有显著效果:总体生存率(HR=0.83,95%CI:0.76~0.91),无瘤生存率(HR=0.75,95% CI:0.68~0.83)[14]。EORTC 22921试验分析表明,无论是否行术前RT或CRT,辅助化疗显著提高T0~2患者的生存率(但不是T3~4)。
5 放射技术的革新
在过去几年的直肠癌放射生物学中,获得的经验是,至少需要30 Gy的生物有效剂量(biological effective dose,BED)能够降低局部复发率。现代放疗能取得的病理完全缓解率为10%~15%。技术人员正通过努力增加目标组织的放射精确性,以提高放疗的治疗效果。高度适形技术,如调强放射治疗(intensity modulated radiation therapy,IMRT)、调强弧形治疗(intensity modulated arc therapy,IMAT)及断层放疗,通过限制小肠所受的放射剂量使胃肠道毒性显著降低[15]。肠腔内放疗与外照射放疗相结合,可能彻底消除早期(T1N0和T2N0)直肠肿瘤,可明显提高pCR率和保肛率。最近一种新的机器问世了(Papillon 50,阿丽亚娜医疗系统,英国)。一些国际性的试验(接触式内镜下显微手术,CONTEM1-3)最近开始在T1、T2、或早期T3的直肠肿瘤患者中使用接触式RT与肛门显微手术、CRT或标准的TME术式组合,探讨新型放疗技术的疗效[16]。
6 直肠癌局部切除的可行性
放化疗联合局部切除或者甚至不做进一步手术的治疗方案,正在反复审议。不过,要使器官保留的概念得到广泛接受,存在几个主要障碍。首先,极少的直肠腺癌对放射敏感,且临床放疗的病理缓解率往往比离体试验更低。其次,CRT后临床、内镜及影像学分期是极其不可靠的,甚至CRT后的组织活检很难分辨肿瘤和直肠系膜的界限。因此,手术切除对放化疗后有明显临床缓解的患者是不可或缺的方法。在荷兰,一项试验将研究新辅助CRT后对临床分期T1~3N0且距肛缘小于10 cm的患者行经肛门内镜显微手术[17],来自法国的试验(NCT00427375)将把直径4 cm或小于4 cm的直肠癌患者施行新辅助CRT。经过6~8周的等待期,肿瘤降期至2 cm以内的患者将行局部切除或行TME。NCT00738790试验将T1~3N0的患者随机分组到短程RT(5×5 Gy 1周后加强4 Gy)或CRT 6周后局部切除。显然,局部切除战略的调整将取决于我们使用临床、分子和成像生物标志物预测病理缓解程度的能力。基因表达分析最近已成功地用于CRT病理反应的预测。Ghadimi等人利用在德国CAO/ARO/AIO-94试验期间获得的cDNA材料,发现有54个标记基因能够正确的预测83%的患者病理反应。在直肠癌中,应答CRT的几个分子、基因、染色体的生物标志物已经确定,且这些生物标志物越来越多的运用于临床试验设计,期待未来这些标志物可以用于临床[18]。
[1]Galler AS,Petrelli NJ,Shakamuri SP.Rectal cancer surgery:a brief history[J].Surg Oncol,2011,20(4):223-230.
[2]Lemmens V,Steenbergen LV,Janssen-Heijnen M,et al.Trends in colorectal cancer in the south of the Netherlands 1975-2007:rec⁃tal cancer survival levels with colon cancer survival[J].Acta On⁃col,2010,49(6):784-796.
[3]Evans J,Patel U,Brown G.Rectal cancer:primary staging and as⁃sessment after chemoradiotherapy[J].Semin Radiat Oncol,2011, 21(3):169-177.
[4]Koh DM,George C,Temple L,et al.Diagnostic accuracy of nodal enhancement pattern of rectal cancer at MRI enhanced with ul⁃trasmall superparamagnetic iron oxide:findings in pathologically matched mesorectal lymph nodes[J].Am J Roentgenol,2010,194 (6):505-513.
[5]Martin ST,Heneghan HM,Winter DC.Systematic review of out⁃comes after intersphincteric resection for low rectal cancer[J].Br J Surg,2012,99(5):603-612.
[6]Viani GA,Stefano EJ,Soares FV,Afonso SL.Evaluation of biolog⁃ic effective dose and schedule of fractionation for preoperative ra⁃diotherapy for rectal cancer:meta-analyses and meta-regression [J].Int J Radiat Oncol Biol Phys,2011,80(4):985-991.
[7]Van Gijn W,Marijnen CAM,Nagtegaal ID,et al.Preoperative ra⁃diotherapy combined with total mesorectal excision for resectable rectal cancer:12-year follow-up of the multicentre,randomised controlled TME trial[J].Lancet Oncol,2011,12(6):575-582.
[8]Rödel C,Liersch T,Becker H,et al.Preoperative chemoradiothera⁃py and postoperative chemotherapy with fluorouracil andoxaliplatin versus fluorouracil alone in locally advanced rectal cancer:initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial [J].Lancet Oncol,2012,13(7):679-687.
[9]Ngan S,Fisher R,Goldstein D,et al.A randomized trial compar⁃ing local recurrence(LR)rates between short-course(SC)and long-course(LC)preoperative radiotherapy(RT)for clinical T3 rec⁃tal cancer:An intergroup trial(TROG,AGITG,CSSANZ,RACS) [J].ASCO Annual Meeting Proceedings.2010,28(15):3509.
[10]Kim SY,Hong YS,Kim DY,et al.Preoperative chemoradiation with cetuximab,irinotecan,and capecitabine in patients with local⁃ly advanced resectable rectal cancer:a multicenter phase II study [J].Int J Radiat Oncol Biol Phys,2011,81(3):677-683.
[11]Inada R,Nagasaka T,Toshima T,et al.Aggressive Multimodality Treatment for Advanced Rectal Cancer[J].Acta Med Okayama, 2015,69(2):113-118.
[12]Marechal R,Vos B,Polus M,et al.Chemotherapy induction fol⁃lowed by preoperative chemoradiation versus preoperative chemora⁃diation alone in locally advanced rectal cancer(LARC):A random⁃ized controlled phase II study[J].ASCO Annual Meeting Proceed⁃ings,2010,28(15):3637.
[13]Garcia-Aguilar J,Smith DD,Avila K,et al.Optimal timing of sur⁃gery after chemoradiation for advanced rectal cancer:preliminary results of a multicenter,nonrandomized phase II prospective trial [J].Ann Surg,2011,254(1):97-102.
[14]Petersen S H,Harling H,Kirkeby L T,et al.Postoperative adju⁃vant chemotherapy in rectal cancer operated for cure[J].The Co⁃chrane Library,2012,54(3):82-84.
[15]Cilla S,Caravatta L,Picardi V,et al.Volumetric modulated arc therapy with simultaneous integrated boost for locally advanced rec⁃tal cancer[J].Clin Oncol,2012,24(4):261-268.
[16]Myint A S.Renaissance of contact radiotherapy with RT 50 Papil⁃lon machine:a revival of new treatment option for early low rectal cancer[J]?J Clin Oncol,2012,30(15):75-78.
[17]Bokkerink GMJ,de Graaf EJR,Punt CJA,et al.The CARTS study:chemoradiation therapy for rectal cancer in the distal rec⁃tum followed by organ-sparing transanal endoscopic microsurgery [J].BMC Surgery,2011,11,34.
[18]Casado E,García VM,Sánchez JJ,et al.A combined strategy of SAGE and quantitative PCR provides a 13-gene signature that pre⁃dicts preoperative chemoradiotherapy response and outcome in rec⁃tal cancer[J].Clin Cancer Res,2011,17(12):4145-4154.
(收稿:2015-02-10修回:2015-04-26)
(责任编辑马东旺)
R735.3+7
A
1007-6948(2015)04-0422-04
10.3969/j.issn.1007-6948.2015.04.030
三峡大学第一临床医学院;宜昌市中心人民医院胃肠外科(宜昌 443003)
朱耀明,E-mail:5407733@qq.com
