自噬在抵御微生物免疫反应中的功能
2015-12-19闫克芹赵树涛韩代书
王 晴 闫克芹 赵树涛 韩代书
(中国医学科学院基础医学研究所细胞生物学系,北京100005)
1.自噬过程
自噬是细胞清除自身衰老细胞器及大分子复合物的过程,对维持细胞内稳态具有重要意义,并且可通过降解细胞内的成分为细胞提供能量。自噬是一个受到精密调控的动态过程,在启动自噬信号的诱导下,首先形成游离的双层膜结构,称之为自噬泡[1]。自噬泡的膜结构可由内质网、高尔基体、线粒体等细胞器的膜隔离而来。自噬泡通过延伸捕获自噬靶点,形成自噬球。双层膜随着其后的延伸闭合,完全包裹捕获物,称之为自噬体。自噬体与溶酶体融合形成自噬溶酶体,溶酶体中的水解酶降解自噬体内层膜及捕获物[2]。自噬过程可分为起始、延伸、封闭、融合、成熟五个阶段(图1)。整个过程受一系列自噬相关基因(ATG)的严格调控,其中Beclin-1与自噬微管相关蛋白轻链3(LC3)在多个阶段行使调节功能。自噬对于防御微生物的免疫反应具有广泛的调节作用[3]。
自噬起始于隔离的双层膜结构—自噬泡,在自噬调节基因(ATG)16L1,LC3,Beclin-1与丝氨酸/苏氨酸蛋白激酶(ULK1)的作用下,自噬泡的双层膜结构进一步延伸,并捕获靶点,形成自噬球。在LC3,ATG2与ATG9的作用下,自噬球完全封闭,形成自噬体。在Beclin-1的调控下自噬体与溶酶体融合,形成自噬溶酶体。溶酶体中的水解酶降解自 噬体的内膜及自噬靶点,称之为自噬体成熟。
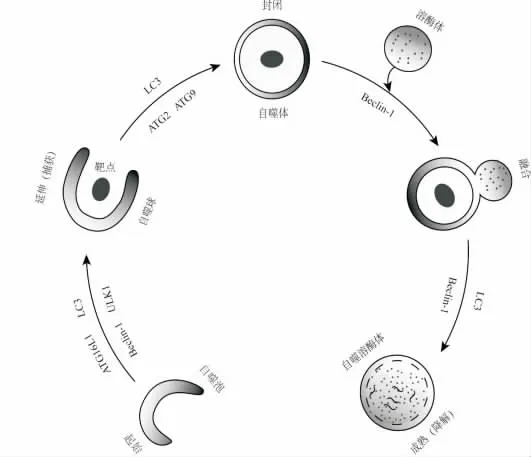
图1 自噬过程。自噬起始于隔离的双层膜结构-自噬泡,在自噬调节基因(ATG)16L1,LC3,Beclin-1与丝氨酸/苏氨酸蛋白激酶(ULK1)的作用下,自噬泡的双层膜结构进一步延伸,并捕获靶点,形成自噬球。在LC3,ATG2与ATG9的作用下,自噬球完全封闭,形成自噬体。在Beclin-1的调控下自噬体与溶酶体融合,形成自噬溶酶体。溶酶体中的水解酶降解自噬体的内膜及自噬靶点,称之为自噬体成熟。Fig.1Autophagic pathway.Autophagy begin with the formation of isolation membrane termed as autophagic vesicle.The vesicle elongates and captures target to form phagophore under control by several autophagy-related genes(ATG),including ATG16L1,microtubule-associated protein light chain 3(LC3),beclin-1and UNC-like kinase 1(ULK1).Further,the phagophore completely closes target to form autophagosome under the regulation by LC3,ATG2and ATG9.Finally,the autophagosome fuses with lysosome to form autolysosome,and the captured target and inner membrane of the autolysosome are degraded.
2.自噬清除微生物
自噬抵御入侵微生物的机制之一是直接将其捕获形成自噬体,与溶酶体融合后将微生物降解清除(图2)。多种机制参与调节这一过程,隔离体样受体(SLR)介导的捕获微生物是一个重要途径。SLR可以识别微生物的分子标志,募集自噬装置将其捕获[4,5]。另一途径是由于入侵的细菌消耗细胞内的营养,而缺乏营养可以促进细胞自噬活性,有利于通过自噬清除细菌。第三种途径是Beclin-1与Toll样受体(TLR)信号通路中的TNF受体相关因子6(TRAF6)相互作用,调节自噬活性。为了启动自噬,细胞首先需要检测微生物是否进入了细胞质,以及所在的位置,模式识别受体(PRR)在识别微生物中行使重要的功能。在感染早期,TLR和NOD样受体(NLR)可以感知微生物的入侵,启动自噬过程[6]。细胞吞噬细菌,也可以诱导自噬[7]。病毒感染后可在复制的不同阶段诱导自噬,有利于清除病毒[8]。自噬机制也参与抵御感染的刚地弓形虫[9]。值得注意的是,一些病毒可抑制自噬或劫持利用自噬,以逃避被清除[10,11],而且自噬在抵御病毒感染中的功能与种属及细胞类型有关[12,13]。
3.天然免疫反应与自噬相互调节
PRR是一类可以识别病原体的模式分子,可被不同微生物的保守分子激活,启动天然免疫反应与调节获得性免疫抵御病原体。PRR可分为几个亚家族,包括 TLR,NLR,RIG-I样受体(RLR),以及DNA受体。PRR可与自噬相互调节,协同抵御微生物感染[14]。
3.1 TLR与自噬
TLR属于跨膜蛋白,定位于细胞膜及内含体膜上,TLR启动的天然免疫反应可以促进自噬。例如,TLR4信号通路中的TRAF6可与Beclin-1相互作用并诱导Beclin-1泛素化,从而激活Beclin-1,增强自噬活性[15]。TRAF6也可以通过泛素化激活ULK1而促进自噬[16]。TLR信号诱导产生的一些细胞因子也参与激活自噬,例如白细胞介素-1β(IL-1β)可诱导巨噬细胞的自噬,并参与清除细胞内的结核分支杆菌[17],而干扰素-γ(IFN-γ)则可促进 T 细胞的自噬,这两种细胞因子均通过激活Beclin-1调节自噬。另外,肿瘤坏死因子α(TNF-α),活性氧簇(ROS)及其氧化酶可以通过诱导自噬增强抗菌作用[18-20]。反过来,自噬也可以促进 TLR启动的天然免疫反应,比较清楚的是自噬体可以将胞质中的病毒核酸运输到内含体,从而激活位于内含体膜上的TLR,诱导I型IFN的产生[21]。IFN是抗病毒反应的重要因子,可以诱导多种抗病毒蛋白的合成,以及促进获得性免疫反应[22]。因此,TLR和自噬可相互调节,协同抵御微生物感染。
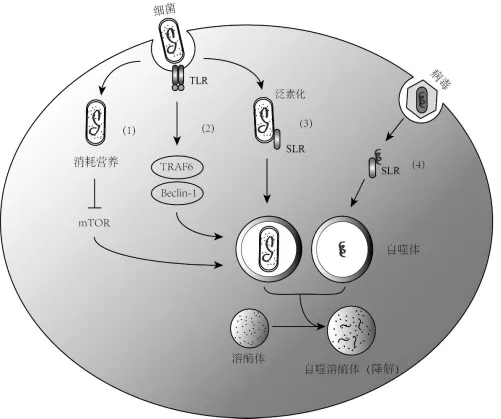
图2 自噬清除微生物。细菌与病毒入侵细胞后可通过多种机制被自噬清除。(1)细菌在细胞内消耗营养,通过抑制雷帕霉素靶蛋白(mTOR)而促进自噬。(2)细菌可激活TLR信号通路,通过TRAF6与Beclin-1相互作用促进自噬活性。(3)入侵的细菌也可以被泛素化后由SLR介导自噬清除。(4)病毒感染细胞后主要是通过SLR途径被自噬体捕获。包裹细菌或病毒的自噬体与溶酶体融合,将微生物降解。Fig.2Role of autophagy in intracellular elimination of invading microbes.Multiple mechanisms are involved in autophagic removal of intracellular bacteria and viruses.(1)Bacterial infection may lead to nutrition exhaustion,which induces autophagy through the inhibition of mTOR.(2)Bacterium can trigger Toll-like receptor(TLR)signaling,which favors autophagy through the interaction of TRAF6and Beclin-1.(3)Bacterium is ubiquitinated within cell and then activates sequestosome1-like receptors(SLR)to promote autophagy.(4)Virus can be captured by autophagosomes through SLR pathway.Microbes in the autophagosomes are degraded after fusion with lysosome
3.2 核酸受体和自噬
识别核酸的PRR主要位于胞浆中,可分为RNA和DNA受体。RLR可以识别病毒双链RNA,包括两个成员:维甲酸诱导基因I(RIG-I)和黑色素瘤分化相关蛋白5(MDA5),RIG-I与 MDA5信号通路可诱导Ⅰ型IFN以及一些炎症因子的产生。与TLR不同,RLR信号通路主要抑制自噬活性[23,24]。但有些 RLR信号通路的下游分子,也可以独立诱导自噬。细胞内存在多种识别DNA的受体,它们通过共同的接头蛋白IFN基因刺激因子(STING)启动天然免疫反应。STING可直接与Beclin-1相互作用,促进自噬[25]。例如Ⅰ型单纯疱疹病毒(HSV-1)或人类巨细胞病毒,均可通过STING诱导自噬[26]。不同PRR可以在感染的不同阶段识别微生物的保守分子,在不同环节促进自噬活性,更有效清除入侵的微生物。然而,在某些情况下,自噬可通过抑制RLR信号通路来阻止I型IFN的产生,从而有利于病毒复制,这也是为什么有时自噬有利于病毒感染[23,24]。目前对于自噬与病毒感染的关系认识的不多,有待深入研究。
3.3 SLR在自噬清除微生物中的功能
除了PRR信号可诱导自噬,SLR是介导自噬捕获病原体的一个重要机制。微生物进入细胞后可被细胞内的泛素化系统识别,从而被泛素化[27]。SLR可识别泛素化的微生物,并与LC3相互作用介导自噬捕获清除微生物[5,27]。
目前对微生物感染如何激活自噬有了更多认识,几乎所有PRR都可调节自噬。免疫调节因子也能促进自噬清除微生物,因此,在细胞内存在着多种自噬调节系统。哪些机制起主要作用具有细胞特异性,例如,神经元主要依赖自噬抵御HSV-1的感染,而不是PRR启动的天然免疫[28]。相反,阴道粘膜细胞抵御 HSV-1感染主要是PRR介导产生的IFN[13]。自噬在不同细胞抵御微生物中的功能是重要的研究方向。
4.自噬与炎症反应
自噬活性与一些慢性炎症疾病有关,自噬在炎症疾病中的作用最初是通过全基因组扫描发现的。ATG16L1或 ULK1突变与慢性肠炎有关[29,30],而系统性红斑狼疮及哮喘与ATG5的突变相关[29,31],ATG突变与慢性炎症疾病的关联表明自噬调节炎症反应。自噬调节I型IFN的合成是其机制之一,自噬可将微生物的核酸转移到内含体中,激活位于内含体膜上的TLR,从而促进IFN的产生。然而,过度激活TLR信号通路可引起持续的炎症反应,从而导致自身免疫疾病。已发现自噬能够促使TLR9识别自身DNA,诱导B细胞对自身DNA的免疫反应[32]。自噬也能够促进天然免疫细胞对自身DNA的免疫反应,产生过量的IFN[33]。值得关注的是,一些ATG可以抑制IFN的产生,ATG5-ATG12复合体能够直接与RIG-I及其接头分子IFN产生刺激因子1(IPS-1)结合,抑制RLR信号通路[24]。ATG9可抑制 DNA 受体的接头分子STING的转运,从而抑制抗病毒信号通路[34],这种抑制干扰素产生的机制有利于某些病毒在细胞中的复制。
自噬调节炎症的另一机制是通过炎症小体。炎症小体是细胞内含有NLR的蛋白复合体,可被NLR的配体激活,进而活化蛋白水解酶caspase-1,活化的caspase-1可以切割IL-1和IL-18前体,使其转化为活性形式。ATG16L1敲除小鼠产生大量IL-1和IL-18,表明自噬可能抑制炎症小体的活性[35]。在生理状态下,自噬可清除内源性炎症小体的配体,如蛋白聚集物和损伤的细胞器,从而抑制炎症小体的活化,减少炎症因子分泌[36,37]。在受到感染时,病原体可通过NLR激活ULK1,促进自噬清除受损的线粒体,从而抑制其激活炎症小体[38]。自噬也能通过清除炎症小体自身的成份,抑制其活性[39]。自噬对炎症小体的抑制作用可避免过度有害的内源性炎症反应。
5.自噬调节获得性免疫
5.1 自噬与抗原递呈
获得性免疫反应是指病原体的特异抗原,经抗原递呈细胞(主要为树突细胞与巨噬细胞)加工后,将抗原递呈给效应T淋巴细胞,启动抗原特异的免疫反应。自噬有助于加工与抗原递呈[40],抗原与LC3融合后可促进 MHC-Ⅱ将其递呈给CD4+细胞[41]。自噬介导的抗原递呈可以调节胸腺中幼稚T细胞的选择,自噬缺陷不能有效清除自身反应CD4+细胞,从而引发自身免疫性肠炎[42]。自噬与蛋白酶体可直接降解抗原成分,调节抗原递呈[43]。自噬也可以调节MHC-Ⅰ抗原递呈通路[44]。
5.2 自噬调节淋巴细胞分化与功能
除了在抗原递呈中的作用,自噬可以调节T细胞的活化与功能[45]。自噬清除线粒体有利于维持造血干细胞的多能性,是产生淋巴细胞的基础[46]。到达胸腺之后,T细胞的成熟也需要通过自噬减少线粒体数量[47]。另外,自噬可以抑制Fas/FasL介导的T细胞凋亡,有利于T细胞存活。而且,自噬能够通过调节天然免疫细胞表达炎症因子,来影响T细胞的分化。自噬缺陷的巨噬细胞过度分泌IL-1,可刺激T细胞的免疫反应[8]。在体液免疫中,浆细胞的分化及抗体产生与自噬有关[48,49]。另外,自噬有利于维持浆细胞中内质网的平衡,自噬缺陷会导致免疫球蛋白的过度分泌[50]。因此,自噬对浆细胞的分化与功能具有调节作用,有利于长时间维持体液免疫。
尽管已认识到自噬通过影响抗原递呈、T细胞亚群选择、浆细胞功能,调节获得性免疫,但详细的机制认识的较少,有待深入研究。对这些问题的深入研究将进一步揭示自噬基因突变相关免疫疾病的机理,并为其治疗提供新线索。
结语
自噬的发现是生命科学的又一个里程碑。自噬在抵御微生物感染中行使重要功能,可直接清除病原体,也可通过调节天然和获得性免疫反应抵御微生物感染。另一方面,PRR启动的天然免疫反应对自噬活性具有调节功能,因此自噬与天然免疫反应相互调节,共同组成了机体抵御微生物感染的第一道防线。免疫反应与自噬间的相互调节机制,仍有很多重要的问题尚待解决,例如,为什么自噬在多数情况下与IFN的抗病毒作用不能协同?这是一个值得深入研究的方向。另外,自噬对炎症因子分泌的调节是一个重要的研究领域,有可能进一步揭示自噬与炎症疾病的关系。自噬对获得性免疫的调节作用,特别是在淋巴细胞亚群分化中的作用,有待深入研究。自噬和免疫间的相互调节将是未来几年的重要研究领域,对其机制的深入认识将促进向临床的转化。自噬已经成为研发新的治疗慢性炎症与自身免疫性疾病的重要靶点,并最终会应用于抵抗炎症反应的治疗中。
[1]Mizushima N,Yoshimori T,Ohsumi Y.The role of Atg proteins in autophagosome formation.Annu Rev Cell Dev Biol,2011,27:107-132
[2]Itakura E,Kishi-Itakura C,Mizushima N.The hairpintype tail-anchored SNARE syntaxin 17targets to autophagosomes for fusion with endosomes/lysosomes.Cell,2012,151(6):1256-1269
[3]Gomes LC,Dikic I.Autophagy in antimicrobial immunity.Mol Cell,2014,54(2):224-233
[4]Wild P,Farhan H,McEwan DG,et al.Phosphorylation of the autophagy receptor optineurin restricts Salmonella growth.Science,2011,333(6039):228-233
[5]Thurston TL,Wandel MP,von Muhlinen N,et al.Galectin 8targets damaged vesicles for autophagy to defend cells against bacterial invasion.Nature,2012,482(7385):414-418
[6]Travassos LH,Carneiro LA,Ramjeet M,et al.Nod1 and Nod2direct autophagy by recruiting ATG16L1to the plasma membrane at the site of bacterial entry.Nat Immunol,2010,11(1):55-62
[7]Sanjuan MA,Dillon CP,Tait SW,et al.Toll-like receptor signalling in macrophages links the autophagy pathway to phagocytosis.Nature,2007,450(7173):1253-1257
[8]Orvedahl A,MacPherson S,Sumpter R,Jr.,et al.Autophagy protects against Sindbis virus infection of the central nervous system.Cell Host Microbe,2010,7(2):115-127
[9]Choi J,Park S,Biering SB,et al.The parasitophorous vacuole membrane of Toxoplasma gondii is targeted for disruption by ubiquitin-like conjugation systems of autophagy.Immunity,2014,40(6):924-935
[10]Beale R,Wise H,Stuart A,et al.A LC3-interacting motif in the influenza A virus M2protein is required to subvert autophagy and maintain virion stability.Cell Host Microbe,2014,15(2):239-247
[11]Blanchet FP,Moris A,Nikolic DS,et al.Human immunodeficiency virus-1inhibition of immunoamphisomes in dendritic cells impairs early innate and adaptive immune responses.Immunity,2010,32(5):654-669
[12]Judith D,Mostowy S,Bourai M,et al.Species-specific impact of the autophagy machinery on Chikungunya virus infection.EMBO Rep,2013,14(6):534-544
[13]Yordy B,Iwasaki A.Cell type-dependent requirement of autophagy in HSV-1antiviral defense.Autophagy,2013,9(2):236-238
[14]Munz C.Regulation of innate immunity by the molecular machinery of macroautophagy.Cell Microbiol,2014,16(11):1627-1636
[15]Shi CS,Kehrl JH.TRAF6and A20regulate lysine 63-linked ubiquitination of Beclin-1to control TLR4-induced autophagy.Sci Signal,2010,3(123):2000751
[16]Nazio F,Strappazzon F,Antonioli M,et al.mTOR inhibits autophagy by controlling ULK1ubiquitylation,self-association and function through AMBRA1and TRAF6.Nat Cell Biol,2013,15(4):406-416
[17]Pilli M,Arko-Mensah J,Ponpuak M,et al.TBK-1 promotes autophagy-mediated antimicrobial defense by controlling autophagosome maturation.Immunity,2012,37(2):223-234
[18]Scherz-Shouval R,Shvets E,Fass E,et al.Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4.Embo J,2007,26(7):1749-1760
[19]Yang CS,Lee JS,Rodgers M,et al.Autophagy protein Rubicon mediates phagocytic NADPH oxidase activation in response to microbial infection or TLR stimulation.Cell Host Microbe,2012,11(3):264-276
[20]Mostowy S,Sancho-Shimizu V,Hamon MA,et al.p62and NDP52proteins target intracytosolic Shigella and Listeria to different autophagy pathways.J Biol Chem,2011,286(30):26987-26995
[21]Lee HK,Lund JM,Ramanathan B,et al.Autophagydependent viral recognition by plasmacytoid dendritic cells.Science,2007,315(5817):1398-1401
[22]Sadler AJ,Williams BR.Interferon-inducible antiviral effectors.Nat Rev Immunol,2008,8(7):559-568
[23]Lei Y,Wen H,Yu Y,et al.The mitochondrial proteins NLRX1and TUFM form a complex that regulates type I interferon and autophagy.Immunity,2012,36(6):933-946
[24]Jounai N,Takeshita F,Kobiyama K,et al.The Atg5 Atg12conjugate associates with innate antiviral immune responses.Proc Natl Acad Sci U S A,2007,104(35):14050-14055
[25]Liang Q,Seo GJ,Choi YJ,et al.Crosstalk between the cGAS DNA sensor and Beclin-1autophagy protein shapes innate antimicrobial immune responses.Cell Host Microbe,2014,15(2):228-238
[26]McFarlane S,Aitken J,Sutherland JS,et al.Early induction of autophagy in human fibroblasts after infection with human cytomegalovirus or herpes simplex vi-rus 1.J Virol,2011,85(9):4212-4221
[27]Thurston TL,Ryzhakov G,Bloor S,et al.The TBK1 adaptor and autophagy receptor NDP52restricts the proliferation of ubiquitin-coated bacteria.Nat Immunol,2009,10(11):1215-1221
[28]Yordy B,Iijima N,Huttner A,et al.A neuron-specific role for autophagy in antiviral defense against herpes simplex virus.Cell Host Microbe,2012,12(3):334-345
[29]Genome-wide association study of 14,000cases of seven common diseases and 3,000shared controls.Nature,2007,447(7145):661-678
[30]Henckaerts L,Cleynen I,Brinar M,et al.Genetic variation in the autophagy gene ULK1and risk of Crohn's disease.Inflamm Bowel Dis,2011,17(6):1392-1397
[31]Martin LJ,Gupta J,Jyothula SS,et al.Functional variant in the autophagy-related 5gene promotor is associated with childhood asthma.PLoS One,2012,7(4):20
[32]Chaturvedi A,Dorward D,Pierce SK.The B cell receptor governs the subcellular location of Toll-like receptor 9leading to hyperresponses to DNA-containing antigens.Immunity,2008,28(6):799-809
[33]Henault J,Martinez J,Riggs JM,et al.Noncanonical autophagy is required for type I interferon secretion in response to DNA-immune complexes. Immunity,2012,37(6):986-997
[34]Saitoh T,Fujita N,Hayashi T,et al.Atg9acontrols dsDNA-driven dynamic translocation of STING and the innate immune response.Proc Natl Acad Sci U S A,2009,106(49):20842-20846
[35]Saitoh T,Fujita N,Jang MH,et al.Loss of the autophagy protein Atg16L1enhances endotoxin-induced IL-1beta production.Nature,2008,456(7219):264-268
[36]Zhou R,Yazdi AS,Menu P,et al.A role for mitochondria in NLRP3inflammasome activation.Nature,2011,469(7329):221-225
[37]Nakahira K,Haspel JA,Rathinam VA,et al.Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3inflammasome.Nat Immunol,2011,12(3):222-230
[38]Lupfer C,Thomas PG,Anand PK,et al.Receptor interacting protein kinase 2-mediated mitophagy regulates inflammasome activation during virus infection.Nat Immunol,2013,14(5):480-488
[39]Shi CS,Shenderov K,Huang NN,et al.Activation of autophagy by inflammatory signals limits IL-1beta production by targeting ubiquitinated inflammasomes for destruction.Nat Immunol,2012,13(3):255-263
[40]Paludan C,Schmid D,Landthaler M,et al.Endogenous MHC class II processing of a viral nuclear antigen after autophagy.Science,2005,307(5709):593-596
[41]Schmid D,Pypaert M,Munz C.Antigen-loading compartments for major histocompatibility complex class II molecules continuously receive input from autophagosomes.Immunity,2007,26(1):79-92
[42]Nedjic J,Aichinger M,Emmerich J,et al.Autophagy in thymic epithelium shapes the T-cell repertoire and is essential for tolerance.Nature,2008,455(7211):396-400
[43]Wenger T,Terawaki S,Camosseto V,et al.Autophagy inhibition promotes defective neosynthesized proteins storage in ALIS,and induces redirection toward proteasome processing and MHCI-restricted presentation.Autophagy,2012,8(3):350-363
[44]Fiegl D,Kagebein D,Liebler-Tenorio EM,et al.Amphisomal route of MHC class I cross-presentation in bacteria-infected dendritic cells.J Immunol,2013,190(6):2791-2806
[45]Puleston DJ,Simon AK.Autophagy in the immune system.Immunology,2014,141(1):1-8
[46]Mortensen M,Soilleux EJ,Djordjevic G,et al.The autophagy protein Atg7is essential for hematopoietic stem cell maintenance.J Exp Med,2011,208(3):455-467
[47]Pua HH,Guo J,Komatsu M,et al.Autophagy is essential for mitochondrial clearance in mature T lymphocytes.J Immunol,2009,182(7):4046-4055
[48]Cenci S.Autophagy,a new determinant of plasma cell differentiation and antibody responses.Mol Immunol,2014,62(2):289-295
[49]Arsov I,Adebayo A,Kucerova-Levisohn M,et al.A role for autophagic protein beclin 1early in lymphocyte development.J Immunol,2011,186(4):2201-2209
[50]Pengo N,Scolari M,Oliva L,et al.Plasma cells require autophagy for sustainable immunoglobulin production.Nat Immunol,2013,14(3):298-305
