重组腺病毒Ad-PTEN-EGFP对肺癌细胞A549的体外实验研究
2015-12-19陈志雄马红梅
黄 琼 陈志雄 陶 琳 马红梅
(1武汉大学人民医院眼科;2武汉大学人民医院老年病科湖北430060)
肺癌是一种恶性肿瘤疾病,它严重影响着人类健康。多种肿瘤抑制基因缺失的现象常出现在癌组织中。PTEN基因是一个抑癌基因,它既是第一个被研究人员发现的具有磷酸酶活性的抑癌基因,又是唯一的具有磷酸酶活性的抑癌基因。研究发现PTEN具有双专一性的磷酸酶活性,PIP3/PKB信号传导可以被它所具有的PIP3磷酸酶活性所抑制,进而促进细胞发生凋亡,或者使细胞生长停滞在Gl期[1-4]。此外PTEN基因还通过其与张力蛋白同源的序列,参与细胞之间的信号转导,还参与了细胞骨架的重组[5,6]。
为研究PTEN基因,我们成功构建了重组腺病毒 Ad-PTEN-EGFP。重组腺病毒 Ad-PTEN-EGFP既携带了PTEN基因,又有绿色荧光表达基因存在,这样有利于我们对PTEN基因进行体内及体外的实验。本实验选择了肺腺癌细胞株A549,对重组腺病毒Ad-PTEN-EGFP对肺癌细胞作用进行研究,为进一步体内的实验研究提供理论依据。
材料和方法
1.实验材料
1.1 细胞株人肺腺癌细胞株A549,购自武汉大学医学院肿瘤研究所。
1.2 重组腺病毒 Ad-PTEN-EGFP
为携带PTEN基因及含EGFP绿色荧光表达基因的重组腺病毒,第一部分方法制备,滴度为1.0×109pfu/ml。
2.主要试剂
DMEM、RPMI1640、胎牛血清均购自GIBCO公司;兔抗人PTEN多克隆抗体及羊抗兔HRP标记IgG均购自武汉博士德公司;Tripure提取液购自武汉康博生物技术公司;RT-PCR试剂盒购自武汉亚法生物技术有限公司;PTEN引物由上海英骏生物技术有限公司合成。
3.实验方法
3.1 A549细胞的培养
均用 Hanks'或0.02%EDTA;均冲洗两次,加入一定量的消化液(0.25%胰酶+0.02%EDTA),在显微镜下进行观察,待细胞形态大部分变成圆形时,吸去废弃的消化溶液,加入一定量的新培养液,反复吹打A549细胞,直到细胞全部悬浮起来,然后加入新的培养液进行分瓶予以培养。注意每日在显微镜下观察A549细胞在培养瓶中的生长状态。
3.2 重组腺病毒感染A549细胞后镜下观察
由于腺病毒对不同细胞株的感染效率存在差异,且考虑到病毒颗粒的细胞毒副作用,通常通过梯度感染的方法确定所需的病毒用量。以相对细胞数1∶1,10∶1,100∶1,1000∶1的病毒颗粒感染靶细胞;加入相对培养液体积1∶1000的Polybrene。在37℃温度下平板离心30min;感染8-12h后换液。将含有病毒的培养液小心移入含有消毒液的废液缸中,加入适量全培液。同时需统计被重组腺病毒Ad-PTEN-EGFP感染的肺癌细胞A549占总细胞数的百分比。
3.3 RT-PCR检测PTEN mRNA表达
将同等剂量的重组腺病毒Ad-PTEN-EGFP以及对照组:腺病毒Ad-EGFP分别感染人肺癌A549细胞(1×106/ml)成功后,提取各组RNA。
(1)每1ml Trizol中溶1×106人肺癌A549细胞,然后加入0.2ml氯仿。盖紧样品管盖,用手用力摇晃试管15s,使其充分混匀,室温静置5min后12000rmp离心15min。(2)RNA 的沉淀;(3)RNA的洗脱小心倒掉上清,留取沉淀。加1ml现配的75%的乙醇(预冷)振荡洗涤RNA沉淀一次然后7500rmp离心5min。(4)RNA的再溶解;(5)RNA的保存;(6)cDNA 的合成;(7)引物设计:参照相关文献引物设计,由上海英骏生物技术有限公司合成PTEN引物:
PTEN引物1)PTEN基因的上游引物
P3 5'-CCGGAATTCACCATGACAGCCATC-3'
2)PTEN基因的下游引物
P4 5'-GCGTCGACTTATCAGACTTTTGTA -3'
(8)RT-PCR参照TaKaRa试剂盒说明:
反应体系如下:

l dNTPs 10mmol/L 0.5μl p3 25μmol/L 0.5μl p4 10μmol/L 0.5μl Taq polymerase 1μ/μl 0.5μl cDNA - 2μl ddH2O - 18.5μl总体系 25μ成分 浓度 体积PCR buffer 10× 2.5μ l
4.Western blot方法鉴定三组 A549细胞中PTEN蛋白的表达
设置三组:A 组,重组腺病毒 Ad-PTEN-EGFP;B组,感染Ad-EGFP;C组,加入PBS溶液。感染48h后,收集3组细胞,进行 Western blot方法鉴定PTEN蛋白的表达情况。
5.统计学处理
采用SPSS13.0统计软件进行分析处理,实验数值均以均数±标准差表示,两组间均数比较用t检验,多组间均数比较用方差分析,P<0.05为有显著性差异。
结 果
1.重组腺病毒Ad-PTEN-EGFP对肺癌细胞A549的体外感染后细胞的形态
倒置显微镜下观察,经重组腺病毒Ad-PTENEGFP感染48h后,发现部分A549细胞的贴壁能力开始减弱,细胞形态开始变圆,体积缩小,出现核固缩现象。Ad-EGFP组及PBS组细胞生长正常,经重组腺病毒 Ad-PTEN-EGFP和 Ad-EGFP感染24h后,均可发现细胞有绿色荧光表达。转染效率均在50%以上(图1-4)。
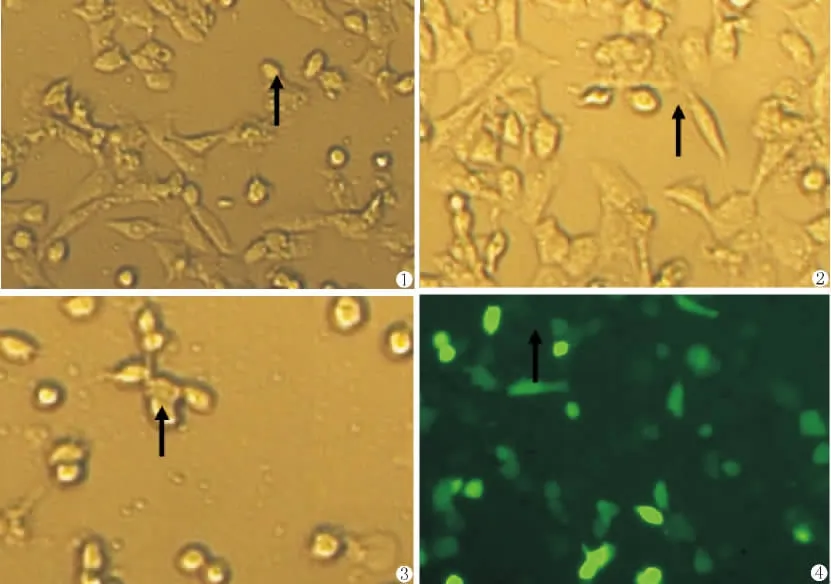
图1 A549细胞(48h,倒置显微镜下观察)图2 Ad-EGFP感染A549细胞(48h,倒置显微镜下观察)图3 Ad-PTEN-EGFP感染A549细胞(48h,倒置显微镜下观察)图4 Ad-PTEN-EGFP感染A549细胞(24h,荧光显微镜下观察)Fig.1A549cell(48h,under inverted microscope observe)Fig.2Ad-EGFP infection A549cell(48h,under inverted microscope observe)Fig.3Ad-PTEN-EGFP infection A549cell(48h,under inverted microscope observe)Fig.4Ad-PTEN-EGFP infection A549cell(24h,under the fluorescence microscope observe)
2.RT-PCR方法检测PTENmRNA在A549细胞中的转录
为了检测将重组腺病毒转入肺癌A549细胞后,RT-PCR 法检测可发现 Ad-PTEN-EGFP组有1236bp左右的条带出现(图5),而对照组Ad-EGFP组细胞无条带出现。

图5 RT-PCR方法检测PTEN mRNA在A549细胞中的转录,左侧泳道为1000bp DNA Marker,中间泳道为感染重组腺病毒Ad-PTEN-EGFP的A549细胞,右侧泳道为对照组Ad-EGFP细胞。Fig.5PTEN mRNA was detectied in transcription of A549cells by RT-PCR method,on the left side of the lane was 1000bp DNA Marker,the middle lane for infection of recombinant adenovirus Ad-PTEN-EGFP A549cells,on the right side as control group for Ad- EGFP cell lane.
3.Western blot方法检测PTEN蛋白在A549细胞中的表达
Western blot方法检测可发现 Ad-PTEN-EGFP组SDS-PAGE中有55kDa条带产生,符合PTEN蛋白的表现,而其他两组均无此特异性条带产生(图6)。
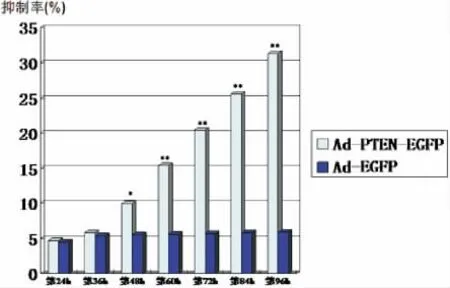
图6 Western blot方法检测各组PTEN蛋白的表达Fig.6Western blot method to detect each group the expression of PTEN protein
4.重组腺病毒Ad-PTEN-EGFP抑制肺癌细胞A549细胞的增殖检测
应用MTT法检测重组腺病毒Ad-PTEN-EGFP转染A549细胞后对其生长的影响。MTT检测结果显示:以 MOI=100转染不同时间(24、36、48、60、72、84、96h),Ad-PTEN-EGFP能够明显抑制A549的增殖速度(P<0.05或P<0.01),而 Ad-EGFP组则无明显抑制作用(图7)。
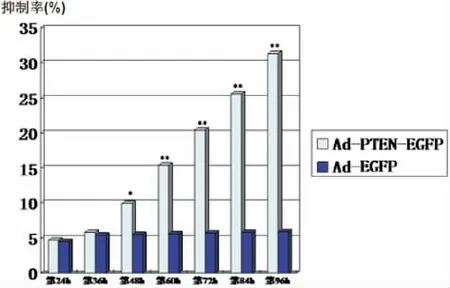
注:Ad-PTEN-EGFP 组 与 PBS 组 和 Ad-EGFP 组 比较,*P<0.05,**P<0.01图7 重组腺病毒Ad-PTEN-EGFP不同时间点转染A549细胞后对其生长的影响Fig.7Recombinant adenovirus Ad-PTEN-EGFP different time points after transfection A549cells to its growth influence
5.流式细胞仪分析重组腺病毒Ad-PTEN-EGFP转染对A549细胞凋亡率的影响
Ad-PTEN-EGFP、Ad-EGFP、PBS 三 组 对 A549肺癌细胞的凋亡率分别为(17.9±2.4)%、(2.8±0.8)%和(2.6±0.6)%。Ad-PTEN-EGFP组凋亡率明显高于其他两组(P<0.05)(图8A,B,C)。
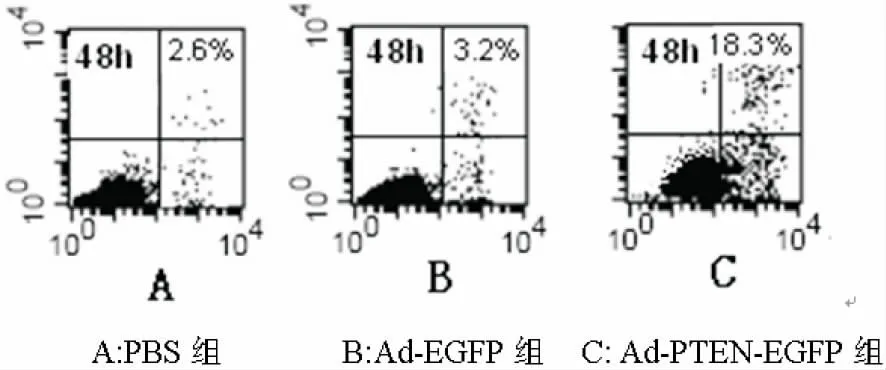
图8 流式细胞仪检测转染后细胞凋亡的情况Fig.8Flow cytometry to detect cell apoptosis after transfection
讨 论
自1997年来,先后在美国三个实验室里,研究人员发现了一个肿瘤抑制基因,分别被命名为PTEN,TEP1和MMAC1,此基因定位于人类基因组的10q23[7]。在对人类大多数的肿瘤组织检测中,研究人员都发现PTEN基因出现失活的现象[8]。研究表明,离体肿瘤细胞的活动度可以被野生型PTEN基因明显的抑制,将外源性PTEN基因转染到细胞内,引起该基因的过度表达,这样可以使胶质母细胞瘤细胞系的增殖受到抑制[9]。近几年来,基因治疗恶性肿瘤已经成为研究人员的研究热点。在基因治疗过程中,影响基因治疗疗效的关键有二点[10-12]:①合适的目的基因;②选择基因高效的转移载体。腺病毒感染宿主细胞的种类比较广泛,它既可以使分裂期的细胞受到感染,又可以使非分裂期的细胞同样受到感染,高滴度的病毒容易被制备出来此外,大片段的外源性基因可以插腺病毒基因中,而在受染细胞内,腺病毒基因不和宿主的基因序列发生整合现象,因此腺病毒不具有致癌以及致突变等危险[13]。对于呼吸道上皮而言,腺病毒有天然的亲嗜性,具有器官和组织的特异性,因此将腺病毒运用于肺癌的基因治疗是非常合适的[14-16]。
为了研究PTEN基因的功能,我们成功构建了含有PTEN基因和绿色荧光表达的EGFP基因的重组腺病毒载体。通过多种实验方法(RT-PCR,Western blot等)证实:转染肺癌A549细胞后,重组腺病毒Ad-PTEN-EGFP在该细胞中能够正确转录,蛋白表达。Ad-PTEN-EGFP,Ad-EGFP及PBS对照组分别感染A549细胞,倒置显微镜下,48h内观察各组细胞生长情况,我们发现,Ad-PTEN-EGFP组细胞的贴壁能力明显开始减弱,细胞形态从狭长状态逐渐开始变圆滑,而细胞体积则变得较小,有些细胞甚至出现核固缩的异常现象。而Ad-EGFP组及PBS组细胞生长正常,从显微的观察我们可以认为Ad-PTEN-EGFP具有一定影响细胞生长的作用。实验中,在感染重组腺病毒Ad-PTEN-EGFP的细胞中可检测到PTEN蛋白和基因的表达,上述结果证明已构建成功的重组腺病毒能成功表达PTEN。
有研究证实:PTEN mRNA以及PTEN蛋白的缺失表达,主要在肿瘤的进展期发生,这种现象与肿瘤的恶性程度、转移等现象有着密切的联系[17-19]。MTT法可用来检测重组腺病毒对细胞的增殖抑制情况。本实验发现:Ad-PTEN-EGFP 转染肺癌A549细胞后,较对照组重组腺病毒具有显著的抑制细胞增殖的作用(P<0.05),且抑制增殖的作用与转染的时间呈现正相关关系。
PTEN基因主要依靠MAPK途径和PIP3途径发挥生理作用,在MAPK途经中,PTEN基因能明显抑制MAPK途径上游ERK、RAS的活化和Shc的磷酸化过程,进而对细胞外信号调节激酶(ERK)/丝裂原激活的蛋白激酶(MAPK)信号途径起着负调节的作用,并且PTEN基因还能抑制MAPK激酶的磷酸化过程,阻滞细胞周期,使之处于细胞周期的G1期,抑制肿瘤细胞的生长过程[20-22]。PTEN 在 PIP3途径中则起到对抗 PI3K的生理作用,从而使得PIP3去磷酸化,阻止PI3K调控的信号转导通路,进而降低PIP3的表达水平,同样使得细胞停止在细胞周期的G1期,从而诱导和促进肿瘤细胞的凋亡。
通过流式细胞仪对重组腺病毒Ad-PTEN-EGFP的细胞凋亡率进行检测和分析。本实验结果显示,重组腺病毒转染A549细胞后,细胞凋亡率明显增加,而Ad-EGFP组及PBS组凋亡率则较低,两者有明显的差异 (P<0.05)。PTEN的这种诱导细胞发生凋亡的具体机制尚不清楚。
综上所述,通过体外实验,证实重组腺病毒Ad-PTEN-EGFP能改变肺癌A549细胞的细胞形态,转录并且有效的表达PTEN基因和蛋白,具有诱导和促进A549细胞发生凋亡的作用。
[1]DavisNM,Sokolosky M,Stadelman K,et al.Deregulation of the EGFR/PI3K/PTEN/Akt/mTORC1pathway in breast cancer:possibilities for therapeutic intervention.Oncotarget,2014,5(13):4603-4650
[2]Nakanishi A,Kitagishi Y,Ogura Y,et al.The tumor suppressor PTEN interacts with p53in hereditary cancer(Review).Int J Oncol,2014,44(6):1813-1819
[3]Hopkins BD,Hodakoski C,Barrows D,et al.PTEN function:the long and the short of it.Trends Biochem Sci,2014,39(4):183-190
[4]Xu WT,Yang Z,Lu NH.et al.Roles of PTEN (Phosphatase and Tensin Homolog)in gastric cancer development and progression.Asian Pac J Cancer Prev,2014,15(1):17-24
[5]Molinari F,Frattini M.Functions and Regulation of the PTEN Gene in Colorectal Cancer.Front Oncol,2014,3:326
[6]Thunnissen E,van der Oord K,den Bakker M.et al.Prognostic and predictive biomarkers in lung cancer.A review.Virchows Arch,2014,464(3):347-358
[7]Li J,C Yen,D Liaw,et al.PTEN,aputative protein tyrosine phosphatasegene mutated in human brain,breast,and prostate cancer.Science,1997,275:1943-1947
[8]Rasheed,B.K.A.,T.T.Stenzel,et al.PTEN gene mutations are seen in high-grade but not in low-grade gliomas.Cancer Res,1997,57:4187-4190
[9]Maehama T,Dixon JE.The tumor suppressor,PTEN/MMAC1,dephosphorylates the lipid second messenger,phosphatidylinositol 3,4,5trisphosphate.Biol Chem,1998,273:13375-13378
[10]Dillon LM,Miller TW.Therapeutic targeting of cancers with loss of PTEN function.Curr Drug Targets,2014,15(1):65-79
[11]De Melo J,He L,Tang D.et al.The protein-protein interaction-mediated inactivation of PTEN.Curr Mol Med,2014,14(1):22-33
[12]Cooper WA,Lam DC,O'Toole SA,Minna JD.Molecular biology of lung cancer.J Thorac Dis,2013,5(Suppl 5):S479-490
[13]Ortega-Molina A,Serrano M.PTEN in cancer,metabolism,and aging.Trends EndocrinolMetab,2013,24(4):184-189
[14]Conde-Perez A,Larue L.PTEN and melanomagenesis.Future Oncol,2012,8(9):1109-1120
[15]Chetram MA,Hinton CV.PTEN regulation of ERK1/2signaling in cancer.J Recept Signal Transduct Res,2012,32(4):190-5
[16]Furnari FB,Lin H,Cavence WK.Growth suppression of glioma cells by PTEN requires a functional phosphatase catalytic domain.Proc Natl Acad Sci.U S A,1997,94:12479-12484
[17]Suda K,Mizuuchi H,Maehara Y,Mitsudomi T.Acquired resistance mechanisms to tyrosine kinase inhibitors in lung cancer with activating epidermal growth factor receptor mutation--diversity,ductility,and destiny.Cancer Metastasis Rev,2012,31(3-4):807-814
[18]Song MS,Salmena L,Pandolfi PP.The functions and regulation of the PTEN tumour suppressor.Nat Rev Mol Cell Biol,2012,13(5):283-96
[19]Ming M,He YY.PTEN in DNA damage repair.Cancer Lett,2012,319(2):125-129
