pCDNA3.1-HEGF真核表达质粒转染牙髓干细胞的研究
2015-12-19胡红梅曾常爱廖家万
胡红梅 曾常爱 廖家万 李 伟*
(1井冈山大学医学院组胚教研室;2井冈山大学临床医学院口腔系,江西吉安,343000)
基因工程重组技术是生物工程的一个重要分支,可以将目的基因通过体外重组后导入受体细胞内,使这个目的基因能在受体细胞内复制、转录、翻译表达,其中将目的基因转移至受体细胞的能自我复制的载体影响着基因工程的研究进程[1]。pCDNA3.1+是一种真核表达载体,在哺乳动物表达载体能使重组质粒获得高水平表达的重组蛋白,目前用pCDNA3.1结合各种基因构建质粒转染神经干细胞、骨髓基质干细胞和软骨细胞的研究都取得成功,对各种干细胞的增值和分化都取得较好的作用[2]。本次实验用成功构建的pCDNA3.1-HEGF真核表达质粒转染牙髓干细胞,并通过Q-PCR和Western blot检测hEGF基因及蛋白的表达,为下一步的牙髓干细胞的增殖和分化取得前期的实验基础。
材料和方法
1.主要试剂与主要仪器
倒置显微镜(OLYMPUS,日本)、细胞培养箱(Shellab,美国)、生物安全柜(上海博讯实业有限公司)、微量移液器(Eppendorf,德国)、荧光定量PCR(FTC2000,Canada)、超净工作台(VS-1300,中国苏州)、迷你型超速离心机(Eppendorf,德国)、Trans-Blot®SD Cell半干转仪(Bio-Rad,美国)、TC2323二氧化碳培养箱(Sheldon Manufacturing,美国)、图像分析系统(LabworksTM Analysis Softwar,美国)、MEM 培养基(GIBCO,美国)、胎牛血清(GIBCO,美国)、胰蛋白酶、青霉素、链霉素(Sigma,美国)、DMSO (Amresco,公司)、Translipid(汉恒,中国)、小提试剂盒、大提试剂盒(OMEGA,美国)、HRP二抗(GenScript,美国)、内参一抗(GenScript,美国)、ECL化学发光试剂(PERCIE,美国)一抗:(RD,美国),pCDNA3.1-HEGF真核表达质粒(保存于井冈山大学医学院中心实验室)。
2.实验方法
2.1 细胞准备
牙髓干细胞在37℃,相对湿度100%,5%CO2培养箱中,然后置于含10%FBS,100kU/L青霉素,100mg/L链霉素的 MEM培养基的条件下培养;每3-4d换液一次,0.25%胰蛋白酶每 5-6d消化传代一次。在显微镜下观察培养瓶贴壁面至70%-80%融合,在超净工作台上操作,先吸除培养瓶中旧培养基,用PBS洗2-3次,50ml培养瓶加入胰酶消化液约1-3ml,按此比例进行消化,晃动使消化液铺均匀,置37℃培养箱约2-5min,镜下见细胞收缩变圆或少数脱落后,轻轻振动瓶底使细胞全部脱落,加入2-3ml完全培养基后,轻轻吹打,收集细胞至离心管,弃上清,加培养液,轻轻吹打成细胞悬液,按照1∶2或1∶3的比例传代至无菌培养瓶内,加入培养基后继续培养或实验。
2.2 质粒小提和大提
实验中质粒小提是在10-20ml试管中,将携带有所需质粒的E.coli接种到5ml LB培养基LB(含氨苄青霉素50μg/ml),37℃振荡培养12-16h。试验中质粒大提是将带有目的质粒的大肠杆菌接种到200-500ml LB(含氨苄青霉素50μg/ml),1-4L培养瓶中37℃震荡培养过夜(12-16h),然后按照试剂盒的说明书进行质粒小提和大提。
2.3 hEGF质粒转染牙髓干细胞
实验分为5组,H-KB表示正常细胞,H-0表示转染空载体的细胞,H-1、H-2、H-3表示转染目标质粒的细胞。用24孔板,每孔细胞接种0.5-2×107个细胞,使转染时细胞达到70%左右的回合率,细胞培养24h后,更换新的培养基。将0.8μg质粒稀释于50μl MEM 培养基,轻轻混匀,并将2μl TransLipid稀释于48μl MEM培养基,轻轻混匀,室温孵育5min。然后两种液体轻轻混匀,室温孵育20min,使 DNA-TransLipid复合物形成。将100μl DNA-TransLipid复合物加入培养板中,轻轻摇匀,将培养板放入37℃培养箱中,转染4-6h后更换新的培养基,继续培养18-72h。
2.4 转染牙髓干细胞的筛选
弃去原MEM培养液,用浓度400nmol/L作为G418的筛选浓度,转染细胞传代后换含400nmol/L G418的牙髓干细胞MEM培养液培养、筛选,定期更换培养液,培养2w后收集G418抗性细胞克隆,将其挑至24孔板,并在MEM培养液中继续培养2w。
2.5 Q-PCR检测hEGF基因
在NCBI的Genbank中查找出人HEGF基因的DNA序列,设计引物hEGFF(TGAGAGTAAACAAGAGGACTGGC)、hEGFR(CAAATATGTTCACAGCCTCCG),145bp。按照试剂盒要求提取RNA,将RNA 沉淀溶解于适量(20-50μl)的无RNase水中,如果RNA 沉淀溶解不完全,使OD260/OD280≤1.6。随机取几个样品进行预实验,然后确定反应条件:反转录反应体系的配制(总体积20μl):2×RT buffer 10μl,6N 随机引物(100 pmol/μl)1μl RT-mix1μl,模板(RNA)5μl,DEPC水3μl。反转录反应条件的设置:25℃10min 42℃50min,85℃5min;荧光定量PCR反应体系的配制:(总体积50μl),2× PCR buffer 25μl,Primers(25pmol/μl)1μl×2,20×Sybr green I 0.5μl,模板(cDNA)2μl,DEPC水20.5μl。荧光定量 PCR扩增条件的设置:94℃4min;94℃20s,60℃30s,72℃30s循环35次,72℃检测信号。
2.6 WB检测蛋白表达
贴壁细胞,去除培养液,用PBS洗一遍。悬浮细胞,离心收集,PBS洗一遍,通常每106个细胞可加0.1ml RIPA buffer,裂解液和细胞充分接触,使细胞充分裂解,考马斯亮兰G250测蛋白浓度,紫外分光光度计,595nm,用1号管调零,制出标准曲线,标准方程及R值(R值应大于0.99,否则操作误差较大),测量待测蛋白OD值,算出蛋白浓度。SDS-PAGE电泳,化学发光,显影,定影,对胶片进行扫描,然后用UVP凝胶图象处理系统Labworks4.6软件分析目的条带的灰度值。
3.统计学处理
所有数据都采用SPSS 17.0医学统计软件进行分析,各组比较用单因素方差分析,取F值,两两比较取P值,P<0.05为差异具有统计学意义。
结 果
1.总的RNA提取凝胶图像
总RNA提取后,分别取5μl作琼脂糖凝胶电泳,紫外灯下可见28s,18s,5s三条rRNA的清晰条带,并且28s条带的强度高于18s,18s条带的强度高于5s,未见其它条带,总RNA未降解,无DNA污染,质量良好(图1)。
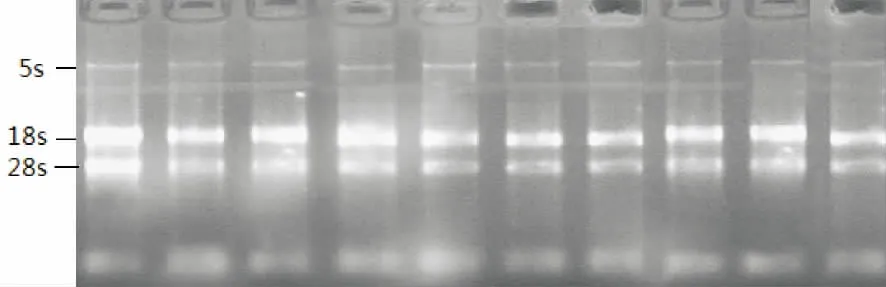
图1 HEGF RNA琼脂糖凝胶电泳结果Fig.1HEGF RNAagarose gel electrophoresis results
2.HEGF质粒扩增曲线及标准曲线分析
将质粒溶液进行10倍的系列梯度稀释,以1∶102、1∶103、1∶104、1∶105、1∶106的5个浓度梯度的DNA溶液作为模板进行Q PCR扩增,荧光定量分析软件绘制出反应的扩增曲线,扩增曲线形态为相似的S型曲线,符合PCR扩增动力学变化(图2)。图中横坐标为循环数,纵坐标为荧光强度,扩增曲线显示,从左至右5条曲线依次代表标准品的1∶102、1∶103、1∶104、1∶105、1∶106的梯度稀释液的扩增曲线,扩增曲线较光滑,呈现典型的S型曲线,且各循环阈值(CT值)间隔均匀。目的基因HEGF质粒的标准曲线自动生成,依次递减的浓度梯度的标准品生成的标准曲线线性关系良好,本实验HEGF质粒扩增效率均在R2=0.9978,均方差=0.0953,斜率=-3.3629,截距=46.9535,说明扩增效率接近100%,提示不同梯度定量模板的对数值与循环数(Ci值)之间,有着很好的相关关系,说明数据的可靠性高 (图3)。
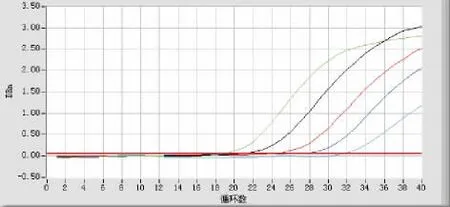
图2 HEGFQ-PCR扩增曲线Fig.2HEGF Q-PCR amplification curve
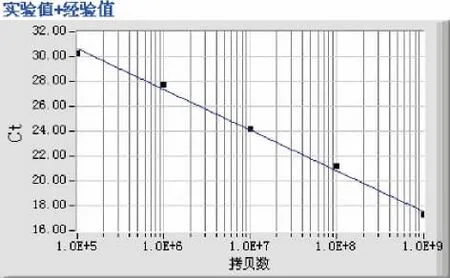
图3 HEGFQ-PCR标准曲线Fig.3HEGF Q-PCR standard curve
3.HEGF质粒及内参扩增表达数据分析
表1和表2显示H1、H2、H3的相对比值明显高于H0、H-KB组,证明HEGF质粒表达情况较高。实验中进行了3个复孔,所以每个组别检测有3个Ct值,即到达平台期所需要的循环数分别为Ct1、Ct2 和 Ct3,通过计算可以得到 3 个 2-△△Ct。2-△△Ct能够准确的反映出该基因表达的差异,即与对照组相比,该基因上调或者下调表达了多少倍,准确定义为:Fold Change。H0、H1、H2、H3组分别与H-KB组对比的2-△△Ct值,通过单因素方差分析F值等于8.009,P<0.05,说明这几组之间的差别是有显著性的,两两比较发现H0组与H-KB组比较的2-△△Ct值与 H1、H2、H3组与 H-KB 组比较的2-△△Ct值的差别是有显著性的,其他组差别无显著性(图4)。
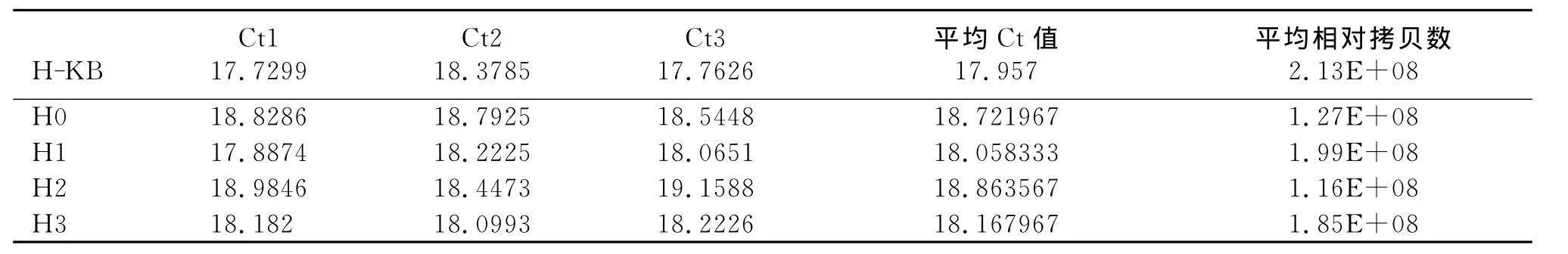
表1 内参Q-PCR扩增数据Table 1 Reference data for Q-PCR amplification
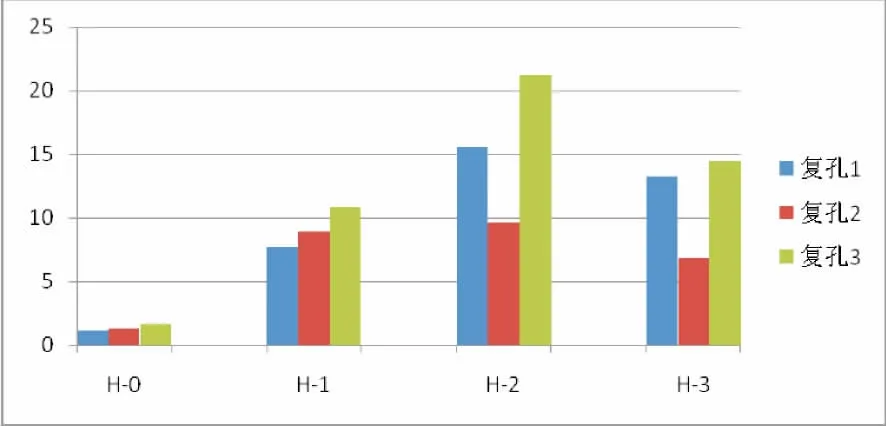
图4 H0、H1、H2、H3组与 H-KB组对比的2-△△Ct值柱形图注:单因素方差分析F值等于8.009,P<0.05Fig.4The 2-△△Ct value column chart of H0,H1,H2,H3group contrast H-KB groupNote:One Way ANOVAFvalue is equal to 8.009,P<0.05
4.熔解曲线分析
结果显示目的基因熔解曲线如图4所示,HEGF基因PCR产物以及标准品(内参)均在大于84℃以上获得单一熔解峰,说明在该反应条件下,扩增反应产物溶解温度较均一,目的基因具有很好的特异性,反应体系良好(图5)。

图5 HEGF以及内参基因熔解曲线Fig.5HEGF and reference gene melting curve
5.转染牙髓干细胞细胞后的蛋白质含量Western blot检测
HEGF蛋白分子量约为133kD,hEGF蛋白表达(HEGF/GAPDH IOD比值)积分光密度是表示整个视野内所有阳性细胞反应强度的总和。积分光密度的值高,表示呈阳性反应细胞的数目多。转染牙髓干细胞后的蛋白质含量Western blot检测以及灰度值发现,在相同的实验条件下,各组均检测到目的基因的表达,H1、H2和H3组较H0组与H-KB组的蛋白表达要增强(图6-7)。HEGF在转染目标质粒的细胞的组别里的表达明显高于正常细胞组和转染空载体的细胞组,通过单因素方差分析F值等于75.488,P<0.05,说明转染目标质粒的细胞组别与正常细胞组和转染空载体的细胞组的差别是有显著性的(图8)。
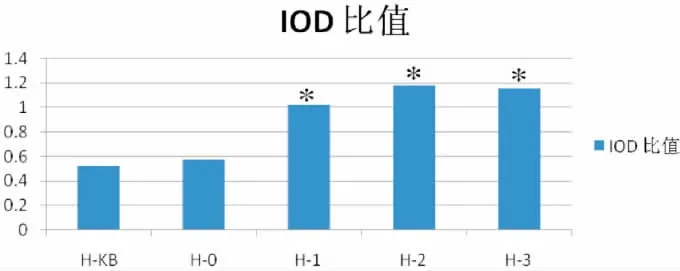
图6 Western blot检测后HEGF蛋白的表达柱形图注:*与H0组和H-KB组相比,P<0.05Fig.6The expression column chart of HEGF protein after Western blotNote:*compared with H0group and H-KB group,P<0.05
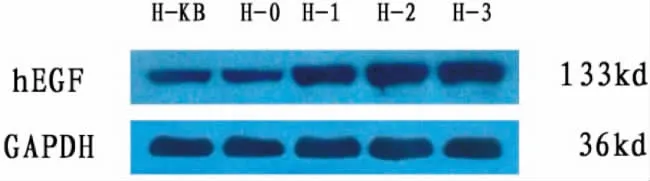
图7 Western blot检测后HEGF蛋白的表达注:*与H0组和H-KB组相比,P<0.05Fig.7The HEGF protein expression after Western blotNote:*compared with H0group and H-KB group,P<0.05
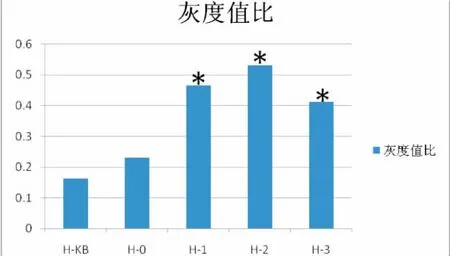
图8 Western blot检测后HEGF蛋白的表达灰度值柱形图注:*与H0组和H-KB组相比,P<0.05Fig.8The gray value expression column chart of HEGF protein after Western blotNote:*compared with H0group and H-KB group,P<0.05
讨 论
牙齿再生医学是利用生物技术完全再生出牙齿或牙齿局部组织再生,然而牙齿发育和萌出机制比较复杂,尤其牙齿发育的牙髓干细胞的的分化机制并不清楚,因此,对牙髓干细胞进行基因修饰,促使其定向分化为组织工程牙齿就显得意义重大[3,4]。HEGF基因位于染色体4q25-27,mRNA约为4.75Kb,编码含1217个氨基酸前体,目前的研究发现其可促进组织的愈合并可使小鼠牙齿早萌,刘俊等通过人牙髓干细胞体外培养技术,采用MTT法研究雄性大鼠表皮生长因子对人牙髓干细胞增殖的影响,结果也发现大鼠表皮生长因子可以促进体外培养的人牙髓干细胞的增殖,大鼠表皮生长因子有效作用浓度越大,牙髓干细胞生长密度越大[5]。由于目前HEGF与真核表达HEGF及生物活性的差别,促使学者将HEGF基因导人真核表达载体,采用基因转移技术将其导入干细胞中,并获得HEGF表达蛋白,使其持续分泌表达表皮生长因子,以促进干细胞的增值和分化[6]。本次实验为了研究牙髓干细胞的增值和分化的后续研究,利用前期实验构建的pCDNA3.1-HEGF真核表达质粒转染牙髓干细胞,通过Q-PCR法和 Western blot法检测 HEGF基因表达,通过计算得到能够准确的反映出该基因表达的差异的2-△△Ct值,即与对照组相比,该基因上调表达了6-21倍,通过单因素方差分析说明差别是有显著性的,为下一步的牙髓干细胞的增值和分化取得前期的实验基础,较常规的DNA基因组分析法,具有明显的优越性。而且Western blot检测发现,在相同的实验条件下,各组均检测到目的基因的表达,但实验组蛋白表达显著高于空白对照组与空载体组的蛋白表达。因为大量相应mRNA的存在则提示表达的增加,但DNA水平的扩增并不一定提示表达的增加,本实验的Q-PCR方法是直接检测特定的mRNA的表达量,可以真实的反应基因表达水平。我们采用实时Q-PCR法和 Western blot法对目的基因进行检测与相对定量,具有很高的敏感性和特异性,为下一步的实验提供了可靠的实验基础。
实验成功的把pCDNA3.1-HEGF真核表达质粒转染到牙髓干细胞,而且通过检测其表达很强,扩增反应产物溶解温度较均一,目的基因具有很好的特异性,反应体系良好,这为下一步的牙髓干细胞的增值和分化的研究奠定了前期实验基础。
[1]Carpenter G.The regulation of cell Proliferation:Advance in the Biology and Mechanism of Epidermal Growth Factor.J Invest Dermator,1978,71:283-288
[2]Andree C,Swain WF,Page LP,et al.In vivo transfer and expression of a human epidermal growth factor gene accelerated wound repair.J ProeNatlAcad Sci,1994,12:12188-12192
[3]Xu KP,Dartt DA,Yu FS,et al.EGF-induced ERK phosphorlationindependent of PKC isozymes in human corneal epithelial cells.J Invest Ophthlmol Vis Sci,2002,12:3673-3679
[4]Liang RF.Effect of Transforming growth Factor-βEpidermal Growth Factor on Clonal Rat Pulp cells.J Arch Oral Biol,1990,35:7-11
[5]刘俊,李玉晶,张海燕等.表皮生长因子对人牙髓细胞DNA合成及细胞周期的影响.现代口腔医学杂志,2003,17(2):200-202
[6]薛震,吕松岑,赵金东等.重组pcDNA311-hBMP-7真核表达载体的构建及转染兔骨髓基质干细胞的实验研究.中国矫形外科杂志,2007,15(20):1570-1573
