两种构建小鼠脊髓击打损伤模型仪器的比较和探讨
2015-12-19王春芳李鹏飞闫肖卿景志杰
田 峰 王春芳 李鹏飞 李 宵 闫肖卿 景志杰
(山西医科大学实验动物中心;实验动物与人类疾病动物模型山西省重点实验室,太原030001)
脊髓损伤(spinal cord injury,SCI)是中枢神经系统中一种严重的高致死致残性创伤疾病,可由多种原因产生作用力于椎体内的脊髓,致使脊髓受损后出现水肿、微血管出血以及神经元坏死等[1]。世界卫生组织2013年报告显示,每年发生脊髓损伤人次多达50万[2]。近些年来,脊髓损伤的研究已经成为医疗领域中的一个热门课题。因此,建立一种稳定、可靠、重复性强,并能够最大程度的接近临床损伤情况的SCI模型,为脊髓损伤研究提供标准化动物模型,成为了许多实验室的亟待解决的问题。
实验室制作SCI模型一般分为三大类,分别是挤压或挫伤模型、完全横断和局部离断模型、缺血和化学损伤模型。每一类SCI模型都有各自的适用范围,为了更接近人类临床脊髓损伤后的情况,多数实验室会选用挤压/挫伤模型[3]。自1911年 Allen[4]首次运用重物自由落体原理实施垂直打击脊髓来制作SCI模型以来,由此而产生的重物打击脊髓仪器也不断的被改进。利用上述原理,本课题组将一台脑立体定位仪改装成了自制Allen脊髓击打仪。前期的实验显示,通过这台仪器,本课题组成功建立了小鼠的脊髓损伤模型,能够通过该仪器将从胎鼠提取的神经干细胞注射入脊髓损伤小鼠的被打击局部,从而尝试对小鼠进行了神经干细胞移植治疗,并取得了一定的疗效[5]。
为了进一步使小鼠脊髓损伤模型更加标准化、规范化,并能与国际标准化脊髓损伤模型接轨,便于在以后的实验中对神经干细胞移植的效果进行量化的分析,本课题组引进了由 The State University New Jersey设计制作的 Impactor M-Ⅲ脊髓撞击器。本文将通过比较上述的两种脊髓打击仪器制作的SCI模型,讨论两种仪器在使用上的优缺点。
材料和方法
1.实验动物
清洁级昆明小鼠(由山西医科大学实验动物中心提供),40只,体重20-25g,BBB运动功能评分[6]为21分,雌雄不限,许可证号为:【SCXK(晋)2009-0001】。室温条件下饲养,12h开/关日光灯交替照明,自由摄食和进水,每两天更换一次垫料。术前3h停止进食和进水,于山西医科大学实验动物中心屏障环境动物实验设施进行手术操作【SYXK(晋)2009-0004】。
2.实验仪器
2.1自制Allen脊髓击打仪
自制Allen脊髓击打仪是根据Allen发明的重物坠落法原理,在现有的脑立体定位仪(深圳沃瑞德,68001型)的基础上改造的一个准确、稳定的脊髓击打仪器。
改良过程:首先将原脑立体定位仪底部用来固定动物的装置拆除;再将原有的三维操纵臂的单头连接器改为一端可以连接一个中空的重物打击杆,另一端连接微量注射器的双头连接器;然后将三维操纵臂与双头连接器组合安装在定位仪上。同时,为重物打击杆制作了专用的重物砝码(外直径为1cm,重量分别为5g、10g、20g三个重量砝码)和压迫砝码(一个类似锥形的倒置砝码;上部与重量砝码接触,直径为1cm;下部与动物脊髓接触,直径为0.15cm)(图1)。
操作时,先将压迫砝码置于重物打击杆中,与实验小鼠的脊髓暴露面接触并轻度抬起;再将重量砝码与长线相连,通过重量砝码自由落体的作用撞击压迫砝码,使得压迫砝码对实验小鼠的脊髓造成设定重量的击打损伤。
2.2Impactor M-Ⅲ脊髓撞击器
Impactor M-Ⅲ脊髓撞击器(W.M.Keck Ceter for Collaborative Neuroscience Rutgers,The State University New Jersey.USA)是设计用来为大小鼠施加可重复的标准脊椎撞击的仪器。Impactor M-Ⅲ为SCI模型制作了固定重量的撞击锤(大鼠:10g,脊髓接触面直径2.5mm;小鼠:5g,脊髓接触面直径1.2mm),可调控高度为0-99.99mm,可连续手动调节,并为减小误差设计了释放撞锤的电动控制按键。同时,Impactor M-Ⅲ脊髓撞击器能够与电脑进行数据连接,通过电脑采集数据,可制作出撞锤从设定高度(3.00mm,6.25mm,9.00mm,12.50mm,25.00mm,50.00mm,75.00mm)落到裸露脊髓表面的运动曲线,并能够精确测量出撞锤在运动过程中各个节点的相关数据(图2)。

图1 自制Allen脊髓击打仪Fig.1 Homemade Allen’s spinal cord

图2 Impactor M-Ⅲ脊髓撞击器Fig.2Impactor M-Ⅲ spinal cord contusion system
3.小鼠脊髓击打模型的建立
3.1 动物分组
将实验选取的40只小鼠随机分为两组,每组20只。一组用自制Allen脊髓击打仪进行脊髓打击(A组,n=20),另一组用Impactor M-Ⅲ脊髓撞击器进行脊髓打击(B组,n=20)。再将A、B两组小鼠各分为两部分A1、A2和B1、B2,A1、B1用于术后BBB运动功能评分(n=10),A2、B2用于组织形态学观察(n=10)。
3.2 模型建立步骤
采用10%的水合氯醛腹腔注射麻醉,将小鼠的四肢固定于手术用托盘。常规消毒后,用手触及小鼠最后一对肋骨下缘定位,并用剪刀延小鼠正中被毛从定位处向头部方向切开一个1.5cm左右的纵向切口。逐层分离皮下组织,显露棘突,直至暴露出T9-T11椎体。用鼠齿镊夹住T9椎体,再用小纹式钳咬除T9-T11的上部椎板(定位:T10为中心,T9棘突方向为斜向尾部,T11棘突方向为斜向头部),直至显露出一个长约8mm的脊髓面。分别采用两种脊髓击打仪器对暴露的脊髓面进行击打实验,建立SCI模型,实验高度为12.5mm,砝码重量为5g。以小鼠尾部痉挛状摇摆,双下肢及躯体回缩扑动、双下肢瘫痪作为造模成功标志。
术后将小鼠单独分笼饲养,每12h按摩小鼠膀胱,帮助其排尿,直至恢复自主排尿。在相应时间节点对实验小鼠进行BBB运动功能评分,记录评分结果。并且在3d、7d、14d、21d提取损伤小鼠的脊髓进行HE染色,观察组织学形态。
4.统计学处理
所得数据采用SPSS13.0统计软件和EXCEL软件处理,实验结果采用均数±标准差()表示,组间比较采用t检验,P<0.05时表明认为差异具有统计学意义。
结 果
1.BBB运动功能评分
术后三周内,对分笼饲养的A1、B1两组受试实验小鼠在6个不同的时间点:1d、3d、5d、7d、14d、21d采用BBB运动功能评分法进行评分。
术前受试的20只小鼠在BBB运动功能评分上并无差异,均保持在21分;术后1d、3d、5d以及进入稳定期的21d,两组BBB运动功能评分相近(P>0.05),表明两组恢复程度差异性不大;而在7d、14d,B1组评分明显高于A1组(P<0.05),表明在这两个时间节点B1组恢复程度高于A1组(表1,图3)。
表1 不同时间点各组BBB评分比较()Table 1 Comparision of BBB scores in eash group at different times()

表1 不同时间点各组BBB评分比较()Table 1 Comparision of BBB scores in eash group at different times()
注:*该组与相邻组同一时间点比较,P<0.05.Note:*P<0.05,compared with the adjacent group at the same time.
组别Groups术后评分Postoperative scores 1d 3d 5d 7d 14d 21d A1组 21.00±0.00 0.10±0.32 0.40±0.52 1.00±1.05 3.40±1.43* 7.40±1.58*术前评分Preoperative scores 14.70±2.91 13.4±3.13 B1组 21.00±0.00 0.20±0.42 0.40±0.70 1.90±1.37 5.10±1.37* 9.30±1.34*

图3 .各时间点BBB运动功能评分折线图Fig 3.The line chart of every time BBB scores

图4 Impactor M-Ⅲ脊髓撞击器与电脑连接得到的撞锤下落曲线及数据Fig.4Impactor M-Ⅲ spinal cord contusion system and the computer to connect the rammer fall curve and data
2.Impactor M-Ⅲ脊髓撞击器电脑数据
以上10幅坐标图(图3)是B1组10只小鼠由Impactor M-Ⅲ脊髓撞击器进行击打实验时,电脑同步收集的相关数据。
图中以重锤所在高度为纵坐标,时间点为横坐标建立坐标图。每幅坐标图中均有7条曲线,分别代表撞击锤运动高度变化(Impactor Ht)、实验小鼠脊髓所在高度(Vertebral Ht)、撞击锤第一次接触脊髓时间(Contact)、脊髓形变时最低高度(Lowest CS Height)、脊髓表面高度(Cord surface)、撞击锤速度(Velocity)、ImpVel Tang Line,并标有撞击锤下落最高高度(Heighest Height)。从坐标图中可以直观的看出,Impactor M-Ⅲ脊髓撞击器能够精确的同步记录打击撞击锤的运动轨迹及重锤相关数据。通过精确的限定实验高度和其他相关条件,可以使实验相关数据量化,稳定性大大增强。
3.伤口对比
以下三张图片为击打手术前小鼠脊髓外观情况和使用两种脊髓打击器制作的脊髓损伤模型后小鼠的脊髓组织外观情况(图5)。从图中可以看出,使用自制Allen脊髓击打仪得到的模型伤口处脊髓被膜无破损、无外部出血,脊髓内部充血较明显;而使用Impactor M-Ⅲ脊髓撞击器得到的模型脊髓被膜有细小伤口并伴有出血。
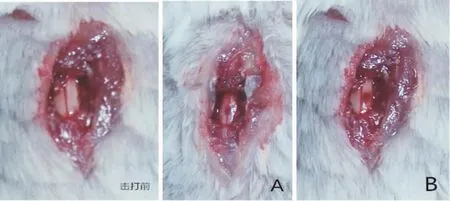
图5 两种仪器击打后脊髓组织情况(击打前:脊髓被膜形态完整,正中有血管走行;A:脊髓被膜无破损,脊髓内可见充血;B:脊髓被膜处有出血现象)Fig.5The structure of the spinal cord injury(Before injury:The intact dura;A:The blood under the intact dura can be seen after the injury;B:Spinal cord have bleeding phenomenon)
4.组织学改变
制作脊髓损伤后,脊髓组织内的结构形态、细胞状况均发生变化。可见脊髓内出现大量血红细胞,并伴有胶质细胞增生、大量空泡产生等现象(图6)。

图6 脊髓击打后HE染色(图中脊髓形态完整,灰白质界限清晰、结构致密,神经纤维排列整齐,打击处可见大量红细胞,组织结构紊乱)Fig.6The result of HE staining of spinal cord injury(The spinal cordStructural integrity,boundary clearly in gray and white substance,Compact structure,Neat nerve fibers.A large number of red blood cells have been seen in wound and the structure disorder)
两种仪器制作的模型在HE染色后,从得到的图片上可以看出染色结果差异不大。均可见3d时,可见明显的出血、充血现象,神经细胞核碎裂,炎性细胞可见,炎性渗出;7d时,有较多的胶质细胞增生出现,血管和间质纤维轻度增生,组织疏松;14d时,组织结构表疏松,灰白质界限模糊,胶原纤维增多伴淀粉样变性,并有大量空泡变性;21d时,有核细胞数量增多,均匀分布,有胶原穿插,结构稍显紧密(图7)。
讨 论
随着现代社会各种交通运输工具数量增多、建筑业的飞速发展,复杂环境和状况对人类造成了伤害的几率日益增加,相关的脊髓损伤患者数量也呈每年上升的趋势。如何更加深入地研究和探索脊髓损伤后各项病理生理状况及治疗,成为了近几年医疗领域的热门课题。因而,在实验室中,如何建立一个稳定、准确、标准化强、操作性强、重复性好并且最大程度接近临床脊髓损伤情况的动物模型就显得至关重要。
实验表明,自制Allen脊髓打击器和Impactor M-Ⅲ脊髓撞击器都能够成功建立的两组动物实验模型,并且两组模型均能很好反应脊髓损伤后小鼠的运动功能恢复过程。并且,通过BBB运动功能评分发现两种仪器所造模型恢复期间存在一定的差异,但在组织形态切片上差异显示不大,可能由于两台仪器构造及操作的不同造成。

图7 各时间点脊髓损伤处HE染色(A1、B1:3d,神经细胞核碎裂,有明显充血出血,炎性渗出,炎细胞可见;A2、B2:7d,脊髓胶质细胞增生,血管和间质纤维轻度增生,组织疏松;A3、B3:14d,灰白质界限模糊,胶原纤维增多伴淀粉样变性,有空泡产生;A4、B4:21d,有核细胞增多,胶原穿插其中,结构稍显紧密)Fig.7Therusult of HE staining in different times(A1、B1:3d,karyorrhexis of neurone,hyperaemia,inflammatory exudation;A2、B2:7d,gliocyte proliferation,tissue loose;A3、B3:14d,boundary blurring in gray and white substance,glial scar as well as cavity were formed;A4、B4:21d,numerous nucleated cells,Collagen interwoven)
1.高度、重量、控制差异
自制Allen脊髓打击器具有一个重物打击杆,实验者手动控制用长线连接的砝码,经过打击杆中空的杆径下落撞击压迫砝码。在这一过程中,砝码离脊髓面的高度由实验者量取线长来确定,不能做到十分的精确,并且砝码与杆内壁会产生摩擦,出现误差;实验者手动控制砝码的下落,这个过程砝码高度也会有一定的误差;压迫砝码是压在裸露脊髓表面并轻微抬起,重量不计,这样会使砝码重量略微增大,存在一定的误差[7]。从实验结果中也可以看出,A组的损伤程度较B组略重,在7d、14d恢复高峰期相对恢复较慢。
Impactor M-Ⅲ脊髓撞击器的砝码高度是由机械控制,可以在0-99.99mm范围内连续调节,垂直运动距离准确度0.001mm,分辨率0.01mm;从得到的坐标图也可以看出,撞击锤下落最高高度(Heighest Height)的误差被控制在5%以内。采用电动按钮机械控制砝码的下落,也可减少摩擦带来的误差。但是Impactor M-Ⅲ的配套撞击锤重量为大鼠10g、小鼠5g、撞击锤为固定机械装置,不能更换其重量,限制了实验中对重量改变的要求。
2.伤口定位差异
自制Allen脊髓打击器在操作时,是先将压迫砝码精确定位于脊髓暴露面并轻轻接触,然后轻微抬起压迫砝码。这样可以使脊髓在被击打时受力均匀,并且可以避免脊髓因撞锤下冲而移位,不易造成脊髓偏击,但脊髓内出血现象较重。
Impactor M-Ⅲ脊髓撞击器操作时,是先将撞击锤定位于脊髓暴露面,精确定位后在手动调节机械臂,使撞锤上升到需要高度,按下电控按钮,撞锤自由下落。这样的方法容易使脊髓在被打击时因形变移位导致砸偏而受力不均。如果高度定位较高,撞锤下落后会对脊髓产生冲击伤,易刺穿脊髓表膜,造成出血较多。
所以从实验结果可以看出,自制Allen脊髓打击器制作的模型打击程度较Impactor M-Ⅲ脊髓撞击器制作的模型损伤程度重,但不易出现砸偏现象。
3.其他差异
在建立脊髓击打模型的基础上,自制Allen脊髓打击器和Impactor M-Ⅲ脊髓撞击器都增加了一些其他功能的设备,用来进一步进行损伤的后续实验。自制Allen脊髓打击器可以在双头连接器上可以加持一个微量注射器,利用三维空间定位的原理,为损伤脊髓后的实验动物注射干细胞使用。而Impactor M-Ⅲ脊髓撞击器可以与电脑相连接,实现数据的实时收集和分析。不仅能够根据撞击锤的下降情况绘制撞击锤运动高度变化(Impactor Ht),而且还可以根据坐标图中其他数据量化模型制作标准,如:根据脊髓所在高度(Vertebral Ht)与脊髓形变时最低高度(Lowest CS Height)计算出脊髓形变对小鼠存活时间的影响;根据撞击锤速度(Velocity)来判断摩擦力的变化,并且误差能控制在5%以内。为稳定分析实验撞击数据提供技术支持,并且使实验相关的各种数据得到了量化,使实验稳定性大大增强。
许多实验室选用自制Allen脊髓打击器,多因为自制Allen脊髓打击器造价较低,能够大大降低实验成本。但是,使用和改装方式不一致,使得得到的实验数据无法用统一的标准来衡量;而Impactor M-Ⅲ脊髓撞击器有着广泛的使用群体,截止目前,国外有超过100个实验室在使用,并且有超过50%的关于脊髓损伤研究文献采用此种打击器,但在国内应用较少。因此,使用该仪器可以很好的实现制作脊髓损伤模型标准化,与国际标准化接轨。但是Impactor M-Ⅲ脊髓撞击器存在着价格昂贵、购买相对困难等问题。随着脊髓损伤研究的广泛展开和不断深入,使用国际标准化的模型制备仪器必将成为以后大势所趋。
综上所述,本实验采用了两种不同的脊髓打击仪器,分别建立两组小鼠脊髓击打模型。通过比较脊髓打击实验时两种仪器的操作情况和脊髓打击后两组小鼠在恢复上的不同,对两种仪器在脊髓击打实验中出现的各种优缺点进行了说明。通过比较可以看出,两种仪器都可以稳定、准确的建立动物脊髓损伤模型。实验者可以根据不同实验的具体情况和要求或所在实验室的要求来选择使用不同的击打仪器,从而得到可重复的脊髓损伤模型。但Impactor M-Ⅲ脊髓撞击器的使用,会为数据化脊髓损伤模型提供可参考的实验数据,为提高动物实验模型的成功率提供保障。
[1]Ratan RR,Noble M.Novel multi-modal strategies to promote brain and spinal cord injury recovery.Stroke,2009,40(3suppl 1 ):SI30-SI32
[2]世卫组织报告.全球每年50万人发生脊髓损伤.上海:上海医药,2014,35(1):43
[3]杨迎暴,朴英杰.脊髓损伤模型的建立及其评价标准.中华创伤杂志,2002,18(3):187-190
[4]AllenAR.Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal colum.JAMA,1911,57(10):878-880
[5]张海滨,王春芳,李鹏飞等.小鼠脊髓损伤模型的建立及神经干细胞移植后运动功能恢复情况的研究.中国组织化学与细胞化学杂志,2014,23(2):105-110
[6]BassoDM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rate.J Neurotrauma,1995,12(1):1-21.
[7]宋轶,马坚妹.脊髓损伤动物模型建立方法的分析与比较.Progress of Anatomical Sciences,2013,19(4):366-369,373
