不同辐照剂量对红豆分离蛋白结构及特性的影响
2015-12-19江连洲王中江
陈 勇 王 晶 江连洲,2 李 杨,2 王 晓 王中江
(东北农业大学食品学院1,哈尔滨 150030)(国家大豆工程技术研究中心2,哈尔滨 150030)
不同辐照剂量对红豆分离蛋白结构及特性的影响
陈 勇1王 晶1江连洲1,2李 杨1,2王 晓1王中江1
(东北农业大学食品学院1,哈尔滨 150030)(国家大豆工程技术研究中心2,哈尔滨 150030)
采用Lowery法、ANS荧光探针法、圆二色光谱、荧光光谱等方法分别对不同辐照处理的红豆分离蛋白溶解度、表面疏水性、蛋白质二级、三级结构、流体动力学半径进行分析。结果表明:随着辐照剂量的增加,红豆分离蛋白的二级结构中α-螺旋结构向无规则卷曲结构的转变,Trp残基所处微环境极性先增强后减弱,这与其表面疏水性呈现正相关,蛋白颗粒大小随着辐照剂量的增加先减小后增大,在5 kGy辐照剂量处理时达到最小,这与其溶解性呈现负相关。
辐照 红豆分离蛋白 蛋白结构 功能特性 圆二色谱
红豆(Phaseolus angularis)菜豆属,豆科,俗称“赤小豆”、“红小豆”[1]。红豆原产于中国,在我国的栽培和利用技术已有2000多年的历史。红豆种子中含有丰富的营养物质,每100 g红豆中约含蛋白质20.79 g、脂肪 0.79 g、糖类 58.59 g、粗纤维 4.39 g、总膳食纤维23.49 g及微量维生素[2]。由于红豆具有独特的中药属性,对红豆蛋白资源开发和综合利用研究已逐步发展起来,这对于改善人们的膳食结构具有重要意义[3]。
辐照技术是借助钴-60所产生的高能量、强穿透性的伽马射线,电离和激发物质产生的活化分子与活化原子,并发生一系列物理、化学、与生物化学变化,使物质发生聚合、交联、降解、并发生改性[4]。FAO、WHO和IAEA辐照食品联合专家委员会早在1980年10月就根据总结的世界各国辐照食品的研究成果制定了国际安全线,即任何食品当总体平均吸收剂量不超过10 kGy时,不存在毒理学的危险,也不会产生特别的微生物学和营养的问题[5]。国外对辐照技术的研究相比国内起步较早,Vaz等[6]研究了低剂量辐照处理对过敏原蛋白抗原决定簇影响;Ramkrashan Kasera等[7]研究了加热处理与辐照处理对豆类变应原性的影响。近年来,我国逐步加快了辐照技术在食品中的应用研究,朱佳廷等[8]进行了大豆蛋白粉的辐照灭菌研究,然而,在这些的研究中,目前鲜有研究低剂量辐照处理红豆蛋白对其结构和功能特性的影响。本试验主要研究了利用60Coγ射线研究不同辐照剂量对红豆分离蛋白的结构和功能性的影响,为辐照技术对红豆蛋白改性应用提供参考。
1 材料与方法
1.1 材料与试剂
红豆:市售产地为黑龙江省海林;九三大豆油:市售Lowry法蛋白质含量测定试剂盒:上海荔达生物科技有限公司;1-苯胺基-8-萘磺酸(ANS):Sigma公司。
1.2 仪器
FD5-3型冷冻干燥机:美国SIM公司;F-4500荧光分光光度计:日本HITACHI公司;J-810圆二色谱仪:日本JASCO公司。
1.3 试验方法
1.3.1 红豆分离蛋白提取
红豆去皮后,粉碎过60目筛子,正己烷脱脂3次,风干后碱溶酸沉法提取,冷冻干燥,得到的红豆分离蛋白在-20℃下储存备用。
1.3.2 红豆蛋白辐照处理
采用透明聚乙烯(PE)塑料袋包装,50 g/袋,辐照处理在黑龙江省农业科学院玉米研究所进行辐照装置为60Coγ辐射源,辐照剂量分别为1、3、5和10 kGy。辐照后样品室温(15~30℃)下贮存,用重铬酸盐剂量计作为辐照剂量跟踪。
1.3.3 圆二色谱分析
采用远紫外区域圆二色光谱研究红豆蛋白的二级结构[9-10],圆二色谱(CD)扫描波长范围为 250~200 nm,常温下(25±1)℃,扫描速度为100 nm/min,样品池光程为0.1 nm,灵敏度为100 mdeg/cm。红豆分离蛋白浓度为 0.4 mg/mL,用 pH 7.0,0.01 mol/L的磷酸缓冲液配制。用平均摩尔椭圆率[θ]来表示CD数据,单位为 deg·cm2·dmol-1。通过 CDPRO软件分析CD色谱图数据,使用的算法为CONTIN/LL,使用的参考蛋白为 SMP56(Optimized for 190-240 nm#Less nm required),取蛋白平均残基浓度MRW为115 g/mol,计算波长范围为 200~240 nm,计算α-螺旋,β-折叠,β-转角与无规则卷曲的含量[11]。每个样品重复3次测定。
1.3.4 流体动力学半径及其分布测试
采用ZetaPlus粒度分析仪测定红豆分离蛋白的流体动力学半径及其分布径。将红豆分离蛋白样品用50 mmol/L的磷酸缓冲液(pH 7.0)稀释至蛋白浓度为0.2%的溶液。过0.45μm醋酸纤维膜(水系),于室温下进行测量,取3次测量的平均值。
1.3.5 荧光光谱测试
采用F-4500荧光分光光度计测定红豆分离蛋白的内源性荧光光谱(色氨酸荧光光谱)。将自制红豆分离蛋白样品分散于0.01 mol/L磷酸缓冲液(pH 7.0)中,配制成0.15 mg/mL的蛋白溶液。荧光发散光谱分析以蛋白质分子内部的色氨酸荧光基团为探针,为了降低酪氨酸的贡献,荧光光谱激发波长为290 nm,发散光谱扫描范围为300~400 nm,激发狭缝和发射狭缝宽均为5 nm[12]。
1.3.6 表面疏水性测定
表面疏水性测定采用ANS荧光探针法。分别称取0.025 g不同品种蛋白样品溶于50 mL磷酸盐缓冲液(0.01 mol/L,pH 7.0)中,在室温条件下搅拌1.0 h,然后在10 000×g离心30 min,取上清液用Lowry法测定蛋白浓度,并用磷酸盐缓冲液依次稀释(浓度为0.005~0.5 mol/mL)后,取不同浓度梯度的样品溶液4 mL,分别加入40μL浓度为8 mmol/L的ANS溶液(用0.01 mol/L,pH 7.0的磷酸盐缓冲液配制),经振荡后静置3 min,再测定样品荧光强度(FI)。试验中激发波长 λex=370 nm,发射波长λem=490 nm,夹缝为5 nm。以荧光强度比蛋白质浓度作图,初始段斜率即为蛋白质分子的表面疏水值(H0)[13]。
1.3.7 溶解性测定
称取100 mg红豆蛋白样品分散于10 mL的去离子水中,磁力搅拌30 min,20℃、12 000×g离心20 min。上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度表示为上清液蛋白质量占总蛋白质量的百分比[14]。
1.4 数据处理与统计分析
单项试验设3次重复,结果均为平均值,以x±s(平均数±标准误)表示,数据处理采用SAS 8.12软件进行单因素方差分析(One-WayANOVA)和差异显著性检验。
2 结果与讨论
2.1 圆二色光谱分析
通过曲线拟合软件CDPro计算得到红豆分离蛋白的二级结构如表1所示。对照样品螺旋结构总量为7.4%,β-折叠结构总量为41.9%,β-转角结构为21.1%,无规则卷曲结构为29.6%。由以上数据可知β-折叠和无规则卷曲是其主要的二级结构单元,这与Meng等[15]采用拉曼光谱研究红豆球蛋白的二级结构组成得到的结果相似。从表1可知,随着辐照剂量的增加,α-螺旋和无规则卷曲结构发生明显变化,这是由于维持大豆蛋白分子螺旋结构的氢键(一个肽键的C==O和其前第3个肽键的N—H之间的氢键)断裂导致α-螺旋结构受到破坏,使α-螺旋结构含量下降,无规则卷曲含量升高。以上结果表明辐照诱导了维持蛋白二级结构的作用力改变,从而使4种结构的含量发生了变化。
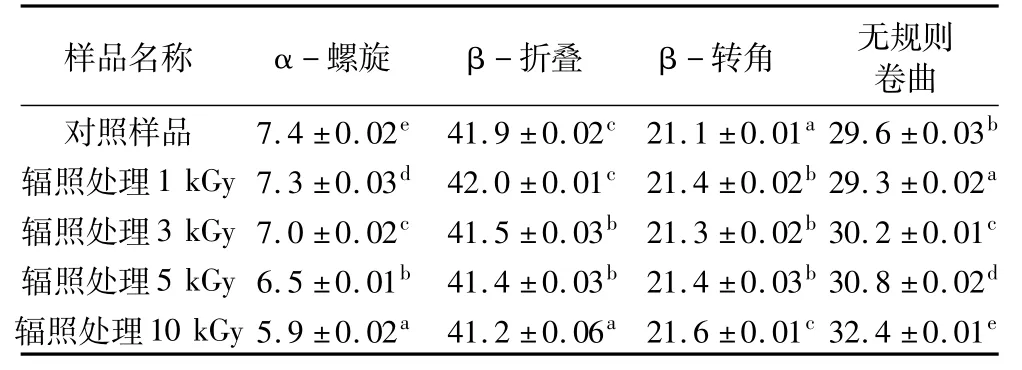
表1 对照样品和不同剂量辐照处理红豆分离蛋白的二级结构含量/%
2.2 荧光光谱
不同辐照剂量处理红豆分离蛋白荧光光谱的影响如图1和表2所示。红豆分离蛋白在290 nm处激发所得到的主要是色氨酸为发射基团的荧光光谱,可反映色氨酸残基的变化程度及其微环境的变化情况[16]。从图1可以看出低剂量辐照条件下,荧光强度有所降低,辐照剂量为5 kGy的条件,荧光强度最大,然后随着辐照剂量增大,荧光强度又呈现下降趋势。原因为蛋白质分子经过辐照处理后,其分子伸展,暴露出不同的生色基团,从而改变了荧光强度的大小,然而当辐照剂量持续增加,则蛋白会发生卷曲、折叠,又会使原本已经外露的生色基团内包于蛋白分子内部,发生荧光猝灭现象。从表2可以看出,经过辐照处理后的样品与对照组荧光发射峰位(332.5 nm)比较,辐照处理后的最大吸收值都变大了,即荧光光谱发生了红移现象。λmax的红移表明辐照使红豆分离蛋白的结构展开,分子内部的色氨酸残基逐渐暴露,其最大吸收波长λmax的分析结果与表面疏水性的分析结果相一致,进一步表明辐照会导致红豆分离蛋白结构的变化。

图1 对照样品和不同剂量辐照处理红豆分离蛋白的荧光光谱图

表2 不同辐照剂量处理红豆分离蛋白荧光光谱最大吸收值
由荧光光谱测试结果可知,辐照处理红豆分离蛋白,使得蛋白的二级和三级结构发生改变。此外,红豆分离蛋白分子整体结构复杂、芳香族氨基酸和荧光生色基团分布不均、蛋白分子伸展或折叠方式不同,在辐照处理下都会引起蛋白荧光强度的差异[17]。
2.3 粒径分布
不同辐照条件下红豆分离蛋白的粒径分布如图2所示,与对照样品相比,辐照剂量在1 kGy和3 kGy条件下,样品的粒径分布相似,都向粒度小的方向偏移。当辐照剂量增加到5 kGy时,样品粒径分布向粒度小的方向偏移更加明显[18],然而随着辐照剂量的进一步增加,样品的粒径分布却向粒度大的方向偏移,并且可以看出辐照剂量为10 kGy的样品,其粒径分布明显在对照样品粒径分布的右侧。上述现象可能是由于辐照处理引起红豆分离蛋白的分子结构展开,蛋白分子发生解聚,导致平均粒径变小;然后随着辐照剂量持续增加,暴露的疏水基团的相互作用生成可溶性聚集体,从而平均粒径变大。粒径分布的分析结果与溶解性的分析结果相一致,进一步说明了低剂量辐照处理有助于红豆分离蛋白溶解度的改善。
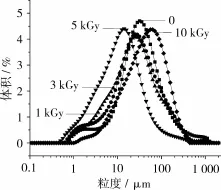
图2 对照样品和不同剂量辐照处理红豆分离蛋白的粒径分布图
2.4 表面疏水性
疏水相互作用对红豆分离蛋白结构的稳定和其功能性质具有重要的作用,是维持蛋白质三级结构的主要作用力。图3结果表明,与未处理的对照样品相比,经过不同剂量辐照处理的红豆分离蛋白表面疏水性都有显著增加,其中经5 kGy辐照处理的红豆蛋白表面疏水性最大。这是由于低剂量辐照条件破坏了蛋白质分子内部间的疏水相互作用,从而有利于聚集体内部二硫键形成,同时降低巯基团浓度,造成蛋白分子内部发生聚集[19],蛋白质分子内部疏水相互作用受到破坏,疏水性区域暴露到蛋白分子表面,导致蛋白的表面疏水性增加。当辐照剂量升高到10 kGy时,蛋白质分子之间通过疏水相互作用,形成蛋白分子聚集体,疏水基团包埋在聚集体内部,因此表面疏水性呈现下降趋势。

图3 对照样品和不同剂量辐照处理红豆分离蛋白的表面疏水性
2.5 溶解度测定
由图4可以看出,对照样品和不同剂量辐照处理红豆蛋白的溶解度变化,未处理的红豆分离蛋白的溶解度约为60%,通过辐照处理后,其溶解性得到了明显改善,当辐照剂量达到5 kGy时,溶解度得到最大上升,达到80%。但随着辐照剂量的进一步增加其溶解度有下降趋势。原因可能由于辐照处理导致蛋白质分子的原有结构破坏,使得多肽链裂解[20],从而体现在红豆分离蛋白溶解性的提高。但是随着辐照剂量的增加,蛋白分子结构展开,使埋藏分子内部的巯基和疏水基团进一步暴露,伸展的蛋白分子之间通过非共价键作用重新形成大分子聚集体,造成溶解度的下降[21]。

图4 对照样品和不同剂量辐照处理红豆分离蛋白的溶解度
3 结论
不同剂量辐照处理红豆分离蛋白,随着辐照剂量的增加,红豆分离蛋白的分子结构和功能都发生不同程度的变化。圆二色光谱分析表明,随着辐照剂量的增加,红豆分离蛋白的二级结构各部分含量发生变化,主要呈现α-螺旋结构向无规则卷曲结构的转变。荧光光谱分析表明,最大吸收波长λmax的红移程度随着辐照剂量的增加表现出先增大后减小的趋势,表明红豆分离蛋白中Trp残基所处微环境极性先增强后减弱,这与其表面疏水性呈现正相关。流体粒径分析表明,随着辐照剂量的增加,蛋白颗粒体积呈现的是先减小后增大趋势,在5 kGy辐照剂量处理时达到最小,与其溶解性呈现负相关。
[1]余文慧.药食兼优赤小豆[J].药膳食疗,2004(8):43
[2]韩涛,孙献军,李丽萍,等.红小豆蛋白与淀粉的提取和分离初探[J].食品工业科技,1997(5):43-45
[3]李杨,江连洲,刘琪,等.酶法水解红豆粉特性的研究[J].食品工业科技,2011(11):177-180
[4]马以桂,徐力平.中国检疫处理需要辐照技术[J].口岸卫生控制,2002,7(6):3-7
[5]胡少新.我国食品辐照技术研究进展[J].黑龙江农业科学,2011(8):149-151
[6]Vaz AFM,Souza MP,Medeiros PL,et al.Low-dose gamma irradiation of food protein increases its allergenicity in a chronic oral challenge[J].Food and Chemical Toxicology,2013,51:46-52
[7]Kasera R,Singh A B,Kumar R,et al.Effect of thermal processing andγ-irradiation on allergenicity of legume proteins[J].Food and Chemical Toxicology,2012,50(10):3456-3461
[8]朱佳廷,冯敏,刘春泉,等.大豆蛋白粉的辐照灭菌研究[J].核农学报,2008,22(5):645-649
[9]Greenfield H J.Methods to estimate the conformation of proteins and polypeptides from circular dichroism data[J].Analytical Biochemistry,1996,235:1-10
[10]张涛,江波,王璋.鹰嘴豆分离蛋白质的特性[J].食品与生物技术学报,2005,24(3):66-71
[11]Sreerama N,Woody R W.Estimation of protein secondary structure from circular dichroism spectra:comparison of CONTIN,SELCON,and CDSSTR methods with an expanded reference set[J].Analytical Biochemistry,2000,287:252-260
[12]尹寿伟.芸豆蛋白的物化修饰及相关构效机理研究[D].广州:华南理工大学,2009
[13]王辰,江连洲,魏冬旭,等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学,2012,33(9):54-57
[14]Samoto M,Maebuchi M,Miyazaki C,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1):317-322
[15]Meng G T,Ma C Y,Phillips D L.Raman spectroscopic study of globulin from Phaseolus angularis(red bean)[J].Food Chemistry,2003,81:411-420
[16]陶慰孙,李惟,姜涌明.蛋白质分子基础[M].北京:高等教育出版社,1995:260-263
[17]刘斌,马海乐,李树君,等.超声波处理对脱脂麦胚分离蛋白结构的变化研究[J].光谱学与光谱分析,2011,31(8):2220-2225
[18]黄科礼,尹寿伟,杨晓泉.微射流处理对红豆分离蛋白结构及功能特性的影响[J].现代食品科技,2011,27(9):1062-1065
[19]莫耽,黄行健,段雅庆,等.辐照对大豆分离蛋白功能特性影响[J].食品科学,2011,32(1):52-55
[20]陈洁,盛奎川,常蕊,等.辐照处理对玉米醇溶蛋白流变性的影响[J].材料科学与工程学报,2011,29(2):263-266
[21]张振山,刘玉兰,王娟娟,等.辐照对大豆中蛋白质品质的影响[J].食品工业科技,2013,34(2):104-107.
Different Iradiation Dose on the Structure and Functional Effects of Red Bean Protein Isolates
Chen Yong1Wang Jing1Jiang Lianzhou1,2Li Yang1,2Wang Xiao1Wang Zhongjiang1
(College of Food Science,Northeast Agricultural University1,Haerbin 150030)(National Research Centre of Soybean Engineering And Technology2,Haerbin 150030)
Different irradiation dose had been researched by Lowery,ANSfluorescence probe method,circular dichroism and fluorescence spectrum.The results showed that the alpha helix structure was changed into random coil,with the increase of irradiation dose.The micro environment polarity of Trp residue increased first and then decreased,which indicated the positive correlation with surface hydrophobicity.Protein particle size decreased first and then increased with the increasing of irradiationdose.When the irradiation dose was 5 kGy,the size of protein particle reduced to the minimum.The protein particle size had negative correlation with the solubility of red bean protein isolates.
irradiation,red bean(Phaseolus angularis)protein isolates,proteins structure,functional property,circular dichroism
TS214.9
A
1003-0174(2015)04-0039-05
黑龙江省青年基金(QC2013C014)
2013-12-17
陈勇,男,1988年出生,硕士,食品工程
江连洲,男,1960年出生,教授,博士生导师,粮食、油脂与植物蛋白工程
