微波辅助水酶法提取番茄籽油工艺优化及理化特性研究
2015-12-19任彦荣
王 强 王 存 王 睿 任彦荣
(重庆第二师范学院生物与化学工程系,重庆 400067)
微波辅助水酶法提取番茄籽油工艺优化及理化特性研究
王 强 王 存 王 睿 任彦荣
(重庆第二师范学院生物与化学工程系,重庆 400067)
以番茄籽为原料提取番茄籽油,通过响应面法优化微波辅助复合酶法提取番茄籽油(MEOs)工艺,并建立回归模型;同时研究了MEOs的理化特性、脂肪酸组成和抗氧化活性,并与传统索氏提取番茄籽油(SEOs)进行比较。结果表明,采用复合酶(纤维素酶∶果胶酶∶蛋白酶=1∶1∶1)的最佳提取工艺为酶添加量1.5%、温度35℃、时间40 min、微波功率500 W,在此条件下MEOs得率为29.65%;MEOs与SEOs在理化特性方面没有显著区别,但MEOs含有较高的生育酚,同时具有较高的氧化稳定性。MEOs表现出较强的抗氧化活性,在DPPH·和β-胡萝卜素-亚油酸测试体系中其IC50分别为9.52和10.64 mg/mL。MEOs是一种理想的天然保健食品原料,具有较好的开发利用前景。
番茄籽油 微波辅助水酶法提取 理化特性 抗氧化活性
番茄是一种重要的蔬菜作物,番茄产品深加工过程中产生了大量废弃物,其中约60%是番茄籽[1]。因此,如何高效利用这些番茄籽成为副产物深加工业亟待解决的问题[2]。目前国内外由于缺乏相应的番茄籽深加工技术,番茄籽基本上用作饲料和肥料,资源利用率低[1-2]。番茄籽中含有丰富的油脂,同时番茄籽油还富含生育酚和植物甾醇等生物活性成分,是一种优质的食用植物油资源。
微波辅助水酶法通过机械和酶解双重手段降解植物细胞壁,使油脂释放出来。采用纤维素酶、蛋白酶、果胶酶等生物酶制剂破坏油料的细胞壁结构,可有效提高油料油脂的提取率[3-4]。在水酶法应用基础上,微波处理可以减少溶剂提取时的传质阻力,使其内部压力超过细胞壁膨胀承受限值,导致细胞壁破裂,细胞内有效成分流出,在较低的温度条件下即可溶于介质中,参与化学反应。与传统单一提取技术相比,微波辅助水酶法提取植物油脂具有诸多优点:油脂得率和品质高,工艺条件和技术设备简单,能耗低;资源的综合利用率高,有利于油脂工业的绿色发展[5-7]。采用微波辅助水酶法提取番茄籽油,目前鲜有报道。本研究对番茄籽油的微波辅助水酶法提取工艺及其理化特性进行了研究,以期为番茄籽资源的开发利用和番茄籽油的生产加工提供参考。
1 材料与方法
1.1 材料与仪器
番茄籽:新疆鸿翔番茄制品有限责任公司;DPPH·:美国Sigma-Aldrich公司;纤维素酶、果胶酶、蛋白酶、淀粉酶:诺维信(中国)生物技术有限公司。
MAS-II常压微波合成/萃取反应工作站:上海新仪微波化学科技有限公司;DHG-9240A电热恒温鼓风干燥箱:上海齐欣科学仪器有限公司;FA2004A型分析天平:上海精天科贸有限公司。
1.2 方法
1.2.1 原料预处理方法
将番茄籽样品冷冻过夜置于冷冻干燥机(-50℃,100 Pa)中干燥。各样品均干燥至含水量约为8%。干燥样品进行粉碎,将番茄籽粉(>100目)真空密封后置于常温干燥器中以待分析。
1.2.2 番茄籽油的提取
1.2.2.1 微波辅助水酶法提取番茄籽油(MEOs)
参照Jiao等[8]的微波辅助水酶法提取工艺,番茄籽粉末(20 g)→灭酶→冷却→设定微波辅助水酶法处理条件(料液比10∶1;pH 5;仪器搅拌速率5 000 r/min)→离心分离→清油。MEOs的精炼方法见文献[9]。MEOs得率=提取的番茄籽油/番茄籽原料干重×100%。
1.2.2.2 索氏提取番茄籽油(SEOs)
取干燥粉碎后的番茄籽,以正己烷(≥98.5%)作溶剂,用索氏提取器提取5 h,在干燥箱(温度为(75±2)℃)中挥干残留溶剂,得SEOs。SEOs的精炼方法见文献[9]。
1.2.3 单因素和响应面试验设计
根据前期试验结果,在料液比10∶1、pH 5和仪器搅拌速率5 000 r/min的条件下研究酶的种类及添加量(%,m/m)、温度(℃)、时间(min)和微波功率(W)对MEOs得率的影响。单因素固定条件为:酶的种类为纤维素酶∶果胶酶∶蛋白酶 =1∶1∶1,复合酶添加量1%、温度45℃、时间70 min和微波功率350 W;选取复合酶添加量、温度、时间和微波功率为自变量,MEOs得率为响应值(Y),根据Box-Behnken design(BBD)原理,进行四因素三水平的响应面分析试验。
1.2.4 番茄籽油理化特性分析方法
比重参考GB/T 5526—1985;折光指数参考GB/T 5527—2010;皂化值参考 GB/T 5534—2008;过氧化值(PV)和酸价按GB/T 5009.37—2003规定的方法测定;碘值按GB/T 5532—2008规定的方法测定;β-茴香胺值(p-AV)参照 GB/T 24304—2009测定。共轭二烯烃(CD,λ232nm)采用IUPAC method II的紫外光谱测定方法[10]。总生育酚(TT)含量采用Wong等[11]报道的比色法测定,TT含量以“mgα-生育酚/kg番茄籽油”表示。
1.2.5 脂肪酸组成分析
1.2.5.1 样品甲酯化 准确量取3 mL番茄籽油,加入5 mL氢氧化钾甲醇溶液(0.5 mol/L),水浴处理(70℃,10 min)至油珠完全消失,冷却后加3 mL三氟化硼甲醇溶液(14%),70℃水浴5min,冷却,加正己烷2 mL和饱和氯化钠溶液2 mL,离心分层,上清液供GC-MS分析用。
1.2.5.2 色谱条件 DB-1毛细管柱(30 m×0.25 mm,0.25μm),载气为 N2,流速14.4 mL/min,进样量:1μL,分流比为 60∶1;升温程序:初始温度 150℃,保持10 min,以0.75℃/min的速率升温到205℃,再以2℃/min速率升温至240℃,保持10 min。质谱条件:采用GC-MS全扫描模式,质量扫描范围为m/z33~450;电离方式:电子轰击;电子能量:70 eV;离子源温度:230℃。积分方法采用面积归一法。
1.2.6 清除DPPH自由基方法
参照 Kalantzakis等[12]测定方法,将浓度为10-4mol/L DPPH·乙酸乙酯溶液4 mL与不同浓度(0~30 mg/mL)的番茄籽油乙酸乙酯溶液(10%)1 mL混匀后于波长517 nm处测定吸光度Ai;将 DPPH·4 mL与体积分数为10%的乙酸乙酯1 mL混匀后测定吸光度Ac,将不同浓度的样品溶液1 mL与乙酸乙酯4mL混匀后测定吸光度Aj,按式(1)计算DPPH·清除率,并求相应的IC50值。
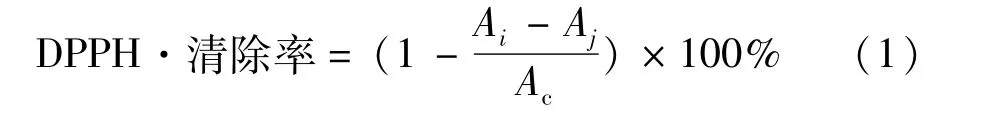
1.2.7 β-胡萝卜素-亚油酸测试
250 mL旋转蒸发瓶中加入1.0 mL 0.2 mg/mL的β-胡萝卜素氯仿溶液,再依次加入25μL亚油酸和200 mg吐温 -40,混合均匀后,旋转蒸发氯仿,然后加入100 mL氧饱和蒸馏水,剧烈振荡即得反应液。取上述反应液2 400μL加入反应管中,加入不同浓度梯度的待测样品溶液100μL。在470 nm处测定起始吸光度,50℃温育2 h后再测定吸光度。以不加样品溶液的β-胡萝卜素-亚油酸体系作为空白对照[13]。对过氧化抑制率按式(2)计算。并求相应的IC50值。

式中:Acontrol-0、Acontrol-120为空白样品起始和温育2 h后的吸光度;Asample-0、Asample-120为待测样品起始和温育2 h后的吸光度。
1.3 数据统计分析
通过Design-Expert 7.1.6软件(STAT-EASE Inc.,Minneapolis,USA)对响应面数据进行多元回归分析,建立多元回归方程。采用SPSS 17数据处理软件,各组数据结果均以平均值±SD(n=3)表示,并进行方差分析,LSD法进行多重比较,P<0.05表示差异具有显著性。
2 结果与分析
2.1 酶的种类及添加量、温度、时间和微波功率对MEOs的影响
在水酶法提取食用油脂的工艺中,生物酶的选择是影响油脂产量和品质的重要因素[14]。如图1a所示,与对照组(16.36%,不添加生物酶)相比,不同种类生物酶处理对MEOs得率有显著影响(P<0.05),其中复合酶(纤维素酶∶果胶酶∶蛋白酶 =1∶1∶1)提取 MEOs的得率最高,达到(24.23±0.54)%,效果最差的是淀粉酶。其可能原因是在微波辅助水酶法提取过程中,番茄籽细胞壁及细胞间层的纤维素、蛋白质和果胶质形成的阻挡层己被纤维素酶和果胶酶有效破解,提高了油脂的溶出;同时蛋白酶渗透到脂质体膜内,以及蛋白酶对脂多糖、脂蛋白的分解作用,有利于油脂从复合体中释放。国内外研究发现,复合酶能够更好地瓦解细胞壁及其内部结构,提高油料的提取率,比单酶的使用效果好[8,14-15]。
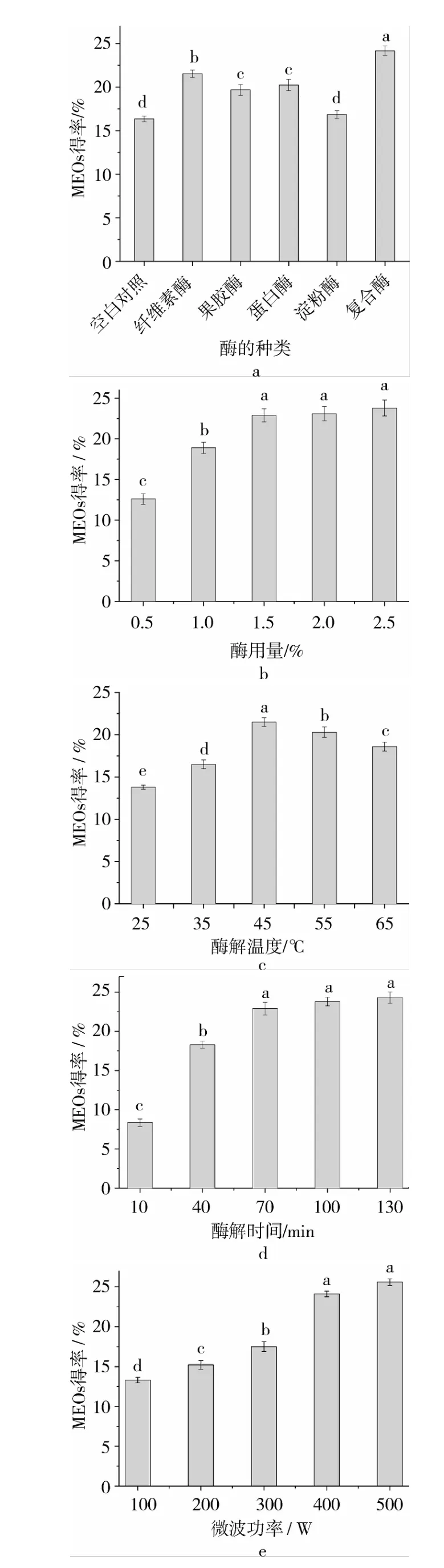
图1 不同因素对MEOs得率的影响
在复合酶条件下,考察各因素对MEOs得率的影响。酶添加量不仅直接关系到提取率的高低,还涉及到生产成本等问题[16]。由图1b可知,随着酶用量的增加,MEOs得率逐渐从12.6%增加到22.9%,但当酶用量超过1.5%时,MEOs得率增大不显著。
升高温度能够提高反应体系的活化能进而提高反应速率,但过高的温度又会使酶失活,因此适当的反应温度十分重要[17]。设定不同的反应温度,结果见图1c。随着酶解温度的增大,MEOs先增大后降低,当酶解温度为45℃时MEOs得率达到最大值21.5%,当酶解温度进一步增加时,MEOs得率降低;这可能是由于酶解温度增高,提取体系分子运动加快,溶出速度也加快,有利于MEOs溶出;但酶解温度过高,酶的活性降低,甚至失活,同时杂质的溶出也增多。因此,选取45℃为酶解反应的温度。
由图1d可知,随着酶解时间的增大,MEOs得率先增大而后趋于平缓,但当酶解时间超过70 min时,MEOs得率增大不显著。由图1e可以看出,微波功率在100~500 W范围内升高,MEOs得率随之提高,之后随着酶添加量的增加,提取量不再继续提高。随着微波功率的提高,出油率增加,这是微波能量使细胞壁疏松甚至破裂、番茄籽细胞中蛋白质变性等因素增加了细胞的通透性,以便于酶作用,从而提高了出油率。因此,选取400 W为合适的微波功率。
2.2 响应面优化微波辅助水酶法提取MEOs工艺参数
在单因素试验的基础上,利用Design-Expert软件中BBD设计方法,可获得MEOs得率的四因素三水平试验设计及结果(见表1)。对表1中的数据进行方差分析,结果见表2。从表2可知,MEOs得率影响因素中一次项A、B、C和D,交互项AC、BD、AD、BC和CD以及二次项A2、B2、C2和D2均表现出了显著水平,仅交互项AB不显著,即交互项AB对MEOs得率影响忽略不计(即回归方程中剔除不显著项),因此可建立如下二次回归方程:
Y=24.73+1.87A+1.35B-1.91C+1.32D-1.37AC-2.67AD+3.74BC-1.32BD-2.94CD-4.20A2-1.23B2-2.07C2-1.66D2
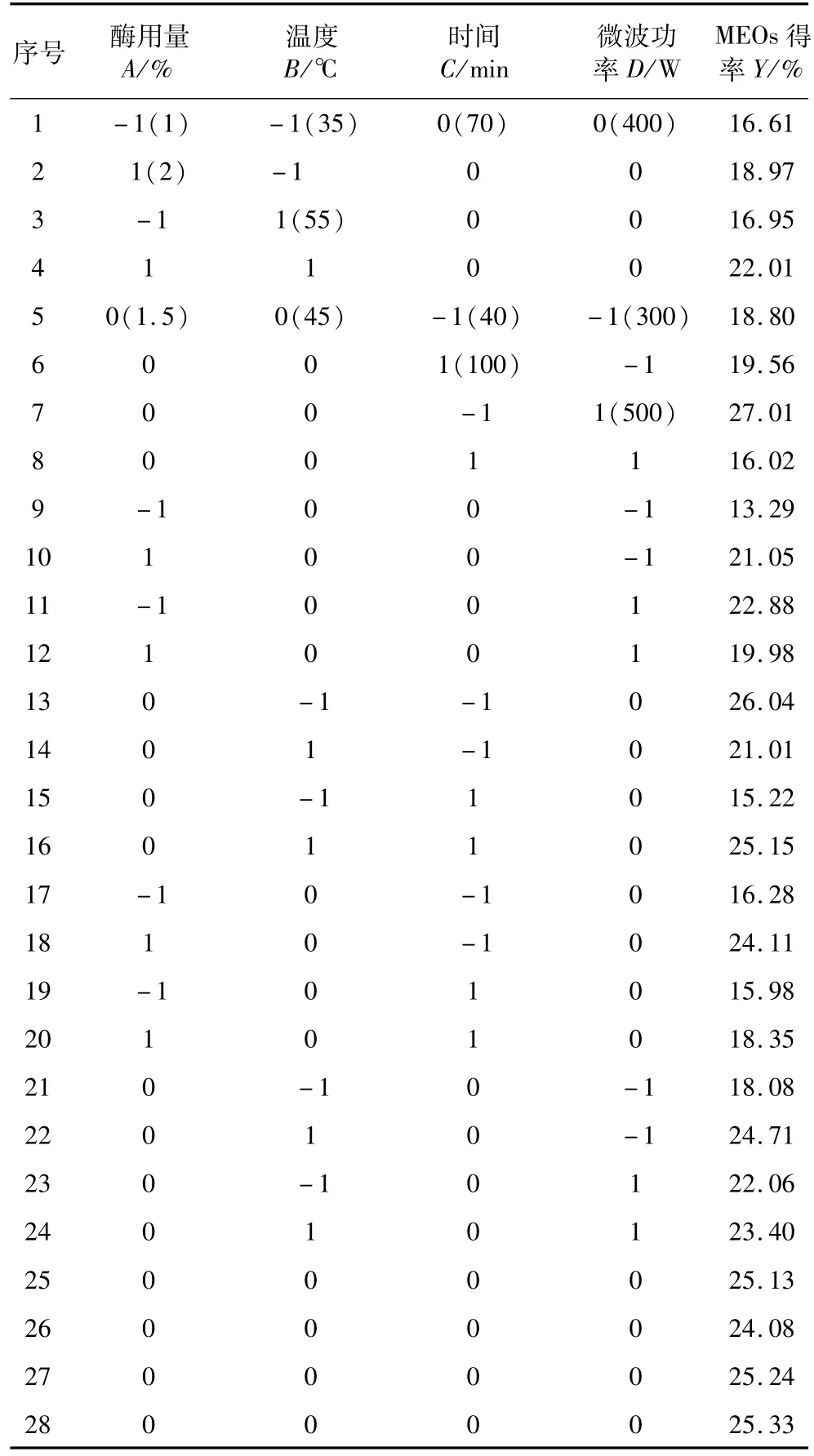
表1 响应面分析方案及试验结果
从表2中还可以看出,二次回归方程整体模型极显著,并且失拟项不显著,说明该回归模型与实测值能较好地拟合。进一步对该回归方程进行显著性检验发现,回归方程决定系数R2和校正决定系数分别为0.950 3和0.900 7,均大于0.90,说明模型相关度很好。
通过固定其他2个影响因素条件为“0”水平,对建立的预测MEOs得率回归模型进行降维分析,结果为酶添加量1.5%、温度35℃、时间40 min、微波功率500 W,在此条件下MEOs得率预测值达到最大值29.65%。为了验证试验结果提供方案的可行性,按响应面优化试验确定的工艺条件进行验证,将预测值与实测值进行比较并计算偏差,两者偏差仅为1.72%,证明所得到拟合方程可以较好地描述工艺中各因素与评价指标的关系。
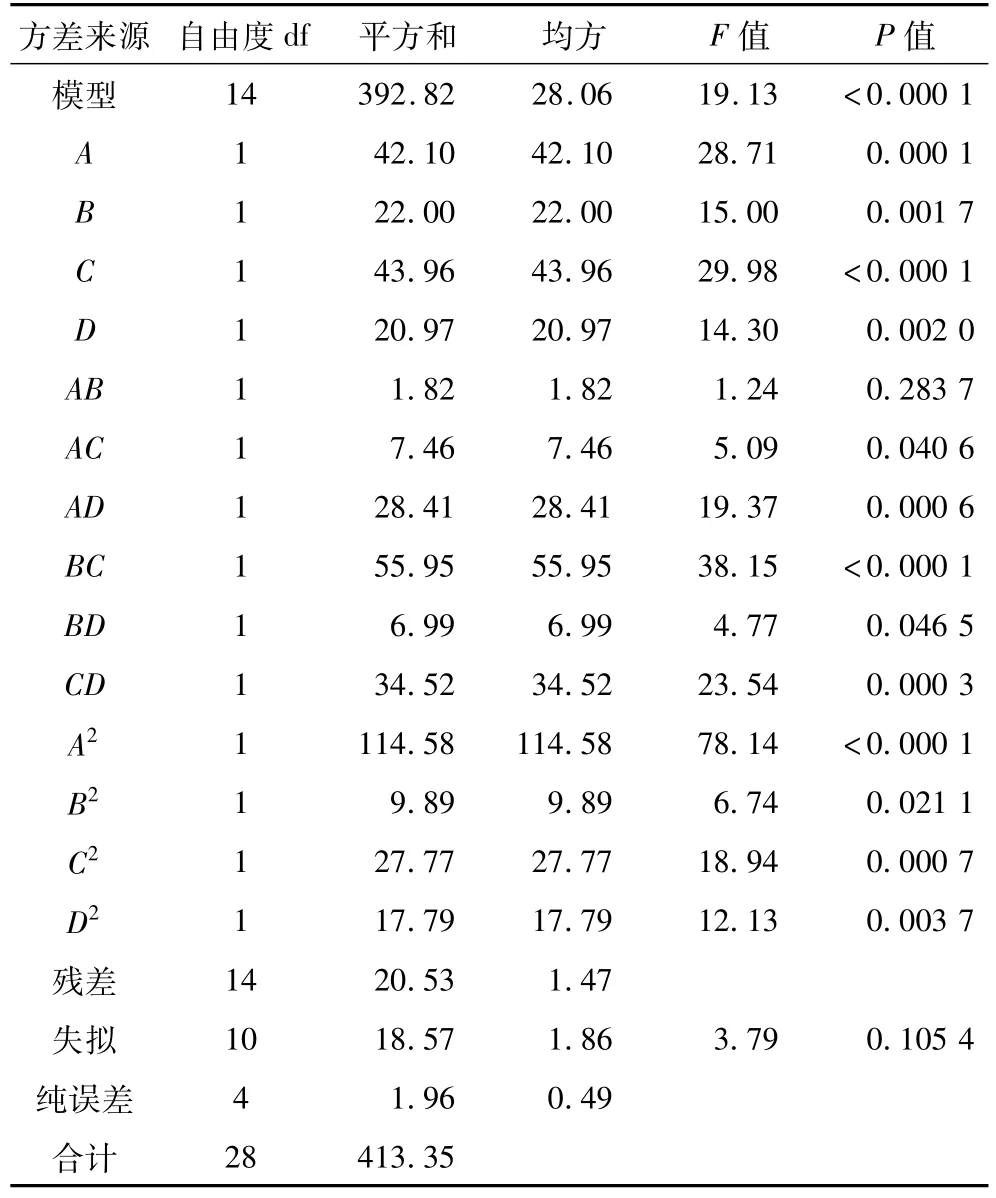
表2 甜菜粗多糖得率回归方程的方差分析表
2.3 MEOs和SEOs理化特性和脂肪酸组成分析
MEOs与SEOs的理化特性如表3所示,其中折射率、皂化值和碘值等指标与董海洲等[9]报道一致。MEOs与SEOs的折射率、比重、酸值、过氧化值(PV)和皂化值等指标没有显著性差异,但MEOs的折射率略高于SEOs,可以得出其脂肪酸组成中含有大量不饱和双键,具有较高的开发利用价值[18];MEOs的碘值(127.15±0.93)gI/100 g油显著高于 SEOs(116.34±0.82)gI/100 g油,同样也说明了 MEOs具有较高的不饱和脂肪酸。MEOs的酸值和PV低于SEOs,说明MEOs具有较高的氧化稳定性;MEOs的β-茴香胺值(p-AV)和共轭二烯烃(CD)均显著低于SEOs,同样说明MEOs具有较高的氧化稳定性。PV是油脂初始氧化反应的产物,大部分初始氧化产物都分解成酮醛等有害物质;而p-AV反映的是油脂氧化时二次氧化产物的含量,p-AV是评价油脂二次氧化最好的方法[19]。CD是不饱和脂肪酸的双键被氧化而产生的初级氧化产物,常使用紫外吸收光谱测定在波长232 nm共轭烯烃的含量来确定食用油氧化程度。CD和PV并不是同一种指标,通过对共轭烯烃的测定,能从微观上更好的说明 PV变化[20-21],所以通过对烯烃的测定能够确定油脂高温时氧化的程度。此外,MEOs中的总生育酚含量(901.31±10.33)mgα-生育酚/kg番茄籽油显著高于SEOs中的含量(623.17±9.26)mgα-生育酚/kg番茄籽油,其可能原因在于微波辅助水酶法以机械和生物酶的手段来破坏番茄籽细胞壁,使其中生育酚得以释放。
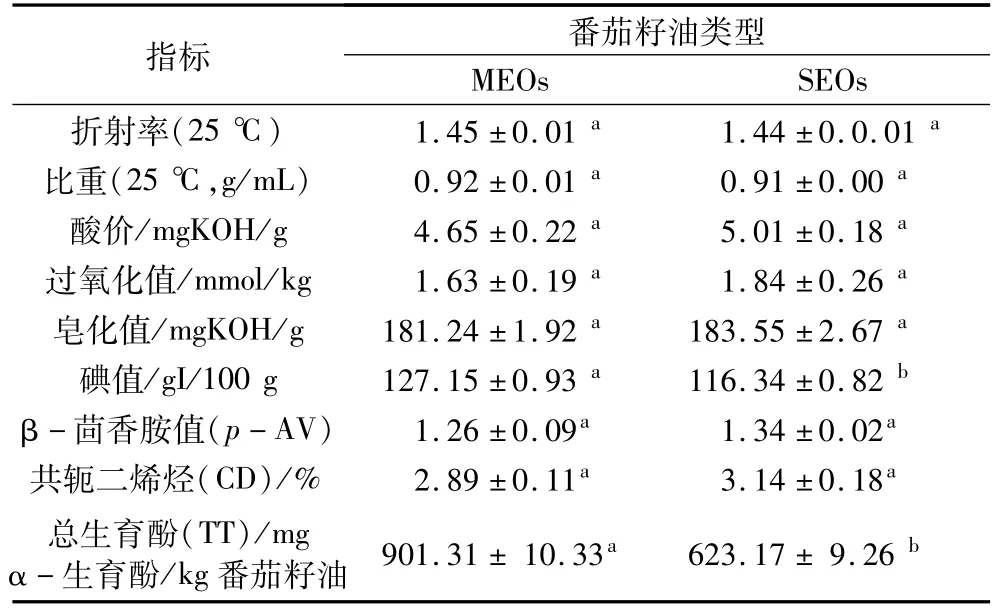
表3 MEOs和SEOs理化特性
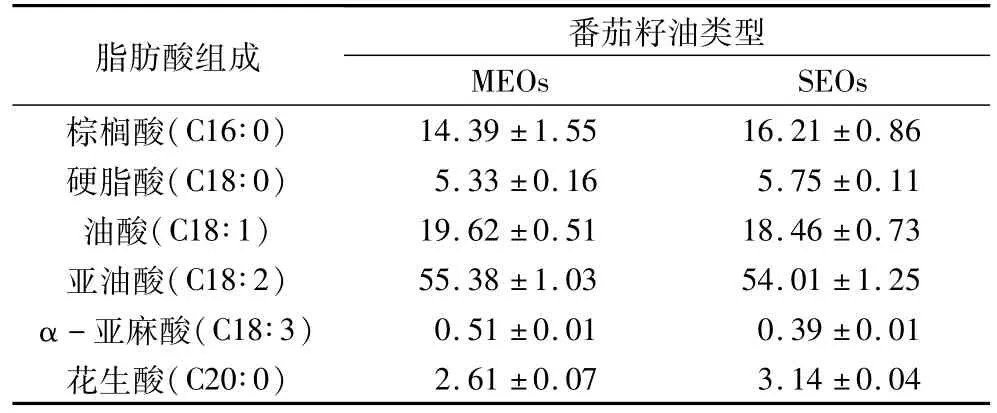
表4 MEOs和SEOs脂肪酸组成
微波辅助水酶法和索氏法提取的番茄籽油脂肪酸组成见表4,MEOs和SEOs脂肪酸均主要由棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)、α-亚麻酸(C18∶3)和花生酸(C20∶0)组成;其中MEOs饱和脂肪酸(棕榈酸、硬脂酸和花生酸)总量低于索氏提取的番茄籽油,而不饱和脂肪酸(UFAs)总量高于SEOs,说明在微波辅助水酶法提取过程中,不饱和脂肪酸甘油酯更容易被萃取出来。含量较高的UFAs有预防心血管疾病、延缓人体衰老等保健作用[22-23],作为一种富含 UFAs功能性油脂,MEOs具有很好的营养保健功效,营养价值比较均衡。
2.4 MEOs和SEOs抗氧化能力分析
1,1-二苯基-2-苦基肼自由基(DPPH·)是合成的以氮为中心的稳定自由基,反应容易控制,已广泛应用于各种植物提取物或纯化合物的抗氧化活性的评价和筛选[24]。MEOs和SEOs清除DPPH·能力如图2a所示,MEOs和SEOs清除DPPH·的活性具有相似的趋势,但MEOs清除DPPH·的能力均大于SEOs。由图2b可知,MEOs和SEOs在β-胡萝卜素-亚油酸测试体系中表现出差异的抗脂质过氧化能力,二者均呈现量效关系,但MEOs抗脂质过氧化能力均强于SEOs,表现出与MEOs清除DPPH·相似的趋势。MEOs抗氧化能力强于SEOs,其主要原因在于MEOs中含有较高的生育酚和不饱和脂肪酸,MEOs和SEOs抗氧化能力与其生育酚和不饱和脂肪酸含量具有较高的相关性。
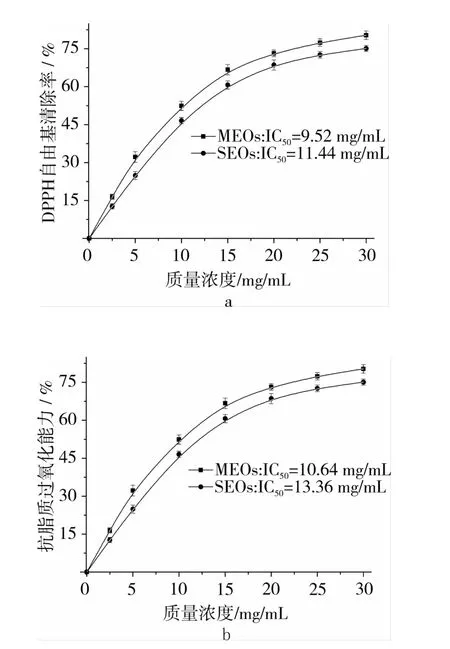
图2 MEOs和SEOs清除DPPH·和抗脂质过氧化效果
3 结论
3.1 微波辅助水酶法提取番茄籽油的最佳工艺条件是:复合酶(纤维素酶∶果胶酶∶蛋白酶 =1∶1∶1)添加量1.5%、温度34℃、时间40 min、微波功率500 W,在此条件下MEOs得率为29.65%。
3.2 MEOs与SEOs在理化特性方面没有显著区别,但MEOs含有较高的生育酚,同时表现出较强的抗氧化活性,在DPPH·和β-胡萝卜素-亚油酸测试体系中其IC50分别为9.52和10.64 mg/mL,说明MEOs具有较高的氧化稳定性和抗氧化能力,MEOs在食品工业中具有较好的应用前景。
因此,利用微波辅助水酶法提取番茄籽油,方法操作和仪器设备简单,具有无毒、无害、可避免产物氧化等优点,是一种提取植物油脂的好方法。
[1]贾雪峰,吴洪斌.番茄籽油的提取及其影响因素和生理活性研究进展[J].中国食品添加剂,2013(1):203-207
[2]Sogi D S,Bhatia R,Garg SK,etal.Biologicalevaluation of tomato waste seed meals and protein concentrate[J].Food Chemistry,2005,89:53-56
[3]刘颖,周利娟,王欣.生物酶法提取葡萄籽油的工艺研究[J].食品科学,2006,27(12):518-520
[4]江连洲,李杨.水酶法提取大豆油的研究进展[J].食品科学,2013,34(9):346-350
[5]陈德经.微波预处理水酶法提取茶叶籽油工艺优化[J].食品科学,2012,33(6):87-91
[6]李大房.水酶法制取油脂研究进展[J].中国油脂,2006,31(10):29-32
[7]张春红,许宁.纤维素酶-微波辅助提取软枣猕猴桃茎黄酮的工艺优化[J].食品科学,2012,33(8):24-28
[8]Jiao J,Li ZG,Gai Q Y,et al.Microwave-assisted aqueous enzymatic extraction ofoil from pumpkin seeds and evaluation of its physicochemical properties,fatty acid compositions and antioxidant activities[J].Food Chemistry,2014,147:17-24
[9]董海洲,张绪霞,刘传富,等.番茄籽油的提取研究[J].中国粮油学报,2007,22(6):113-117
[10]IUPAC.Standard methods for the analysis of oils,fats,and derivatives,7th edn.Blackwell Scientific Publication,Oxford,1987
[11]Wong M L,Timms R E,Goh EM.Colorimetric determination of total tocopherols in palm oil,olein and stearin[J].Journal of the American Oil Chemists'Society,1988,65:258-261
[12]Kalantzakis G,Blekas G,Pegklidou K,et al.Stability and radical-scavenging activity of heated olive oil and other vegetable oils[J].European Journal of Lipid Science and Technology,2006,108(4):329-335
[13]Yesilyurt V,Halfon B,Ozturk M,et a1.Antioxidant potential and phenolic constituents of Salvia cedronella[J].Food Chemistry,2008,108:31-39
[14]罗明亮,申爱荣,蒋丽娟.生物酶的选择对水酶法提取蓖麻油的影响[J].中南林业科技大学学报,2013,33(9):55-59
[15]GaiQ Y,Jiao J,Mu PS,etal.Microwave-assisted aqueous enzymatic extraction of oil from Isatis indigotica seeds and its evaluation of physicochemical properties,fatty acid compositions and antioxidant activities[J].Industrial Crops and Products,2013,45:30-311
[16]Yu X,Sun D,Li X.Preparation of levulinic acid using cellulose and solid acids ynergistic hydrolysis for rice straw[J].Asian Journal of Chemistry,2010,22(9):7113-122
[17]GaiQ Y,Jiao J,Wei F Y,et al.Enzyme-assisted aqueous extraction of oil from Forsythia suspense seed and its physicochemical property and antioxidant activity[J].Industrial Crops and Products,2013,51(5):274-278
[18]李志西,李元瑞,于修烛,等.苹果籽及其油的理化特性研究[J].中国油脂,2005,30(11):71-73
[19]Ying Z,Lei Y,Yuangang Z,et al.Oxidative stability of sunflower oil supplemented with carnosic acid compared with synthetic antioxidants during accelerated storage[J].Food Chemistry,2010,118:656-662
[20]Gutierrez R,Quijano G,Dobarganes M C,et al.Frying of food:principles,changes,new app roaches[M].Chichester:Ellis Horwood,1988:141-154
[21]Melton S L,Jafar S,Sykes D,et al.Review of stability measurements for frying oils and fried food flavor[J].Journal of the American Oil Chemists'Society,1994,71:1301-1308
[22]王萍,张银波,江木兰.多不饱和脂肪酸的研究进展[J].中国油脂,2008,33(12):42-46
[23]王雪青,苗惠,胡萍.膳食中多不饱和脂肪酸营养与生理功能的研究进展[J].食品科学,2004,25(11):337-339
[24]熊双丽,卢飞.DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J].食品工业科技,2012,33(8):380-383.
Microwave-Assisted Aqueous Enzymatic Extraction of Oil from Tomato Seed and Evaluation of Its Physicochemical Properties
Wang Qiang Wang Cun Wang Rui Ren Yanrong
(Department of biological and Chemical Engineering,Chongqing University of Education,Chongqing 400067)
Response surfacemethodology has been applied to optimize the microwave-assisted aqueous enzymatic extraction of oil from tomato seeds(MEOs).The physicalchemical compositions,fatty acid compositions and antioxidant activities of MEOs have been compared with that features of soxhlet-extracted oil(SEOs).The optimal extraction conditionswas found to have enzyme concentration of1.5% (cellulase,pectinase and proteinase:1∶1∶1),temperature of 35℃,time of 40 min and irradiation power of 500 W.On the conditions,the extraction yield of MEOs could reach 29.65%.Moreover,there were no significant variations in physicochemical properties of MEOs and SEOs,while MEOs had the higher tocopherols and exhibited the better oxidation stability.MEOs showed the stronger antioxidant activitieswith IC50values of9.52 and 10.64 mg/mL according to DPPH radical scavenging assay andβ-carotene/linoleic acid bleaching test.MEOs shall be a fine nutritionalmaterial which has wide prospects in health food fields.
tomato seed oil,microwave-assisted aqueous enzymatic extraction,physicochemical properties,antioxidant activity
TS214.2
A
1003-0174(2015)10-0043-07
重庆市应用开发计划(cstc2014yykfA80009),重庆高校创新团队建设计划(KJTD201325)
2014-05-09
王强,男,1982年出生,副教授,油脂化学、抗氧化自然资源利用与生理生化
