恶性肿瘤患者并发脑梗死机制分析
2015-12-19黄健康
黄健康 韩 萌
上海交通大学附属第六人民医院神经内科 上海 200233
脑梗死和肿瘤在老年人中均有较高的发病率,预后差,临床工作中恶性肿瘤患者出现急性脑梗死的病例并不少见,脑梗死的发生导致肿瘤患者预后明显恶化。这部分患者与普通脑梗死患者比较,其脑梗死危险因素及临床表现有其特点。由于新药研发的进展及医疗水平的不断进步,恶性肿瘤患者治疗效果有明显改善,肿瘤病人带瘤生存质量较以往有明显提高,对肿瘤患者脑梗死的相关因素进行分析将有助于改善患者预后。
1 资料与方法
1.1 一般资料 我院2008-01-2014-07共收治恶性肿瘤并发脑梗死患者67例,男30例,女37例;年龄38~72岁,平均58.6岁;包括肺癌12例,结直肠癌11例,胃癌10例,原发性肝癌7例,食管癌6例,妇科肿瘤11例,血液系统肿瘤4例,胆囊癌3例,甲状腺癌乳腺癌鼻咽癌各1例。健康中心体检者67例,男40例,女27例;年龄36~76岁,平均57.2岁;无恶性肿瘤的普通脑梗死67例,男40例,女27例;年龄40~75岁,平均59.4岁;3组患者年龄构成差异无统计学意义(P>0.05)。脑梗死纳入标准:(1)符合脑梗死临床表现,头颅MRI显示有急性或亚急性脑梗死病灶;(2)恶性肿瘤患者需有完整病史并经病理学检查确诊。排除标准:(1)脑内有肿瘤转移灶患者;(2)有心律失常史;(3)肿瘤临床已治愈病例。
1.2 研究方法 统计各组中脑梗死相关危险因素,包括糖尿病、高血压、吸烟及饮酒史、房颤史,并分析相关实验室指标,包括D-二聚体、纤维蛋白原、血小板计数及同型半胱胺酸水平。对所有肿瘤伴脑梗死及普通脑梗死组患者头颅MRI梗死病灶的部位进行统计分析,按单一病灶及多发病灶进行比较,多发病灶又分同侧前循环、后循环、双侧前循环及同侧前后循环。
1.3 数据处理 采用SPSS 22.0数据包进行统计学分析,计量资料以均数±标准差表示,采用t检验,计数资料以百分率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组间脑梗死危险因素及实验室指标比较 肿瘤组高血压、糖尿病、房颤比率及胆固醇水平明显低于普通脑梗组(P<0.05或P<0.01),与体检对照组相比无明显差异,肿瘤并发脑梗组患者D-二聚体及纤维蛋白原水平明显高于普通脑梗组及体检对照组,3组血小板水平大致相同,吸烟及饮酒史比例无明显差异。见表1。
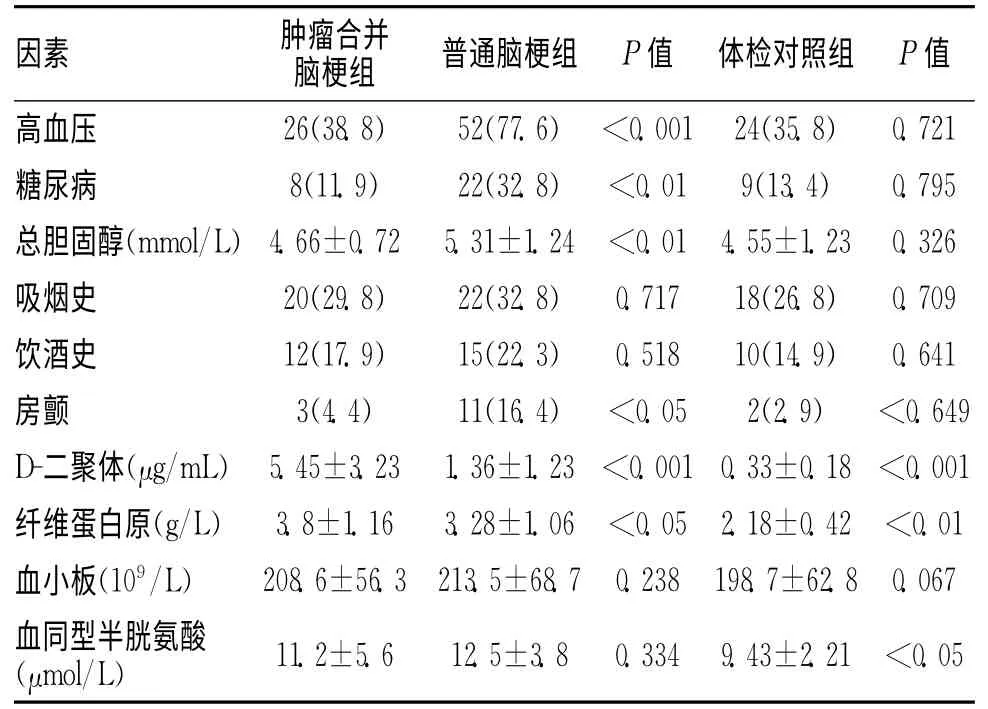
表1 各组间脑梗死危险因素及实验室指标比较 [n(%)]
2.2 脑梗病灶分布特点分析 肿瘤并发脑梗组患者头颅MRI多发脑梗病灶明显较普通脑梗死组增多,主要表现在双侧前循环及同侧前后循环,普通脑梗组患者单发病灶比例明显高于肿瘤并发脑梗组。见表2。
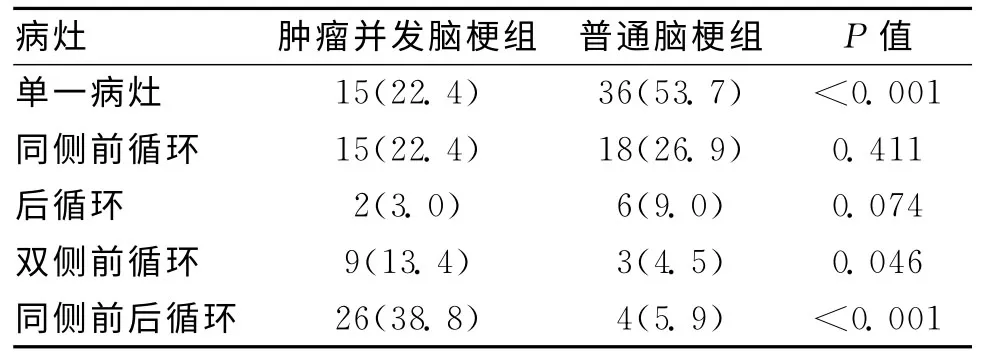
表2 2组梗死病灶分布特点 [n(%)]
3 讨论
恶性肿瘤组患者常见的脑血管病危险因素,如高血压、糖尿病等较普通脑梗组明显减少,与体检对照组相比差异无统计学意义,而D-二聚体及纤维蛋白原水平明显升高,提示恶性肿瘤患者脑梗死发生有其特殊性。恶性肿瘤常导致患者机体高凝状态,其机制同各种内外源性因素相关,如肿瘤细胞可分泌各种促凝物质、机体免疫细胞分泌的炎症因子导致内皮细胞功能障碍及肿瘤放化疗的影响[1]。研究显示,肿瘤病人由于高凝状态而易发深静脉血栓形成[2]。血浆纤维蛋白原和D-二聚体可作为肿瘤相关高凝状态的指标,血浆纤维蛋白原是重要的凝血因子,直接参与凝血过程,凝血途径激活后,被凝血酶裂解形成纤维蛋白单体Ⅰ及纤维蛋白单体Ⅱ,纤维蛋白单体互相交联,形成稳定的可溶性纤维蛋白,并将血液的有形成分包绕其中,从而形成血栓[3]。D-二聚体是纤维蛋白单体经活化因子交联后,再通过纤溶酶水解作用下所生成的一种特异降解产物,其水平的升高特异反映继发性纤溶活性的增强和凝血酶生成增多,标志着机体凝血和纤溶系统的双重激活,可作为体内高凝状态和纤溶亢进的分子标志物之一[4]。肿瘤细胞进入血循环后,与血小板、内皮细胞等相互作用,释放生物活性物质,促使血小板激活后释放含有大量纤维蛋白原的α颗粒,血液循环中形成的癌栓引起继发性纤溶亢进所生成的纤维蛋白原降解产物(FDP)反馈性地刺激血浆纤维蛋白原水平进一步增高[5]。而肿瘤患者的微血栓状态及肿瘤细胞的直接作用,导致了D-二聚体的升高[6]。肿瘤并发脑梗死患者的D-二聚体明显升高,提示机体血管内有活化的血栓形成及纤维溶解活动,可导致微小栓子的形成而导致多发脑梗死病灶。近年的研究发现肿瘤并发脑梗死患者经颅多普勒监测到的微栓子信号明显增多,且与D-二聚体水平相关,对患者进行抗凝治疗后微栓子信号较前明显减少[7]。头颅MRI上多血管区域的病灶是血管栓塞的重要表现[8],肿瘤并发脑梗死患者与普通脑梗死患者对比,头颅MRI上多发病灶的比例明显升高,提示肿瘤患者血液高凝状态是导致多发脑血管栓塞的重要因素。
本文显示,肿瘤相关性脑梗死的发病机制与普通脑梗死患者不同,血液高凝状态可能是肿瘤患者脑梗死的重要因素,临床工作中应给予关注。密切监测肿瘤患者的血液高凝状态,并给予适当的干预,将有助于改善患者预后,提高肿瘤患者的生存质量。
[1]Dammacco F,Vacca A,Procaccio P,et al.Cancer-related coagulopathy(Trousseau's syndrome):review of the literature and experience of a single center of internal medicine[J].Clin Exp Med,2013,13(2):85-97.
[2]Ahlbrecht J,Dickmann B,Ay C,et al.Tumor grade is associated with venous thromboembolism in patients with cancer:results from the Vienna Cancer and Thrombosis Study[J].J Clin Oncol,2012,30(31):3 870-3 875.
[3]Tennent GA,Brennan SO,Stangou AJ,et al.Human plasma fibrinogen is synthesized in the liver[J].Blood,2007,109(5):1 971-1 974.
[4]Lee AY,Julian JA,Levine MN,et al.Clinical utility of a rapid whole-blood D-dimer assay in patients with cancer who present with suspected acute deep venous thrombosis[J].Ann Intern Med,1999,131(6):417-423.
[5]曾丽,刘永立,刘谢添,等.老年恶性肿瘤高凝状态监测[J].中国老年学杂志,2012,32(2):609-610.
[6]Sood SL.Cancer-associated thrombosis[J].Curr Opin Hematol,2009,16(5):378-385.
[7]Seok JM,Kim SG,Kim JW,et al.Coagulopathy and embolic signal in cancer patients with ischemic stroke[J].Ann Neurol,2010,68(2):213-219.
[8]Baird AE,LK,Schlaug G,et al.Multiple acute stroke syndrome:marker of embolic disease[J].Neurology,2000,54(3):674-678.
