低分子质量核桃多肽抗氧化及抗肿瘤活性研究
2015-12-18王丰俊
许 典 吕 佼 于 超 王丰俊
(北京林业大学生物科学与技术学院1,北京 100083)(林业食品加工与安全北京市重点实验室2,北京 100083)
低分子质量核桃多肽抗氧化及抗肿瘤活性研究
许 典1,2吕 佼1,2于 超1,2王丰俊1,2
(北京林业大学生物科学与技术学院1,北京 100083)(林业食品加工与安全北京市重点实验室2,北京 100083)
研究了核桃发酵多肽的抗氧化效果及抗肿瘤活性。结果表明,此多肽具有一定的抗氧化及抗肿瘤活性,当样品质量浓度为2 mg/mL时其DPPH自由基清除率为91.7%,对人小肠癌细胞(Caco-2)的IC50值为3.67 mg/mL。对4组分发酵多肽(分子质量>30、10~30、5~10 ku及<5 ku)进行抗肿瘤活性的试验及筛选,发现<5 ku组分有较强的抗肿瘤活性,表明低分子质量多肽对Caco-2细胞增殖具有较强的抑制作用(IC50值为2.63 mg/mL),且该样品不仅抑制Caco-2细胞生长,对人乳腺癌细胞(MCF-7)增殖也有显著的抑制作用(IC50值为3.76 mg/mL),而对非肿瘤细胞大鼠小肠隐窝上皮细胞(IEC-6)未显示显著的抑制作用。以上结果表明,核桃粕发酵产生的小分子活性多肽有明显的抗氧化及抗肿瘤活性。
核桃多肽 抗氧化活性 MTT 检测 抗肿瘤活性
核桃作为重要的木本粮油经济树种在我国种植面积大,产量可观[1]。核桃仁不仅营养丰富且味道鲜美,也是多种食品的辅料。核桃仁制油后剩余的核桃粕中的蛋白质消化率较高,氨基酸含量丰富且种类齐全,是一种良好的蛋白质来源。但是,目前我国核桃粕的深加工产品不多,对核桃中丰富的生物活性肽的利用更是不足,以致大量的核桃粕原料无法得到有效利用[2]。
近年来,随着自由基理论研究的逐渐深入,发现自由基影响很多疾病的发生发展,其中就包括癌症及一些心血管疾病。具备抗氧化效应的活性物质一般具备一定的抗癌效果,说明两者间存在一定的协同作用[3]。研究表明,非单一氨基酸形式的小肽类是一种十分重要的生物活性物质,这些小肽具备一定的抗氧化及抗癌活性,且对于人体来说吸收率高于氨基酸,因而拥有比氨基酸更为有效的生理功能[4]。现在也有关于核桃多肽的研究,但主要集中于制备工艺及其体外抗氧化研究,尚未见关于核桃小肽的抗肿瘤活性研究。本试验利用制油后的核桃粕制备功能性小肽,并研究其抗肿瘤活性,对科学有效利用核桃蛋白资源,具有重要意义。
1 材料与方法
1.1 材料与仪器
核桃粕:北京大山鑫港技术开发有限责任公司;Caco-2细胞、人乳腺癌细胞MCF-7、大鼠小肠隐窝上皮细胞IEC-6、牛血清白蛋白、细胞培养基、胰蛋白酶:北京协和细胞资源中心;黑曲霉AS3.350:中科院微生物研究院菌种保藏中心。
3111型 CO2细胞培养箱:Thermo SCIENTIFIC;KHZ-1 357型超净工作台:上海市沪西分析仪器厂;KP-629型酶标仪:Thermo SCIENTIFIC。
1.2 试验方法
1.2.1 核桃多肽的制备
核桃粕经烘干、粉碎、脱脂后制成核桃粕粉,利用黑曲霉液态发酵制得核桃多肽液。将核桃多肽粗提液过0.45μm的微孔滤膜,除去大分子物质及杂质,在冻干机中以-90℃冷冻干燥制得核桃多肽粉,放入冰箱中冷藏保存以备用。
1.2.2 核桃多肽样品的抗氧化试验
1.2.2.1 核桃多肽清除DPPH自由基能力的测定
以发酵产核桃多肽及未发酵核桃原料为样品,以维生素C为对照,测定核桃粕发酵前后对DPPH自由基的清除能力影响。
试验步骤如下:离心管中分别加入2 mL不同浓度梯度的核桃多肽溶液,未发酵核桃原液和维生素C溶液,再分别加入2 mL DPPH·溶液,混合均匀后避
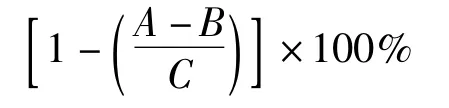
1.2.2.2 核桃多肽总还原力测定
以发酵产核桃多肽及未发酵核桃原料为样品,以维生素C为对照,测定核桃粕发酵前后其总还原力的区别。
分别取1 mL不同浓度的样品溶液、未发酵核桃原液和维生素C溶液于10 mL离心管中,加入2 mL磷酸盐(PBS)缓冲液和2 mL 1%铁氰化钾溶液,加入2 mL 10%三氯乙酸溶液,离心,取1.5 mL上清液于10 mL离心管中,加入1.5 mL蒸馏水和0.3 mL 0.1%的三氯化铁溶液,混匀,测定其在700 nm处的吸光度值,以A700nm表示样品的还原能力。以蒸馏水为空白,每个样品做3个平行试验,取平均值。
1.2.2.3 核桃多肽清除羟自由基(·OH)活性测定
以发酵产核桃多肽及未发酵核桃原料为样品,以维生素C为对照,测定核桃粕发酵前后对羟自由基(·OH)的清除能力影响。
试验步骤如下:在10 mL的离心管中分别加入0.5 mL配好的邻二氮菲溶液,1 mL磷酸缓冲溶液,0.5 mL不同浓度的样品溶液、未发酵核桃原液和维生素C溶液,加入0.5 mL 0.75 mmol/L FeSO4溶液,混匀后再加入H2O2溶液0.5 mL,在536 nm处测定吸光度Ax;将上述步骤中样品溶液换为蒸馏水,其余不变,测定吸光度Af;将上述步骤中H2O2溶液换为蒸馏水其余步骤不变测定吸光度A0;不加入H2O2,其余步骤不变,测定吸光度As。以蒸馏水为空白,每个样品做3个平行试验,取平均值。
1.2.2.4 核桃多肽清除超氧阴离子(O2-)活性测定
以发酵核桃多肽及未发酵核桃原料为样品,以维生素C为对照,测定核桃粕发酵前后对超氧阴离子(O2-)的清除能力影响。
试验步骤如下:取0.05 mol/L Tris-HCl缓冲溶液2 mL,加入1 mL不同浓度的样品溶液、未发酵核桃原液和维生素C溶液,然后加入配制好的的邻苯三酚0.5 mL,混匀后在25℃水浴中保温20 min,然后加入 10 mol/L的盐酸 0.3 mL,终止反应,在420 nm处测吸光度,得到的数据为A;上述步骤中不加入邻苯三酚其余步骤不变测吸光度值为B;上述步骤中将样品溶液换成蒸馏水,其余步骤不变,测定吸光度值为C。以蒸馏水为空白,每个样品做3个平行试验,取平均值。
1.2.3 细胞培养
1.2.3.1 细胞培养基的准备
本试验主要讨论3种细胞,分别为Caco-2细胞(MEM-EBSS培养基、10%胎牛血清、0.5%双抗、1%NEAA);人乳腺癌细胞(MCF-7)(DMEM高糖培养基、10%胎牛血清、0.5%双抗、1%NEAA);大鼠小肠隐窝上皮细胞(IEC-6)(DME高糖培养基、10%胎牛血清、0.5%双抗、胰岛素、1%NEAA)
1.2.3.2 细胞培养及传代
由于试验中选取的3组细胞均为贴壁细胞,因此细胞培养及传代的方法基本一致[6]。将买来的细胞通过活化(37℃水浴)、消化(0.05%的胰蛋白酶处理)、终止消化(细胞分层加入培养基)。混匀细胞(吹打细胞悬浮液)、离心(细胞悬浮液冷冻离心)等步骤得到沉淀的细胞。加入新培养基,利用培养液稀释,控制细胞的浓度在3×104个/mL左右[7]。将细胞分装至数个培养皿中继续放入CO2培养箱中培养[8]。
1.2.4 MTT试验
1.2.4.1 接种细胞
将各株细胞培养至对数生长期后,进行细胞消化,制得细胞悬浊液,进行细胞计数(细胞数/mL=100小格内细胞个数/100×400×104×稀释倍数)[9]根据所测浓度,将细胞悬液浓度用培养基稀释至3×104个/mL左右。将细胞悬液接种在96孔板上,除4个边上的孔不加外,每个孔接种100μL的细胞悬液。每加完1个孔都需要轻晃离心管以保证细胞悬液浓度分布均匀,加完4个孔后用移液枪吹打离心管3~4次。将接种完细胞的96孔板放入CO2细胞培养箱中培养24 h。
1.2.4.2 添加核桃多肽样品
将4种样品稀释成不同浓度梯度(1~5 mg/mL),过0.22μm微孔滤膜除菌。按照设计好的加板方式,每孔加入100μL多肽样品。空白组每孔加入100μL的培养基溶液。每个样品梯度做3次平行试光反应30min。在517 nm处测定吸光度值。得到的数据为A;上述步骤中不加入DPPH·,其余步骤不变B;离心管中分别加入2 mL蒸馏水,再分别加入2 mL DPPH·溶液,测得吸光度值为C[5]。以蒸馏水为空白,每个样品做3个平行试验,取平均值。
1.2.4.3 进行MTT检测
配置MTT溶液,在96孔板中每孔中加入20 μL的MTT溶液。培养4 h后用移液枪吸走上清液后加入200μL的二甲基亚砜(DMSO)。低速震荡15 min。用酶标仪测量各孔的吸光度值,计算每组多肽样品对于肿瘤细胞增殖的抑制作用。以核桃多肽样品浓度为横轴,抑制率为纵轴绘制抑制肿瘤细胞增殖的量效关系曲线,并计算核桃多肽样品的IC50值。
式中:A1为试验孔OD值;A2为对照孔OD值;A0为空白孔OD值。
1.2.5 对不同分子质量的核桃多肽样品进行抗肿瘤效果试验
使发酵产物分别通过30、10、5 ku的超滤膜,将核桃多肽分为>30、10~30、5~10 ku及<5 ku等4个组分,测定这4组分对Caco-2细胞增值抑制作用。根据试验结果选取效果较好的样品进行补充试验。补充试验选用MCF-7细胞和IEC-6细胞。
1.2.6 统计分析
每组数据均用平均值±标准差来表示。通过SPSS软件从单一方差分析的变化来评价不同组数据中的统计学意义。统计学意义P<0.05视为显著[11]。*P<0.05,**P<0.01,***P<0.001,通过SPSS软件对所得数据进行配对T检验。
2 结果与讨论
2.1 核桃粕发酵前后抗氧化活性变化
图1a为发酵前后核桃粕清除DPPH自由基能力的测定结果,图1b为发酵前后核桃粕的总还原力测定结果,图1c为发酵前后核桃粕清除羟自由基活性测定结果,图1d为发酵前后核桃粕清除超氧阴离子(O2
-·)活性测定结果。由图1a~图1d可以看出,原料核桃粕的抗氧化效果不显著,而经发酵后样品抗氧化效果显著增加。以清除DPPH自由基能力为例,样品质量浓度在30 mg/mL时,对DPPH自由基的清除效果显著增加(见图1,P<0.05)且清除率与样品浓度有一定的量效关系。此结果与邵元龙等[12]对芝麻蛋白水解多肽的抗氧化活性的研究结果相符,连伟帅等[13]对沙棘籽酶解多肽的抗氧化活性研究也有相似结论。结合其余3抗氧化数据得出结论,核桃粕经黑曲霉发酵后抗氧化效果显著增加,可能与发酵过程产生了小分子肽类物质有关。
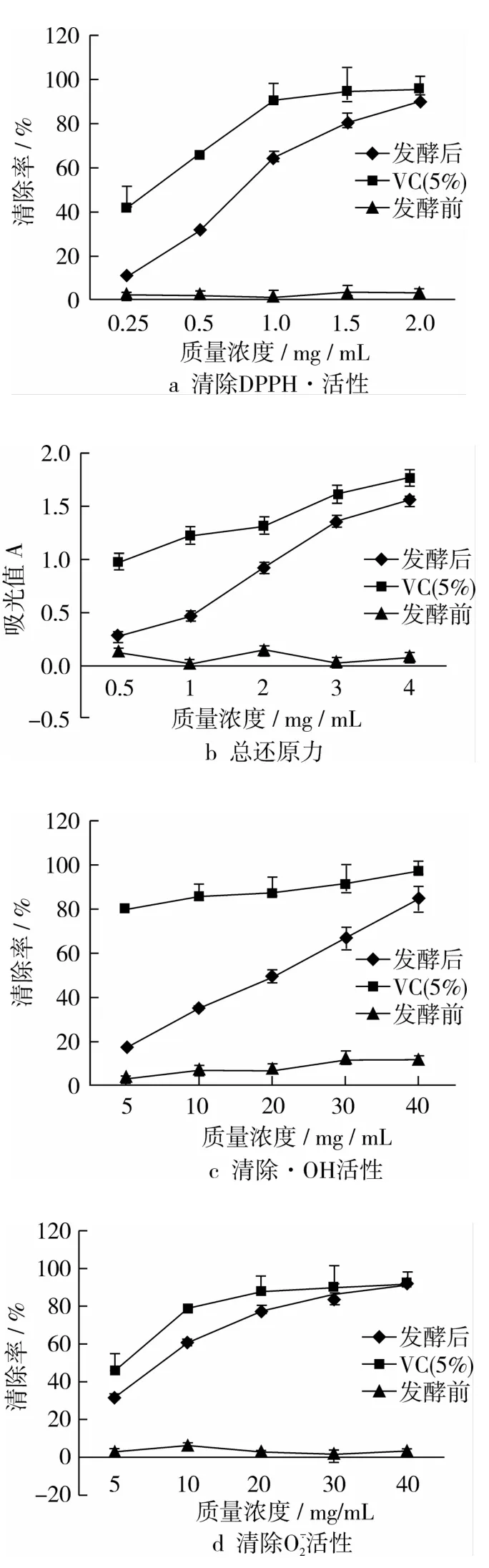
图1 核桃粕发酵前后抗氧化活性变化
2.2 发酵前后核桃原料的抗肿瘤效果对比
为研究核桃粕发酵产物对Caco-2细胞增殖的影响,分别用核桃粕及其发酵产物进行细胞增殖分析。结果表明,未经处理核桃粕对细胞增殖无明显影响,但经发酵后产物显示出极强的细胞增殖抑制作用。发酵产物对Caco-2细胞生长抑制作用呈一定的剂量依赖性,以1 mg/mL和2 mg/mL质量浓度作用于细胞时,未显示明显的增殖抑制作用,当剂量提高到4 mg/mL以上时,出现极其显著抑制细胞生长作用(见图2,P<0.01),对细胞增殖的抑制率高达70%。计算核桃粕发酵产物对Caco-2细胞增殖抑制作用的IC50值为3.66 mg/mL。以上结果表明,核桃粕经发酵后产生能抑制Caco-2细胞增殖的活性成分。

图2 核桃粕发酵前后对Caco-2细胞增殖的影响
2.3 不同多肽样品对Caco-2细胞的抑制作用
选取分子质量 >30、10~30、5~10及 <5 ku的4种核桃多肽作为样品,测定这4种样品对Caco-2细胞的增殖抑制作用。结果表明,4种样品均对Caco-2细胞具有一定的生长抑制作用(见图3)。其中>30、10~30、5~10 ku 3种样品在质量浓度 <3 mg/mL时对细胞增殖抑制作用并不明显,当质量浓度为4 mg/mL和5 mg/mL时,会在一定程度上抑制细胞增殖(见图3,P<0.05)其中5~10 ku样品对Caco-2细胞增殖抑制作用的IC50值为3.31 mg/mL(见表1)。
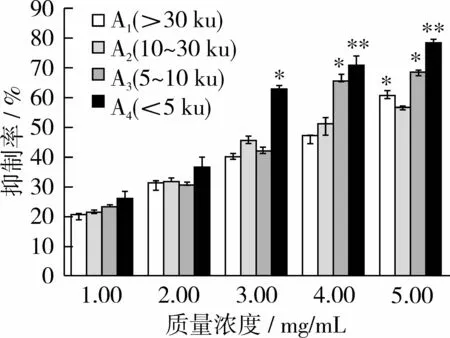
图3 不同多肽样品对于Caco-2细胞的抑制作用效果
分子质量<5 ku样品对Caco-2细胞具有明显的生长抑制作用,其IC50值为2.63 mg/mL,并呈一定的剂量依赖性(见图3)。当样品质量浓度为1mg/mL和2 mg/mL时,对细胞增殖抑制作用并不明显,当质量浓度为3 mg/mL时,显示出显著抑制细胞增殖作用(P<0.05),当质量浓度为4 mg/mL和5 mg/mL时,会极其显著抑制细胞增殖(P<0.01)。样品对Caco-2细胞增殖抑制作用的IC50值为2.63 mg/mL。不同分子质量的核桃多肽均对Caco-2细胞的增值有抑制作用,但不同样品对Caco-2细胞增殖抑制效果不尽相同,分子质量<5 ku样品的抑制效果最强,表明抑制Caco-2细胞增殖的活性成分含量较高。
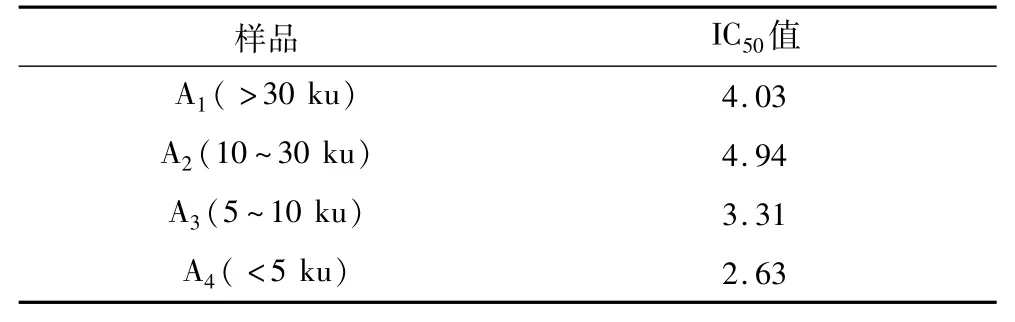
表1 不同分子质量样品的IC50值/mg/mL
2.4 不同浓度A4(<5 ku)多肽样品对MCF-7细胞增殖抑制作用
为进一步研究<5 ku样品对其他肿瘤细胞生长的影响,以人乳腺癌细胞株MCF-7为研究模型,同样在1、2、3、4及5 mg/mL的质量浓度水平下,检测样品对细胞增殖的影响。MTT细胞增殖试验结果表明,<5 ku样品对MCF-7细胞也具有明显的生长抑制作用,其IC50值为3.64mg/mL,并呈一定的剂量依赖性(见图4)。当分子质量<5 ku样品质量浓度为1~3mg/mL时,对细胞增殖有抑制作用但并不明显;当质量浓度为4 mg/mL时,显著抑制细胞增殖(P<0.05);当质量浓度为5 mg/mL时,会极其显著抑制细胞增殖(P<0.01)。以上结果表明,<5 ku样品对MCF-7细胞具有一定的增殖抑制作用,但对Caco-2细胞的增殖抑制作用更强。
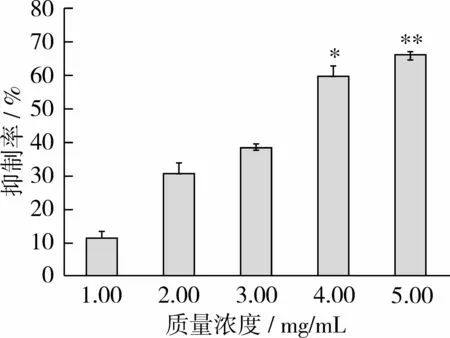
图4 不同浓度A4多肽样品对MCF-7细胞增殖抑制作用
2.5 不同浓度A4(<5 ku)多肽样品对IEC-6细胞增殖抑制作用
为研究分子质量<5 ku样品对健康非肿瘤细胞生长的影响,本试验选择大鼠小肠隐窝上皮细胞(IEC-6)作为研究模型。IEC-6细胞具有典型的正常肠上皮细胞的形态特征、生长特性和超微结构,可用于研究正常培养条件下样品对肠上皮细胞的作用。在1、2、3、4及5 mg/mL的样品质量浓度水平下,进行 MTT细胞增殖分析试验。结果表明,小分子质量核桃多肽对IEC-6细胞没有明显的生长抑制作用(见图5),量效关系也不明显。但在高质量浓度时(5 mg/mL)样品还是对细胞的增殖产生了一定的抑制作用(35.19%)。
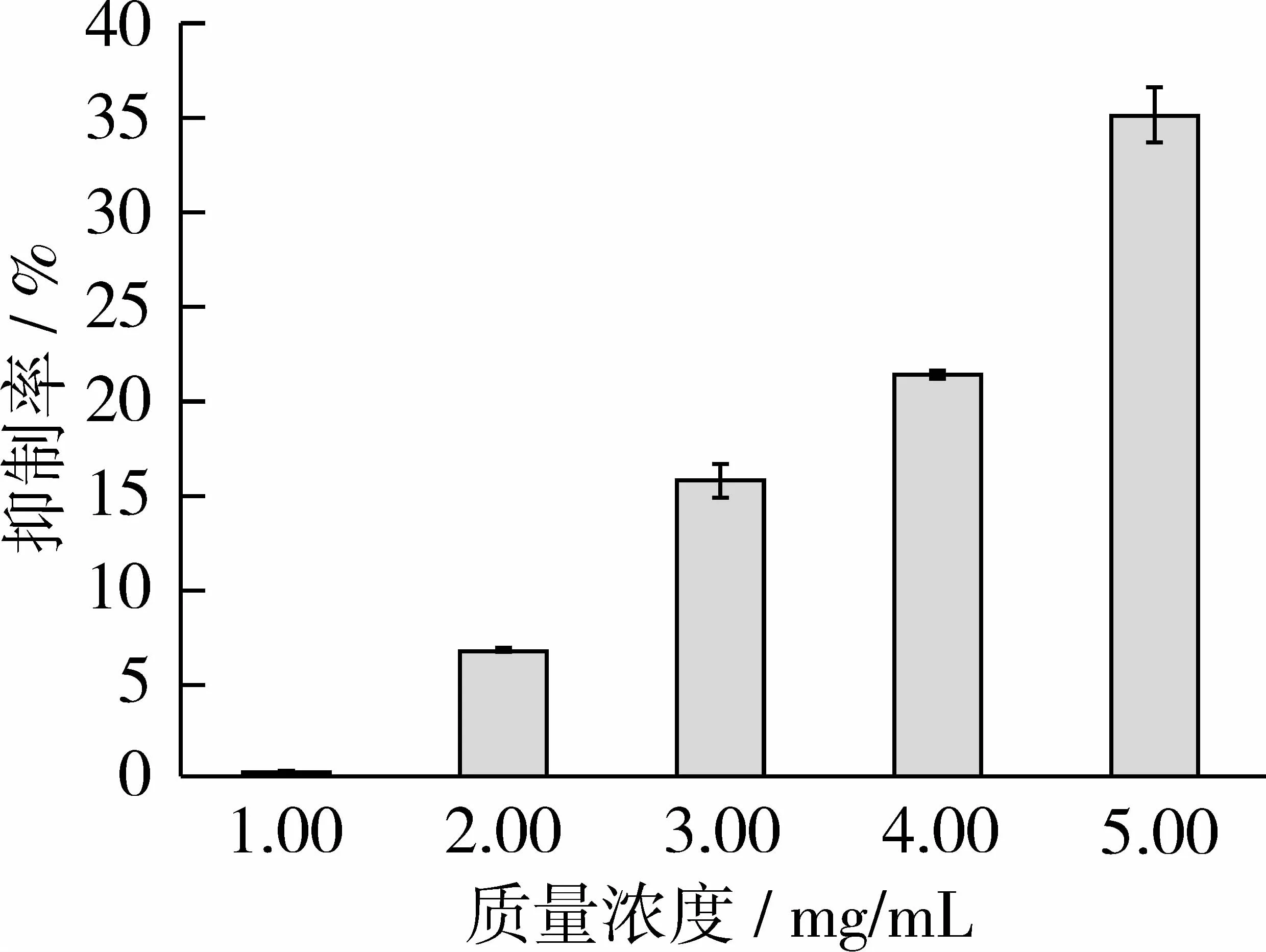
图5 不同浓度A4多肽样品对正常IEC-6细胞增殖抑制作用
3 结论
核桃粕原料抗氧化性及对Caco-2细胞增殖的抑制作用较小,但经黑曲霉发酵后,产生小分子多肽类物质,抗氧化性及对Caco-2细胞增殖的抑制作用均有显著提高。分子质量<5 ku的核桃多肽样品不仅对人结肠癌细胞具有生长抑制作用,对人乳腺癌细胞也具有较强生长抑制作用,表明核桃粕经发酵后产生的抑制癌细胞生长的活性成分且分子量较小的肽类样品抑制效果更好。而且,对癌细胞生长具有较强抑制作用的分子质量<5 ku的样品,对正常非肿瘤细胞IEC-6没有明显的生长抑制作用。以上结果表明,核桃粕黑曲霉发酵产物以特定形式存在的小肽类具有一定抗肿瘤活性,符合理想抗肿瘤活性成分所需的高效、低毒副作用特点。该研究结果为阐明核桃蛋白能产生抗肿瘤活性肽提供了依据,可以作为今后核桃生物活性多肽深度开发利用的基础。
[1]李敏,刘媛,孙翠,等.核桃营养价值研究进展[J].中国粮油学报,2009,24(6):166-170
[2]王丰俊,王建中.核桃综合深加工的思路与技术评价[J].中国油脂,2005,30(1):17-20
[3]夏春燕,郭晓晖,李富华,等.细胞抗氧化活性方法在食物抗氧化活性评价中的研究进展[J].食品科学,2012,33(15):297-302.
[4]刘丽娜,何东平,张声华,等.化学发光法对花生多肽的体外抗氧化活性和对 DNA损伤的保护作用的研究[J].中国粮油学报,2011,26(4):69-73
[5]Kim H,Moon JY,Kim H,etal.Antioxidantand antiproliferative activities ofmango flesh and peel[J].Food Chemistry,2010,121(2):429-436
[6]Ribeiro SM R,Barbosa LCA,Queiroz JH,etal.Phenolic compounds and antioxidant capacity of Brazilian mango(Mangifera indica L.)varieties[J].Food Chemistry,2008,110(3):620-626
[7]刘爽,汤锋,刘琦,等.全反式维甲酸对卵巢上皮腺癌细胞株抑制作用的试验研究[J].中华临床医师杂志 (电子版)ISTIC,2013,7(4):1601-1604.
[8]田洪磊,张灏,田丰伟.小白杏杏仁油免疫调节及对S180肉瘤抑制作用研究[J].中国粮油学报,2013,28(2):55-59
[9]刘翠翠,张荣泉,冯文茹,等.鸡血清抗肿瘤活性的初步观察[J].食品研究与开发,2010,31(8):179-182
[10]Hideshima T,Bradner JE,Wong J,et al.Small-molecule inhibition of proteasome and aggresome function induces synergistic antitumor activity in multiple myeloma[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(24):8567-8572
[11]Muthaiyah B,Essa M M,Chauhan V,et al.Protective Effects of walnut extract against amyloid beta peptide-induced cell death and oxidative stress in PC12 cells[J].Neurochem Res,2011(36):2096-2103
[12]邵元龙,董英.芝麻蛋白水解工艺优化及芝麻多肽组分抗氧化活性的研究[J].中国粮油学报,2010(1):69-73
[13]连伟帅,王常青,于书佳,等.沙棘籽酶解多肽的抗氧化性能研究[J].食品工业科技,2013,22:128-130,140.
The Antioxidant and Anti-Tumor Abilities of Low-Molecular-WeightWalnut Peptides
Xu Dian1,2LüJiao1,2Yu Chao1,2Wang Fengjun1,2
(College of Biological Science and Technology,Beijing Forestry University1,Beijing 100083)
(Beijing Key Laboratory of Forest Food Processing and Safety,Beijing Forestry University2,Beijing 100083)
In the paper,the antioxidant and antineoplastic activity of walnut polypeptide after fermented has been researched.The results showed that the walnut polypeptide had an antioxidant activity and the clearance rate of its DPPH· free radicalwas91.7%at2mg/mL alsowith an inhibition on proliferation of human colon cancer(Caco-2)cells(IC50value of 3.67 mg/mL).The walnut polypeptide was separated into four fragments,including A1(MW>30 ku),A2(MW:10~30 ku),A3(MW:5~10 ku)and A4(MW:<5 ku),to determine the different inhibition on tumor cells.The fragment A4exhibited obvious inhibition(IC50value of2.63 mg/mL)and a certain extent of inhibition on the proliferation ofMCF-7 tumor cells(IC50value of3.76mg/mL).However,no significant inhibitory effect of the fragment A4was observed on IEC-6 cells.The results indicated that the polypeptide derived from walnut protein cake had antioxidant and antineoplastic activities.
walnut peptide,antioxidant activity,MTT detection,anti-tumor activity
TS201.2
A
1003-0174(2015)11-0065-06
中央高校基本科研业务费专项(TD2012-03),北京市农业科技项目(20130110)
2014-04-10
许典,女,1989年出生,硕士,油脂与植物蛋白
王丰俊,男,1975年出生,副教授,油脂与植物蛋白
