高温高湿贮藏对玉米淀粉合成关键酶的影响
2015-12-18畅鹏飞郑明珠刘景圣
畅鹏飞 修 琳 郑明珠 蔡 丹 刘景圣
(吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室,长春 130118)
高温高湿贮藏对玉米淀粉合成关键酶的影响
畅鹏飞 修 琳 郑明珠 蔡 丹 刘景圣
(吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室,长春 130118)
选用2013年收获的“农大709”玉米籽粒,根据吉林省夏季平均气温与相对湿度设定玉米的贮藏条件,将玉米籽粒分别贮藏于室温和恒温恒湿培养箱(35℃,75%)中,并测定分析了不同贮藏时间玉米籽粒可溶性淀粉合成酶(SSS)、束缚性淀粉合成酶(GBSS)、淀粉分支酶(SBE)以及淀粉脱支酶(DBE)活性的变化,进而分析玉米在不同贮藏条件下淀粉品质的变化。试验结果表明:常温条件下,只有SBE在贮藏第30天时有显著的下降(P<0.05),其余3种淀粉关键酶(SSS、GBSS、DBE)活性均没有发生显著变化(P>0.05)。高温高湿贮藏条件下,SSS、SBE、DBE酶活性均呈极显著下降(P<0.01),且分别下降了42.1%、39.5%和33.7%。而GBSS酶活性则呈先上升后下降的趋势(P<0.01),较常温贮藏,GBSS酶活性总体呈上升趋势。
高温高湿 可溶性淀粉合成酶 束缚性淀粉合成酶 淀粉分支酶 淀粉脱支酶
本试验选用“农大709”玉米籽粒,通过人工模拟过夏贮藏条件对玉米籽粒进行30 d的短期贮藏,对贮藏期间4种淀粉合成代谢关键酶活性的变化进行了研究。通过对酶活性变化的分析,进而推断高温高湿贮藏条件对玉米淀粉食用品质的影响,以期为高温贮藏条件对采后玉米食用品质的影响提供参考。
1 材料及方法
1.1 样品贮藏
选用“农大709”作为试样,测定初始水分质量分数为13.2%,将其用纱布包好,放入35℃,相对湿度为75%的恒温恒湿培养箱中,同时留一部分放在室温下不控湿度,作为空白。贮藏期为30 d,每隔6 d进行取样。
1.2 试剂与设备
4-羟乙基哌嗪乙磺酸(HEPES)、聚乙烯吡咯烷酮(PVP-40)、二硫苏糖醇(DTT)、2-(N-吗啉)乙磺酸一水合物(MES)、支链淀粉(Amylopectin)、三甲基甘氨酸(Tricine)、腺苷二磷酸葡萄糖(ADPG)、磷酸烯醇式丙酮酸(PEP)、丙酮酸激酶(PK)、葡萄糖(Glucose)、烟酰胺腺嘌呤二核苷酸磷酸(NADP)、己糖激酶(HK):美国 sigma公司;可溶性淀粉:天津市风船化学试剂科技有限公司;β-巯基乙醇:北京鼎国生物技术有限责任公司。
恒温恒湿培养箱:上海新苗医疗器械制造公司;Z36HK高速冷冻离心机:德国Hermle Labortechnik GmbH公司;TU-1810紫外分光光度计:北京普析通用仪器有限责任公司。
2 试验方法
2.1 可溶性淀粉合成酶(SSS)和束缚性淀粉合成酶(GBSS)活性的测定
2.1.1 粗酶液的提取
参照程方民等[5]的方法,并略作改动。
称取3.0 g籽粒样品,加12 mL提取缓冲液于4℃下浸泡12 h,冰浴磨成匀浆,取200μL匀浆加1.0 mL缓冲液,1 000 r/min 4℃离心 10 min,沉淀用缓冲液悬浮后用于GBSS活性测定,剩余匀浆10 000 r/min,4℃离心 30 min,收集上清液用于 SSS活性测定。
提取缓冲液:最终浓度为 Tricine-NaOH(pH 7.5)100 mmol/L,MgCL28 mmol/L,EDTA 2 mmol/L,甘油125 ml/L,PVP-40 10 g/L,β-巯基乙醇 50 mmol/L。
2.1.2 酶活性的测定
参照 Nakamura[6]等的方法,并略作改动。
三十多年来,农场培养了一个种植芒果的顶尖管理团队,一批批优秀的芒果种植技术人才。他们凭借多年积累的技术和经验,让优质芒果从林间树梢来到人们的手中。
取240μL酶提取液加入36μL反应液Ⅰ(其中包含 HEPES-NaOH(pH 7.5)50 mmol/L,ADPG 1.6 mmol/L,Amylopectin 0.7 mg,DTT 15 mmol/L),30℃反应30 min后,沸水浴1 min终止反应,冰浴中冷却;加100μL反应液Ⅱ(其中包含 HEPES-NaOH(pH 7.5)50 mmol/L,PEP 4 mmol/L,KCL 200 mmol/L,MgCL210 mmol/L,PK 1.2 U),30℃反应 20 min后,沸水浴1 min终止反应,10 000 r/min离心10 min。取上清液240μL与120μL反应液Ⅲ(其中包含HEPES-NaOH(pH 7.5)50 mmol/L,Glucose 10 mmol/L,MgCL220 mmol/L,NADP 2 mmol/L,HK 1.4 U,G-6-PD 0.35 U),30℃反应 20 min后,测定340 nm下OD值。以240μL煮沸的粗酶液作为对照,酶活性以每分钟增加0.001 OD值为1个酶活单位[U·g-1(FW)·min-1]。
2.2 淀粉分支酶(SBE)活性的测定
2.2.1 粗酶液提取
参考Nakamura等[7]的方法,并略作修改。
取3 g玉米籽粒于研钵中,加入HEPES-NaOH,pH 7.5的提取缓冲液10 mL,4℃下浸泡12 h。冰浴条件下进行研磨,所得匀浆于4℃,13 000 r/min离心15 min,取上清液装于小清瓶中即为粗酶液,用于SBE酶活的测定。
提取缓冲液:50mmol/LHEPES-NaOH(pH 7.5),5 mmol/L EDTA,1 mmol/L DTT,2 mmol/L KCl,1%PVP-40。
2.2.2 酶活测定
酶活测定参照何煜[8]的方法,略作改动。取250 μL粗酶液于试管中,加入1 500μL提取缓冲液,再加120μL 0.75%可溶性淀粉,混匀,在37℃恒温水浴中反应30 min后,置于沸水浴中1 min终止反应。加2 mL浓度为0.2%的盐酸溶液,再加150μL碘液(0.1%I2—1%KI)显色10 min后加2 ml蒸馏水进行稀释,测定波长为660 nm处的吸光度值。以250μL灭活后的粗酶液作为对照。淀粉分支酶活性以波长660 nm的吸光度值下降百分率表示,以每降低1‰碘蓝值为1个酶活性单位[U·g-1(FW)·min-1],所有测定均重复3次。
2.3 淀粉脱支酶(DBE)活性的测定
2.3.1 粗酶液提取
参考Nakamura等[7]的方法,并略作修改。
取贮藏玉米籽粒,称取3 g于研钵中,加入MES-NaOH,pH 6.5的提取缓冲液10mL,浸泡12 h。冰浴条件下进行研磨,所得匀浆于4℃,13 000 r/min离心30 min,取上清液装于小清瓶中即为粗酶液。
提取液浓度:100 mmol/L MES-NaOH(pH 6.5),5mmol/LMgCl2,2 mmol/L EDTA,50 mmol/L,β-巯基乙醇和12.5%的甘油。
2.3.2 酶活测定
酶活测定参照文献[9],将每分钟水解支链淀粉生成0.01 pmol的还原糖(以麦芽糖计)的酶量定义为 1个酶活力单位(pmol·min-1·μL-1)。
2.3.3 麦芽糖标准曲线的绘制
参照文献[9]。
2.4 数据分析
可溶性淀粉合成酶、束缚性淀粉合成酶、淀粉分支酶、淀粉脱支酶活性变化规律使用Origin 8.5绘制,利用SPSS16.0对数据进行方差分析。
3 结果分析
3.1 SSS活性变化趋势
可溶性淀粉合成酶(SSS)是淀粉合成途径中非常关键的淀粉酶之一,其主要负责支链淀粉的合成过程。由图1所示,常温贮藏过程中,SSS酶活性呈波动变化,在贮藏第30天时,酶活性为0.148 8 U,较初始酶活性(0.151 4 U)有所下降。但是,据方差分析知,30 d的常温贮藏过程中SSS活性变化不显著(P>0.05)。然而,高温高湿贮藏条件下,SSS活性在贮藏第6天时就有显著下降(P<0.01),并且随时间的延长,下降趋势更明显。在贮藏第30天,SSS活性达到最低(0.087 6 U),较初始SSS活性下降了42.1%。由此可见,高温高湿贮藏下,玉米籽粒中SSS活性发生了明显的下降,这主要是因为SSS为热敏性淀粉酶[10],其对温度特别的敏感,当外界温度升高时,酶活性会发生明显变化,Keeling等[10]称此为“Knock-down”现象。
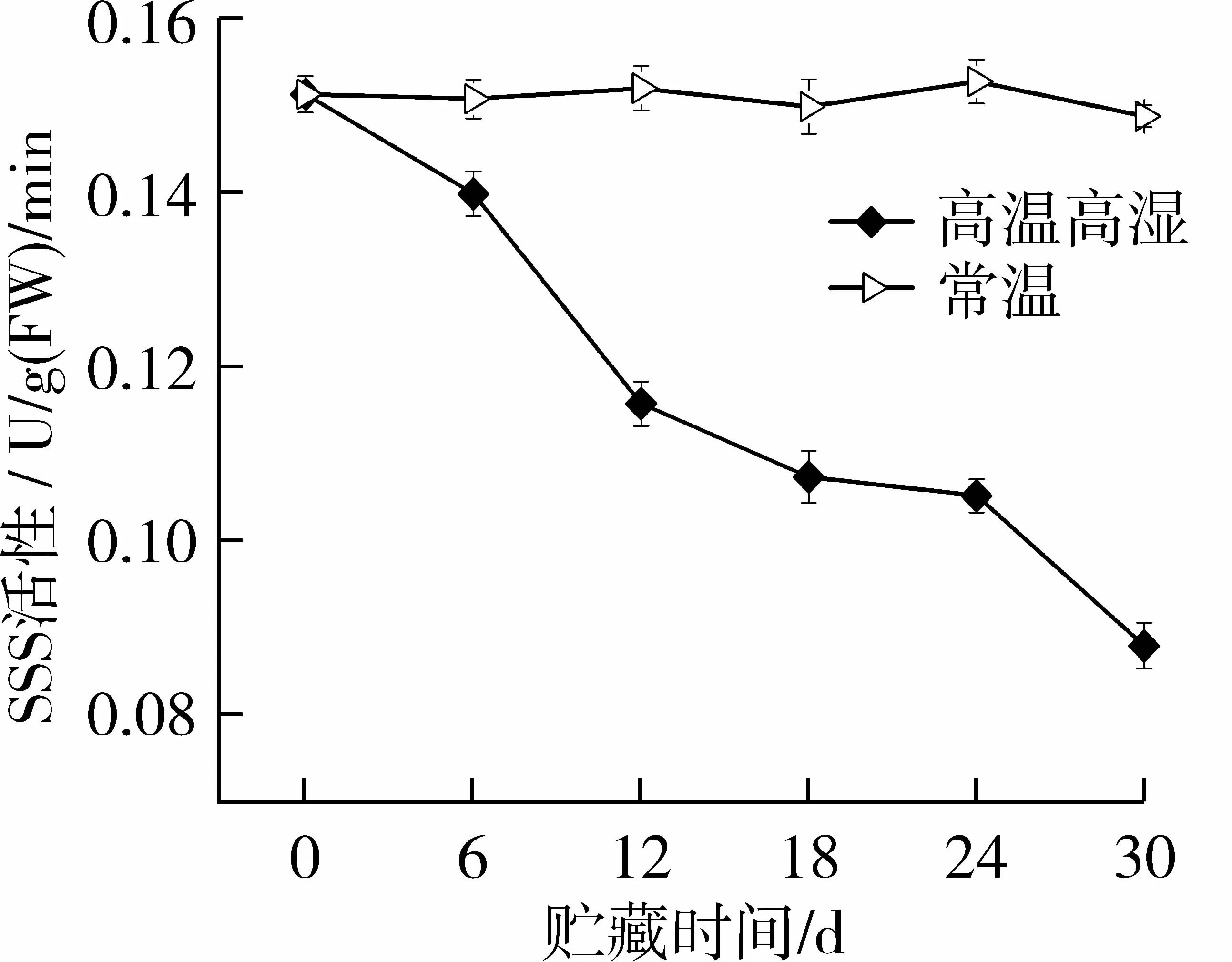
图1 SSS活性随贮藏时间的变化
3.2 束缚性淀粉合成酶(GBSS)活性的变化
GBSS是已发现的淀粉合成过程中又一种重要的酶类,在淀粉合成过程中,GBSS主要负责直链淀粉的合成[11],还有报道称,GBSS还能辅助支链淀粉的合成[12]。由图2可知,常温贮藏过程中,GBSS活性在第12天时出现最低值(0.587 U),但是通过方差分析可知,常温贮藏过程中各贮藏时间GBSS活性没有显著的差异(P>0.05)。在高温高湿贮藏条件下,贮藏第6天时,GBSS活性没有显著变化。而贮藏第12天时,GBSS活性较初始值有明显的上升(P<0.01),达到峰值(0.624 U),随着贮藏时间的延长,GBSS活性呈下降趋势。30 d时的GBSS活性比初始(第0天)值上升了5.58%。图2显示,高温高湿较常温贮藏,GBSS活性总体升高(P<0.05)。从而表明高温高湿贮藏条件能够加快玉米籽粒中底物转化为直链淀粉的速度,这与Shi等[13]证明适当的温度可以提高谷物中直链淀粉的比例有相似的结果。

图2 GBSS活性随贮藏时间的变化
3.3 SBE活性变化
目前研究表明,SBE不仅能切开以α-1,4糖苷键连接的葡聚糖,并且能把切下的短链通过 α-1,6糖苷键连接于受体链上,形成分支的糖链,影响籽粒中淀粉的组成和结构的关键酶[14]。图3显示,2种贮藏对玉米中SBE活性的影响存在显著差异(P<0.05),并且随着贮藏时间的延长,SBE活性均发生了显著的变化(P<0.05)。常温条件下,SBE活性呈波动下降趋势,但是到第24天时,SBE活性在统计学上没有显著差异(P>0.05),只有在贮藏第30天时有显著下降(P<0.05),出现了最低值(0.226 U),与贮藏第0天相比,第30天时 SBE活性下降了5.91%。在高温高湿贮藏条件下,SBE活性变化更加明显,贮藏第6天时,SBE较第0天有所下降,但是变化不显著(P>0.05),而后SBE呈明显下降趋势。在贮藏末(第30天),SBE活性达到最低值(0.145 2 U),较初始酶活性下降了39.5%。从而可知,高温高湿贮藏条件抑制了玉米籽粒中SBE的活性。

图3 SBE活性随贮藏时间的变化
3.4 麦芽糖标准曲线的回归方程
利用origin绘图软件计算出麦芽糖标准曲线的斜率k=2.122 6,相关系数R2=0.999 42。回归方程为:Y=2.122 6X。
式中Y为麦芽糖含量,X为麦芽糖在540 nm处的吸光值。
3.5 DBE活性变化
早期研究表明,DBE在氨基酸序列上与α-淀粉酶相似,属于淀粉水解酶家族。而Ball等[15]在提出了Glucan triming模型,认为DBE在淀粉的合成中可以专一性地裂解支链淀粉上的α-1,6糖苷键,起到“修饰”淀粉结构的作用。由图4可知,常温贮藏过程中,淀粉脱支酶(DBE)活性呈缓慢下降趋势,但是根据显著性分析得知,常温贮藏30 d的过程中DBE活性变化不显著(P>0.05)。而高温高湿条件下,DBE酶活性从贮藏第6天开始即发生了显著变化(P<0.05),而后呈不断的下降趋势。分析可知,高温高湿条件下,贮藏第30天较第0天时DBE活性下降了33.7%。从而可知,高温高湿贮藏条件加速了DBE酶活下降的速率。

图4 DBE活性随贮藏时间的变化
4 讨论
在30 d的高温高湿贮藏过程中,由于负责直链淀粉合成的GBSS活性的相对上升,可能会导致直链淀粉有所上升。Cheetham等[16]提出,直链淀粉扰乱了支链淀粉微晶的形成,直链淀粉会形成双螺旋结构,形成潜在的结晶排列。所以高温高湿贮藏过程中,玉米淀粉更容易老化。此外,高温高湿条件下支链淀粉合成有关酶(SSS、SBE、DBE)活性的下降,会导致支链淀粉含量会有所减少。从而分析得到,直链/支链淀粉比值会变大。所以,长期的高温高湿贮藏会导致玉米淀粉在体内的消化率有所下降[17],还有可能导致玉米淀粉的食用品质劣变[18]。
5 结论
5.1 常温贮藏下,除SBE活性发生了显著的下降(P<0.05)外,其余3种淀粉合成关键酶活性均没有显著的变化。
5.2 高温高湿贮藏条件下,SSS、SBE和DBE活性分别下降了42.1%、39.5%和33.7%,而GBSS活性在高温贮藏过程中总体呈上升趋势。
[1]冯敏.中国玉米需求分析[D].杨凌:西北农林科技大学,2011
[2]Rehman Z U,Habib F,Zafar S I.Nutritional changes in maize during storage at three temperatures[J].Food Chemistry,2002,77(2):197-201
[3]张平,佀静雪,王莉,等.采收成熟度对不同品种的玉米贮藏过程中碳水化合物含量的影响[J].保鲜与加工,2012,12(5):14-17
[4]王春辉,王清章,严守雷,等.气调对甜玉米贮藏品质的影响[J].安徽农业科学,2011,39(4):2305-2307
[5]程方民,蒋德安,吴平,等.早釉稻籽粒灌浆过程中淀粉合成酶的变化及温度效应特征[J].作物学报,2001,27(2):202-206
[6]Nakamura Y,Yuki k.Changes in enzyme activities associated with carbohydrate metabolism duri-ng development of rice endosperm[J].Plant Science,1992,82:15-20
[7]Nakamura Y,Umemoto T,Ogata N,et al.Starch debranching enzyme(R-enzyme or pullulanase)from developing rice endosperm:purification,cDNA and chromosomal localization of the gene[J].Plant,1996,199:209-218
[8]何煜.鲜食玉米贮藏过程中SBE、DBE的活性变化规律研究[D].长春:吉林农业大学,2013
[9]王浩,何煜,代立刚,等.鲜食玉米淀粉脱支酶活性测定方法的建立[J].食品工业,2013(10):166-169
[10]Keeling P L,Bacon P J,Holt D C.Elevated temperature reduces starch deposition in wheat endosperm by reducing the activity of soluble starch synthase[J].Planta,1993,191(3):342-348
[11]Denyer K,Johnson P,Zeeman S,et al.The control of amylose synthesis[J].Journal of Plant Physiology,2001,158(4):479-487
[12]Umemoto T,Nakamura Y,Ishikura N.Activity of starch synthase and the amylose content in rice endosperm[J].Phytochemistry,1995,40(6):1613-1616
[13]Shi Y C,Seib P A,Bernardin J E.Effects of temperature during grain-filling on starches from six wheat cultivars[J].Cereal Chemistry,1994,71:369-383
[14]Mizuno K,Kimura K,Arai Y,et al.Starch branching enzymes from immature rice seeds[J].Journal of Biochemistry,1992,112(5):643-651
[15]Ball S,Guan H P,James M,etal.From glycogen to amylopectin:amodel for the biogenesis of the plant starch granule[J].Cell,1996,86(3):349-352
[16]Cheetham N W H,Tao L.Solid state NMR studies on the structural and conformational properties of naturalmaize starches[J].Carbohydrate Polymers,1998,36(4):285-292
[17]Englyst H N,Veenstra J,Hudson G J.Measurement of rapidly available glucose(RAG)in plant foods:a potential in vitro predictor of the glycaemic response[J].British Journal of Nutrition,1996,75(3):327-337
[18]Zeng M,Morris C F,Batey IL,et al.Sources of variation for starch gelatinization,pasting,and gelation properties in wheat[J].Cereal Chemistry,1997,74(1):63-71.
Effects of High Temperature and High Humidity Storage of Corn Grain on the Activity of Its Key Starch Synthases
Chang Pengfei Xiu Lin Zheng Mingzhu Cai Dan Liu Jingsheng
(Food Science and Engineering,Jilin Agricultural University,National Engineering Laboratory of the Wheat-corn Deep Processing,Changchun 130118)
Samples of corn grain“Nongda 709”gained in 2013 have been selected to study the effects of storage temperature and humidity on corn starch syntheses activity.The storage conditionswere set based on the average temperature and relative humidity in summer of Jilin Province.The corn grainswere stored in conditions at room temperature and the incubator(35℃,75%)respectively with constant temperature and humidity.The activity change of soluble starch syntheses(SSS),bound starch syntheses(GBSS),starch branching enzyme(SBE)and starch branching enzyme(DBE)of corn grainswith different storage timeweremeasured.Then the change of starch quality in different storage conditions was studied.The results showed that:on condition of normal temperature,only the SBE had significantly decrease(P<0.05)on 30 d of storage.However,the activity of the other three kinds of key enzymes of starch synthesis(SSS,GBSS,DBE)were not significantly changed(P>0.05).On high temperature and humidity storage conditions,SSS,SBE,DBE enzyme activity were significantly decreased(P<0.01),and decreased by 42.1%,39.5%and 42.1%respectively.However,GBSS activity first increased and then decreased(P<0.01).Compared with normal temperature storage,GBSS increased totally.
high temperature and high humidity,soluble starch syntheses,bound starch synthase,starch branching enzyme,starch branching enzyme
TS212.2
A
1003-0174(2015)11-0037-05
公益性行业(粮食)科研专项(201313011-3),玉米主食工业化生产关键技术及其产业化示范(2012BAD 37B05)
2014-04-28
畅鹏飞,男,1988年出生,硕士,粮油深加工与综合利用
刘景圣,男,1964年出生,教授,粮食深加工
