气相色谱内标法测定水产饲料中的脂肪酸
2015-12-18张凤枰罗彬月杜雪莉刘耀敏
张凤枰 罗彬月 杜雪莉 曹 静 刘耀敏
(通威股份有限公司水产畜禽营养与健康养殖农业部重点实验室1,成都 610041)
(上海海洋大学食品学院2,上海 201306)
气相色谱内标法测定水产饲料中的脂肪酸
张凤枰1,2罗彬月1杜雪莉1曹 静2刘耀敏1
(通威股份有限公司水产畜禽营养与健康养殖农业部重点实验室1,成都 610041)
(上海海洋大学食品学院2,上海 201306)
建立以十三烷酸为内标物,气相色谱定量测定水产饲料中脂肪酸含量的方法。饲料样品中的油脂经酸热法提取、氢氧化钾-甲醇皂化、三氟化硼-甲醇甲酯化后衍生为相应的脂肪酸甲酯,以SPTM-2560毛细管柱分离,氢火焰离子化检测器测定,保留时间定性、峰面积内标法定量。结果表明,在所选择的色谱条件下,37种脂肪酸甲酯在65 min内获得较好的分离;9种主要脂肪酸加标回收率(n=6)为88.4%~107.5%,相对标准偏差为2.28%~4.79%,最低定量限(S/N=10)为2.0 mg/kg。该方法操作简便、快速、重复性好,适合批量水产饲料样品脂肪酸的定量测定。
气相色谱 内标法 脂肪酸 水产饲料
鱼类能量主要来源于脂肪酸的分解代谢,亚麻酸、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等长链多不饱和脂肪酸为鱼类细胞膜结构和功能所需要,是前列腺素(PG)、白细胞三烯(LT)和脂氧素等的前体,在调控细胞代谢和鱼类生理功能方面具有重要生理功能[1]。季文娟[2]研究结果表明 EPA、DHA对中国对虾的繁殖力具有特殊的作用,亲虾饲料中必须含有适量EPA、DHA,才能保证亲虾正常的产卵和卵质。吉红等[3]研究表明饲料HUFA具有抑制草鱼脂质合成及向肝组织的脂质转运、降低肝胰脏脂质及腹腔脂肪的沉积、提高草鱼抗氧化能力的作用。水产饲料生产企业一般在饲料生产过程中添加大豆油、鱼油、藻粉等脂肪源,以满足鱼虾对脂肪酸特别是长链多不饱和脂肪酸的生理需求。因此,脂肪酸含量已成为国内外水产饲料品质控制重要指标之一。脂肪酸的测定方法有气相色谱法[4-5]、液相色谱法[6]、气相色谱质谱联用法[7-8]、液相色谱质谱联用法[9-10]、红外光谱法[11-12]等,国家标准方法[13]规定了饲料中的脂肪酸含量测定方法,该法采用索氏抽提法得到饲料油脂后,外标法定量测定各种脂肪酸的含量,检测周期长,操作步骤繁琐,且对于添加微藻等原料的水产饲料,若采用该法测定脂肪酸,不能完全提取藻粉中的油脂,测定结果与产品标示值相差较大。本试验采用酸热法一次提取饲料中的油脂,内标法定量测定水产饲料中脂肪酸含量,旨在简化前处理步骤,缩短检测周期,为水产饲料脂肪酸的质量控制提供简便、快速、准确可靠的检测方法。
1 材料与方法
1.1 仪器、试剂和材料
7890 A气相色谱仪,配7683B自动进样器、FID检测器:美国Agilent科技有限公司;Allegra 64R冷冻离心机:美国Beckman Coulter公司。
Supelco37种脂肪酸甲酯混合标准溶液(10 mg/mL),十三烷酸(C13∶0)、豆蔻酸(C14∶0)、棕榈酸(C16∶0)、棕榈油酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1n9c)、亚油酸 (C18∶2n6)、亚麻 酸(C18∶3n3)、二十碳五烯酸(C20∶5n3)、二十二碳六烯酸(C22∶6n3)等10种脂肪酸及其甲酯标准品(纯度≥99%)、13%~15%三氟化硼-甲醇溶液:美国Sigma-Aldrich公司。
水产饲料样品:四川当地饲料市场采集。
1.2 方法
1.2.1 标准溶液的配制
1.2.1.1 十三烷酸内标溶液
准确称取适量十三烷酸标准品,用甲醇配制成10.0 mg/mL溶液,充分摇匀备用;准确称取适量十三烷酸甲酯标准品,用异辛烷配制成0.25 mg/mL内标溶液,充分摇匀备用。
1.2.1.2 脂肪酸甲酯标准溶液
准确称取适量十三烷酸、豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、亚麻酸、二十碳五烯酸、二十二碳六烯酸等10种脂肪酸甲酯标准品适量,用异辛烷分别配制 0.25、5.0、50.0、50.0、5.0、50.0、50.0、5.0、5.0、5.0 mg/mL的混合储备液,充分摇匀备用。
1.2.2 色谱条件
色谱柱:Supelco SPTM-2560石英毛细管柱,100 m×0.25 mm×0.20μm;汽化室温度:250℃;检测器温度:260℃;色谱柱初始温度60℃,以4℃/min升至160℃,再以2℃/min升至240℃;载气:高纯氮;柱流速:1.0 mL/min;尾吹流速:40 mL/min;氢气流速:35 mL/min;空气流速:350 mL/min;分流比10∶1;进样量1μL。
1.2.3 样品前处理
1.2.3.1 饲料油脂的提取
参考酸热法[14],稍作改动。准确称取饲料样品1.0 g(精确至0.000 1 g),置50 mL离心管中,加入10.0 mg/mL十三烷酸内标溶液 0.5 mL、4 mol/L盐酸6 mL,漩涡混匀1 min,置于60℃恒温振荡水槽,100 r/min振荡30 min,沸水浴煮5 min,-20℃速冷后加入20 mL三氯甲烷-甲醇(1∶1)混合溶剂,漩涡混匀 2 min,5 000 r/min离心 10 min,取氯仿层,加等体积的0.1%氯化钠溶液,混匀,5 000 r/min离心10 min,取氯仿层移至干燥的100 mL三角瓶中,旋转蒸发除去氯仿,得到油脂。
1.2.3.2 脂肪酸甲酯的制备[15]
所得油脂加10 mL 0.5 mol/L NaOH-CH3OH,充N2,连接冷凝器,置于水浴上回流10 min后立即加入7 mL 13%~15%BF3-CH3OH于沸腾的溶液中,继续煮沸,回流20 min。加入20 mL异辛烷于沸腾的混合溶液中,停止加热,加入20 mL饱和NaCl溶液,在漩涡混合器上混合1 min,静置分层,移取4~5 mL上清液至10 mL具塞试管中,加入适量无水Na2SO4脱水,移取1 mL脱水试液作为样品溶液备用。
1.2.4 分析测定
按上述色谱条件,待基线稳定后,标样、样品溶液分别等体积进样,进行气相色谱分析,以样品峰的保留时间与脂肪酸甲酯标准品的保留时间定性,按内标法计算各脂肪酸的含量。
2 结果与讨论
2.1 水产饲料油脂提取方法的选择
饲料油脂的提取方法有索氏抽提法、酸水解-索氏抽提法[16],因从饲料经销商了解到,本试验采集的部分水产饲料样品中添加了DHA藻粉,在试验设计时就采用酸水解-索氏抽提法测定样品粗脂肪含量,结果见表1,6个样品所得粗脂肪测定结果均大大低于产品标示含量,这可能是因为试验样品添加了一定量的DHA藻粉,采用常规的酸水解法未有效破坏DHA藻粉的细胞壁,所用石油醚极性弱、提取效果不理想。试验参考了文献[15]酸热法,利用盐酸对细胞壁中糖及蛋白质等成分的作用,在60℃水浴中振荡30 min,使原来结构紧密的细胞壁变得疏松,再经沸水浴及-20℃速冻处理,使细胞壁进一步被破坏,再用极性较强的三氯甲烷-甲醇混合溶剂有效地浸提出DHA藻粉细胞中的油脂。事实证明,酸热法所得粗脂肪测定结果与产品标示含量基本一致,所得油脂中的DHA含量与酸水解-索氏抽提法相比大大提高,进一步说明酸水解-索氏抽提法不能充分有效提取DHA藻粉中的油脂。

表1 2种油脂提取方法脂肪测定结果比较/g/100 g
2.2 色谱条件及内标物的选择
为了使37种混合脂肪酸甲酯能够完全分离、准确定量,参考了国家标准[17],选择可完全分离脂肪酸异构体的SPTM-2560石英毛细管柱(100 m×0.25 mm i.d.×0.20μm),试验采用程序升温,对色谱条件进行了选择、优化,选择分离时间较短、能把Supelco37种脂肪酸甲酯混合标准溶液中各脂肪酸甲酯达到最佳分离状态时的条件确定为色谱条件。在此色谱条件下,37种脂肪酸甲酯出峰顺序见图1。
色谱内标物应与被测组分的相对分子质量和沸点相近、结构相似,且保留时间相近,但又能分开。试验选择十三烷酸为内标物,按照所选择的色谱条件,供试品不加内标物、加内标物的色谱图如图2、图3。结果表明,待测成分及内标物分离效果良好,十三烷酸是较理想的内标物。

图1 Supelco 37种脂肪酸甲酯混合标准溶液色谱图

图2 饲料样品未加内标物色谱图

图3 饲料样品加内标物色谱图
2.3 线性范围
分别准确移取0.10、0.20、0.50、1.0、2.0 mL脂肪酸甲酯混合标准储备液(1.2.1.2),用 0.25 mg/mL十三烷酸甲酯内标溶液(1.2.1.1)稀释至10.0 mL,摇匀,在上述色谱条件下分析测定。以各脂肪酸甲酯标准品与内标物的质量浓度比为横坐标(x),相对应的标准品与内标物峰面积比为纵坐标(y),进行线性回归,结果见表2。试验结果表明,相关系数均在0.997 6以上,说明在测定的浓度范围内,FID的响应与脂肪酸甲酯的质量浓度成线性相关。

表2 9种脂肪酸的标准曲线、线性范围、相关系数、加标回收率和相对标准偏差(n=6)
2.4 回收率、精密度和最低定量限
准确称取饲料样品1.0 g(精确至0.000 1 g),置50 mL离心管中,分别添加3个浓度梯度的9种脂肪酸,其中棕榈酸、油酸、亚油酸添加量为10.0、20.0、50.0 mg,其余 6种脂肪酸添加量为 1.0、2.0、5.0 mg,每个梯度重复2次,方法的回收率结果和相对标准偏差见表2。以信噪比S/N=10且回收率和精密度较好的浓度点计算最低定量限(LOQ),9种脂肪酸甲酯的最低定量限为2 mg/kg。
2.5 实际样品测定
按上述方法,分别测定6批水产饲料样品的脂肪酸含量,结果见表3。
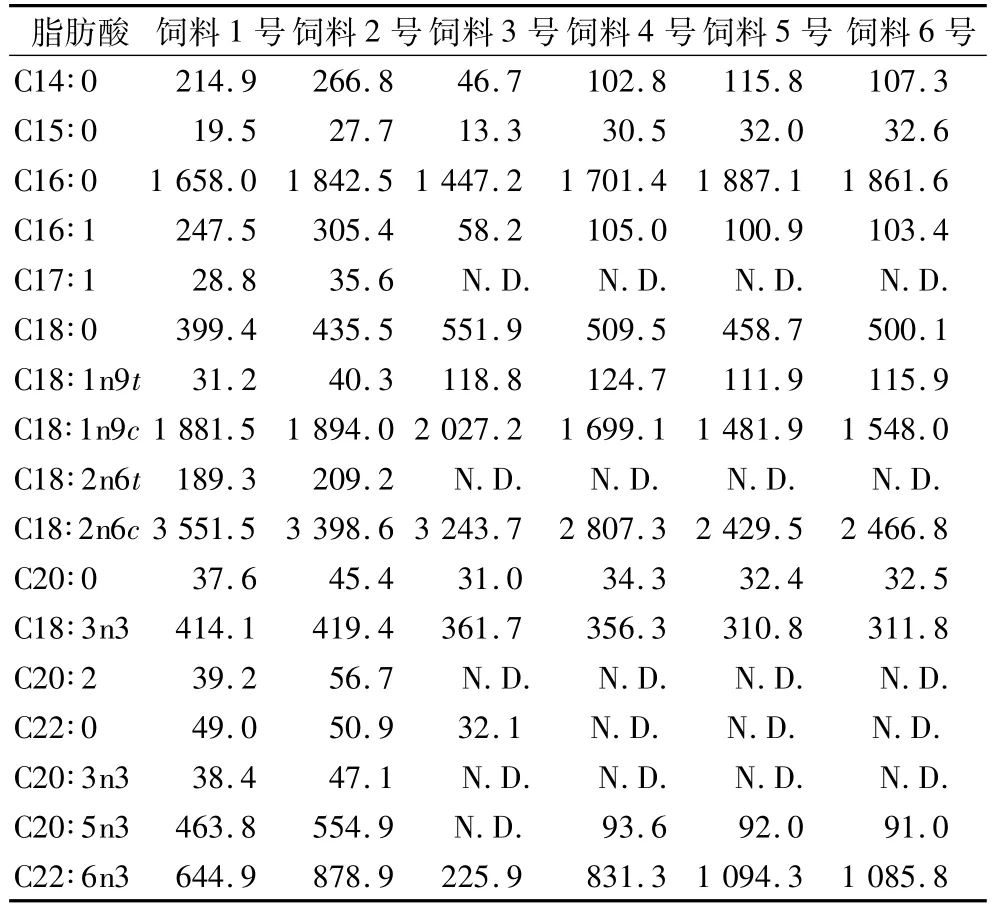
表3 样品测定结果/mg/100 g
3 结论
采用酸热法提取饲料油脂,氢氧化钾-甲醇皂化、三氟化硼-甲醇甲酯化进行衍生,前处理简单、快速、易操作,SPTM-2560毛细管柱可有效分离各种脂肪酸甲酯的异构体,分离效果好,用十三烷酸内标物定量,测定结果重现性好、可信度高,为水产饲料脂肪酸的质量控制提供了检测方法依据。
[1]Ronald W H,Delbert M G,Shiau Shi-Yen,et al.Nutrient requirements of fish and shrimp committee[M].National Research Council,2011:116-117
[2]季文娟.高度不饱和脂肪酸对中国对虾亲虾的产卵和卵质的影响[J].水产学报,1998,22(3):240-246
[3]吉红,曹艳姿,刘品,等.饲料中HUFA影响草鱼脂质代谢的研究[J].水生生物学报,2009,33(5):881-889
[4]张凤枰,索有瑞,王洪伦,等.毛细管气相色谱内标法测定沙棘油中的脂肪酸[J].中国粮油学报,2008,23(1):198-202
[5]Dodds E D,McCoy M R,Rea L D,et al.Gas chromatographic quantification of fatty acid methyl esters:flame ionization detection vs.electron impactmass spectrometry[J].Lipids,2005,40(4):419-428
[6]Makahleh A,Saad B,Siang G H,et al.Determination of underivatized long chain fatty acids using RP-HPLC with capacitively coupled contactless conductivity detection[J].Talanta,2010,81:20-24
[7]张凤枰,刘耀敏,史俊友,等.超临界CO2萃取-气相色谱质谱法测定斑点叉尾鮰肌肉中的脂肪酸[J].分析化学,2010,38(2):163-168
[8]Pérez-Serradilla JA,Ortiz M C,Sarabia L,etal.Focused microwave-assisted soxhlet extraction of acorn oil for determination of the fatty acid profile by GC-MS Comparison with conventional and standard methods[J].Analytical and Bioanalytical Chemistry,2007,388:451-462
[9]You Jinmao,Zhao Xianen,Suo Yourui,etal.Determination of long-chain fatty acids in bryophyte plants extracts by HPLC with fluorescence detection and identification with MS[J].Journal of Chromatography B,2007,848:283-291
[10]Chen Xiangming,Dong Xiuli,You Jinmao,et al.Determination of free fatty acids from soil by LC-MSwith fluorescence detection and atmospheric pressure chemical ionization identification[J].Chromatographia,2010,72:171-175
[11]宋涛,张凤枰,刘耀敏,等.透反射近红外光谱法快速测定大豆油中的脂肪酸[J].光谱学与光谱分析,2012,32(8):2100-2104
[12]Flatten A,Bryhni E A,Kohler A,et al.Determination of C22:5 and C22:6 marine fatty acids in pork fatwith fourier transform mid-infrared spectroscopy[J].Meat Science 2005,69:433-440
[13]GB/T 21514—2008饲料中脂肪酸含量的测定 [S]
[14]李植峰,张玲,沈晓京,等.四种真菌油脂提取方法的比较研究[J].微生物学通报,2001,28(6):72-75
[15]GBT 17376—2008动植物油脂 脂肪酸甲酯制备 [S]
[16]GB/T 6433—2006饲料中粗脂肪的测定 [S]
[17]GB/T 17377—2008动植物油脂 脂肪酸甲脂的气相色谱分析[S].
Determination of Fatty Acids in Aquatic Feed with Gas Chromatography by Using Internal Standard Method
Zhang Fengping1,2Luo Binyue1Du Xueli1Cao Jing2Liu Yaomin1
(Key Laboratory of Aquatic,Livestock,Poultry Nutrition and Healthy Culturing,Ministry of Agriculture,Tongwei Co.Ltd.1,Chengdu 610041)
(College of Food Science and Technology,Shanghai Ocean University2,Shanghai 201306)
A gas chromatographic method for determination of fatty acids in aquatic feed was established and tridecanoic acid was selected as the internal standard substance.The lipid of aquatic feed samplewas extracted by acidheatingmethod,saponified with KOH-CH3OH and the fatty acids were methylated with BF3-CH3OH.The obtained fatty acid methyl esterswere seperated by gas chromatography using a SPTM-2560 capillary column and analyzed by a flame ionization detector.Retention time of the peaks could be applied for quantative analysis.Internal standard method was used for quantitative analysis.The results showed that under the condition of selected chromatography,37 kinds of fatty acid methyl esters can separate wellwithin 65 min.Standard recovery rate ofmain 9 kinds of fatty acid was 88.4%~107.5%with relative standard deviation of2.28%~4.79% ,and the limit of quantitation(S/N=10)was 2.0 mg/kg.The simple,effective and reproduciblemethod can be used for the fatty acids determination of a lot of aquatic feed samples.
gas chromatography,internal standard method,fatty acids,aquatic feed
S816.2
A
1003-0174(2015)01-0136-05
四川省科技支撑计划(2011NZ0071)
2013-09-29
张凤枰,男,1972年出生,高级工程师,食品饲料质量安全检测
