苦荞麸皮多酚抑制人结肠癌细胞Caco-2增殖活性研究
2015-12-18李富华张小利
李富华 张小利 明 建,3
(西南大学食品科学学院1,重庆 400715)(华南理工大学轻工与食品学院2,广州 510640)(农业部农产品贮藏保鲜质量安全与风险评估重点实验室3,重庆 400715)
苦荞麸皮多酚抑制人结肠癌细胞Caco-2增殖活性研究
李富华1,2张小利1明 建1,3
(西南大学食品科学学院1,重庆 400715)(华南理工大学轻工与食品学院2,广州 510640)(农业部农产品贮藏保鲜质量安全与风险评估重点实验室3,重庆 400715)
研究了产自重庆酉阳的苦荞(Fagopyrum tartaricum L.Gaerth,FG1)麸皮和四川西昌的苦荞(Fagopyrum tartaricum L.Gaerth,FG2)麸皮中酚类化合物的含量、抗氧化和抗增殖活性。结果表明:FG1和FG2 2种苦荞麸皮总酚含量分别为(26.40±0.41)和(27.00±0.72)mg GAE/g DW,且游离态是其酚类化合物的主要存在形式(约占其总酚含量的93%);2种苦荞麸皮酚提取物均表现出一定的抗氧化性,并且FG2的抗氧化能力强于FG1(P<0.05),FG1和FG2的DPPH自由基清除能力总IC50值分别为(39.56±2.76)和(24.69±0.33)μg·mL-1;还原力总 EC50值分别为(97.92±1.4)和(73.18±4.32)μg·mL-1;在抗增殖试验中,与对照组相比,FG1和FG2游离酚提取物均能明显抑制人结肠癌细胞Caco-2增殖(P<0.05)。然而,在不产生细胞毒性的浓度范围内,其结合酚提取物却表现出极弱的抗增殖作用。
苦荞麸皮 酚类化合物 抗氧化 人结肠癌细胞Caco-2 抗增殖
荞麦为蓼科一年生宿根性双子叶植物,常见的种植品种为甜荞(Fagopyrum esculentumMöench)和苦荞(Fagopyrum tartaricum L.Gaerth),荞麦不仅富含膳食纤维、维生素及高生物价的蛋白质等营养元素,还含有芦丁、槲皮素等功能性成分[1]。研究发现,经常摄食荞麦或其他全谷物制品能有效降低心脑血管疾病、糖尿病、某些癌症和死亡的发生率,此类保健功效的发挥,与其所含的酚类化合物有密切关系[2-3]。此外,酚类化合物能明显抑制肿瘤细胞增殖。Lee等[4]指出薏米麸皮甲醇提取物乙酸乙酯浸出部分的多酚化合物对HT-29和COLO-205人体结肠癌细胞有明显的抗增殖作用。蓝莓花色苷对结肠癌HT-29和SW48的抑制作用主要是通过降低前恶性肿瘤细胞的比率、促进肿瘤细胞凋亡来实现[5]。葡萄多酚对肝癌Hepa1c1c7细胞的抗增殖作用具有浓度剂量关系,荔枝皮多酚对肝癌细胞SMMC-7721有抑制作用,其机理主要体现在荔枝皮多酚能够诱导癌细胞凋亡,并抑制癌细胞DNA的合成而起到抗增殖的作用[6]。另外,苹果皮、葡萄籽、草莓、马铃薯等多酚能显著抑制肿瘤细胞肝癌细胞HepG2、结肠癌细胞 Caco-2、乳腺癌细胞 MCF-7增殖[7-9]。因此,植物酚类化合物在抗肿瘤治疗药物研发方面,有很大的研究潜力和开发空间。
目前,对荞麦中酚类化合物的研究主要集中在酚类化合物提取工艺的优化[10],荞麦酚类提取物化学抗氧化活性[11]、含量分布等方面[12],而对荞麦酚类化合物抑制肿瘤细胞增殖活性的研究基本未涉及。本研究目的包括:1)以产自重庆酉阳的苦荞(FG1)麸皮和四川西昌的苦荞(FG2)麸皮为试验对象,检测其游离态酚和结合态酚的含量;2)通过DPPH自由基清除力和还原力试验,验证苦荞麸皮游离酚和结合酚提取物的抗氧化能力;3)评价苦荞麸皮游离酚和结合酚提取物抑制人结肠癌细胞(Caco-2)增殖的活性。
1 材料与方法
1.1 材料和试剂
本试验选择2种产自重庆酉阳和四川西昌的苦荞作为试验材料。苦荞籽粒(收获于2012年10月,抽真空包装)粉碎,所得粉碎物过40目和60目筛,收集位于40目~60目之间的荞麦麸皮样品,密封,置于干燥器内备用。
三氯乙酸、DPPH自由基:成都科龙化工试剂公司;人结肠癌细胞Caco-2:美国菌种保藏中心;Folin-Ciocalteu福林酚试剂、羟乙基哌嗪乙硫磺酸(N-2-hydroxyethylpiperazine-N-ethane-sulphonicacid,Hepes)、青霉素与链霉素混合液(100×):美国 Sigma公司;胎牛血清(Fetal bovine serum,FBS)、0.05%胰酶-EDTA消化液(Trypsin-ethylene diamine tetraacetie acid,EDTA)和高糖培养基:美国Gibco公司。
1.2 仪器与设备
722型分光光度计:上海精科科学仪器厂;HERA cell 240型CO2细胞培养箱美国Thermo公司;DM IRB型荧光倒置显微镜:德国Leica仪器有限公司;Spectra Max M2型连续光谱密度荧光检测仪:美国Molecular公司;T25、T75细胞培养瓶:美国 Corning公司。
1.3 方法
1.3.1 荞麦酚类化合物提取方法
参照Adom等[13]的方法,将游离酚和结合酚提取液贮存于-80℃,3周内检测。
1.3.2 酚含量检测
没食子酸标准曲线的制备:方法参考Adom等[13],根据浓度与吸光度值所绘制的曲线,得到没食子酸浓度与吸光度值的回归方程为:
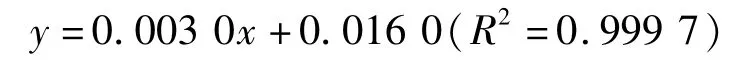
式中:y表示吸光度;x表示没食子酸质量浓度/μg·mL-1,根据该回归方程计算待检样品中,酚类物质的含量。
荞麦样品中酚类化合物含量检测:取0.2 mL提取液(可作适当稀释)并用去离子水补至1 mL,后续操作方法同Adom等[13]。每个样品做3组平行,结果表示为平均值±标准偏差。
1.3.3 DPPH自由基清除力试验
参考Vaher等[14]的方法,根据本实验室条件稍作修改,即将样品酚类化合物提取液做相应稀释,配制成质量浓度梯度为0.05~1.0μg·mL-1的反应液,加入5 mL 0.1 mmol·L-1的 DPPH·溶液混匀,于室温下避光静置30min,然后于517 nm波长处,测其吸光度。以维生素C为对照品。根据下式计算样品清除DPPH自由基的能力:
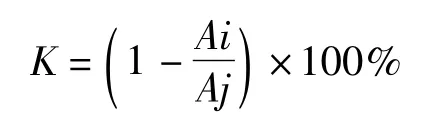
式中:K表示样品对DPPH自由基的清除率;Ai表示样品的吸光度;Aj表示作为对照的DPPH·溶液的吸光度。
试验选择IC50值作为评价DPPH自由基清除力大小的标准[15],每个样品做3组平行,结果表示为平均值±标准偏差。
1.3.4 还原力试验
参考Ferreira等[16]的方法,提取液的体积范围为0.2~0.8 mL。以维生素C为对照品,其质量浓度范围为10~100μg·mL-1。每个样品做3组平行,结果表示为平均值±标准偏差。
1.3.5 细胞毒性试验
参考 Salawu等[17]的方法,即取对数生长期的Caco-2细胞接于96孔白板,使每孔细胞数约为4×104个,于37℃,5%CO2下培养6 h后,移去残余培养基,PBS清洗1次。其中,样品孔中加入100μL含样品的培养基,控制孔中加入100μL的培养基,于37℃,5%CO2下培养24 h后,开始测板,即移去96孔板内残余培养基,PBS清洗1次,加50μL/孔亚甲基蓝溶液,于培养箱中放置1 h,移去染色液,去离子水中清洗该96孔板至清洗液无色,吸去多余水分并风干,加100μL/孔洗脱液,然后震荡至形成均匀的细胞悬浮液,于570 nm下读取各孔中染色细胞悬浮液的吸光度。与控制孔相比,减少的吸光度≧10%时,即认为该样品浓度下具有细胞毒性。
1.3.6 细胞抗增殖试验
参考Wolfe等[18]的方法,即取对数生长期Caco-2细胞接种于96孔白板,使每孔细胞数约为2.5×104个,于37℃,5%CO2下,培养6 h后,移去残余培养基,PBS清洗1次。其中,样品孔中加入100μL含样品的培养基,控制孔中加入100μL的培养基,于37℃,5%CO2下培养72 h后开始测板,测板操作同上述1.3.5细胞毒性试验。
细胞增殖抑制率=(1-样品组吸光度值/对照组吸光度值)×100%
1.4 数据处理
每个样品至少3次重复,试验结果表示为平均值±标准差.使用MS Excel软件计算DPPH自由基清除力试验的IC50值和还原力试验的EC50值以及抗增殖试验的EC50值;SPSS17.0软件计算差异性,在P<0.05水平分析显著性差异(t检验法);图表采用Sigma plot绘制。
2 结果与分析
2.1 酚类化合物含量及抗氧化能力
酚含量结果以每克荞麦样品中所含的没食子酸当量(mg gallic acid equivalent/g dry-weight basis,mg GAE/g DW)表示。由表1可知,2种苦荞麸皮游离态酚和结合态酚的含量分别约占其总酚含量的93%和6%,也即游离态是苦荞麸皮中酚类化合物的主要存在形式,该结论与Guo等[19]的报道一致。2种苦荞麸皮结合酚含量无显著差异,游离酚和总酚含量在P<0.05水平存在差异。这种差异性可能是由于品种不同所致。此外,植物酚类化合物的含量也受植物的生长环境、采摘期等因素的影响[2]。
DPPH自由基清除能力试验中,2种苦荞麸皮游离和结合酚类化合物的IC50值见表1。FG2游离酚(2.80μg·mL-1)和结合酚(21.89μg·mL-1)的IC50值均低于FG1游离酚(3.0μg·mL-1)和结合酚(36.56μg·mL-1),即苦荞麸皮游离酚提取物清除DPPH自由基能力强于其结合酚,甚至强于对照品维生素 C(IC50,8.39μg·mL-1),此外,与苦荞麸皮FG1相比,FG2清除DPPH自由基的能力较强(P<0.05)。
还原力试验中,2种苦荞麸皮游离和结合酚类化合物的EC50值见表1。FG2游离酚(4.72μg·mL-1)和结合酚(68.46μg·mL-1)的 EC50值均低于 FG1游离酚(12.55μg·mL-1)和结合酚(85.38μg·mL-1),根据EC50值的定义,该值越低则样品的还原力越强。即苦荞麸皮游离酚提取物的还原力强于其结合酚,甚至强于对照品维生素C(EC50,57.63μg·mL-1),此外,与苦荞麸皮FG1相比,FG2麸皮酚提取物的还原力较强(P<0.05)。
2.2 抗肿瘤细胞增殖活性
表2列出了2种苦荞麸皮游离酚和结合酚提取物对Caco-2细胞抗增殖作用的半数有效剂量EC50值。此处EC50值的定义为:当细胞细胞增殖率下降至50%时,所需样品的浓度,EC50值越低,则样品的抗增殖活性越强。
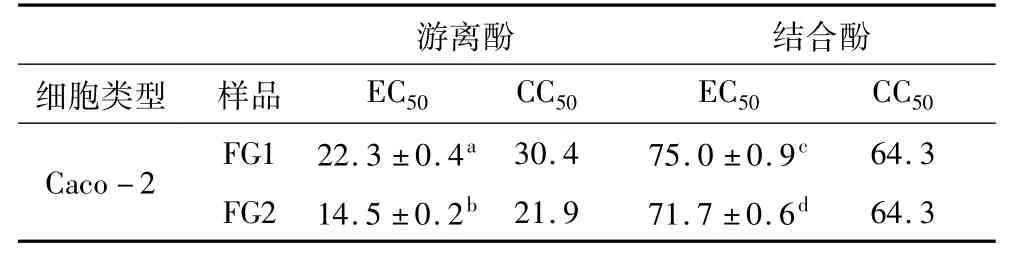
表2 2种苦荞麸皮酚提取物对Caco-2细胞的EC50值及相应的细胞毒性值CC50/mg/mL
FG1游离酚提取物对Caco-2细胞抗增殖作用的EC50值(22.3±0.4)mg·mL-1显著高于 FG2(14.5±0.2)mg·mL-1(P<0.05,表2),说明 FG2游离酚对Caco-2细胞增殖的抑制能力强于FG1。与其他食物相比,苦荞麸皮FG1和FG2游离酚提取物对Caco-2细胞抗增殖作用的EC50值明显低于马铃薯多酚提取物(30.9±8.8)~(101±9.3)mg·mL-1),但低于核桃(1.8±0.1)mg·mL-1、美国山胡桃(2.5±0.1)mg·mL-1等某些坚果的 EC50值[9,20]。
2种苦荞麸皮结合酚提取物对Caco-2细胞抗增殖作用的EC50值虽然被计算出(见表2),但该值却大于其相应的CC50值,这可能是由于结合酚提取物对结肠癌细胞增殖抑制作用不明显所致。
FG1、FG2苦荞麸皮游离酚提取物对Caco-2细胞增殖活性的影响,见图1。2种苦荞麸皮游离酚样品的抗增殖曲线明显低于空白对照组的抑制曲线,说明FG1、FG2游离酚提取物具有抑制Caco-2细胞增殖的能力。当苦荞麸皮FG1游离酚的质量浓度≧14.29 mg·mL-1时即可显著抑制Caco-2细胞的增殖(P<0.01),并呈现一定的剂效关系(图1a),当苦荞麸皮FG1游离酚的质量浓度为28.57 mg·mL-1时,Caco-2细胞的增殖率仅达到33.7%,但当苦荞麸皮FG1游离酚的质量浓度≧30.36 mg·mL-1时,则会产生细胞毒性,此时的抗增殖作用可能是由细胞毒性作用引起。对于苦荞麸皮FG2而言,当其游离酚质量浓度≧7.8 mg·mL-1时则可显著抑制Caco-2细胞的增殖(P<0.01),并呈现一定的剂效关系(图1b),当苦荞麸皮FG2游离酚的质量浓度为20.3 mg·mL-1时,Caco-2细胞的增殖率仅达到34.3%,需指出的是,当苦荞麸皮FG2游离酚的质量浓度≧21.9 mg·mL-1时,其抗增殖作用可能主要由细胞毒性作用引起。
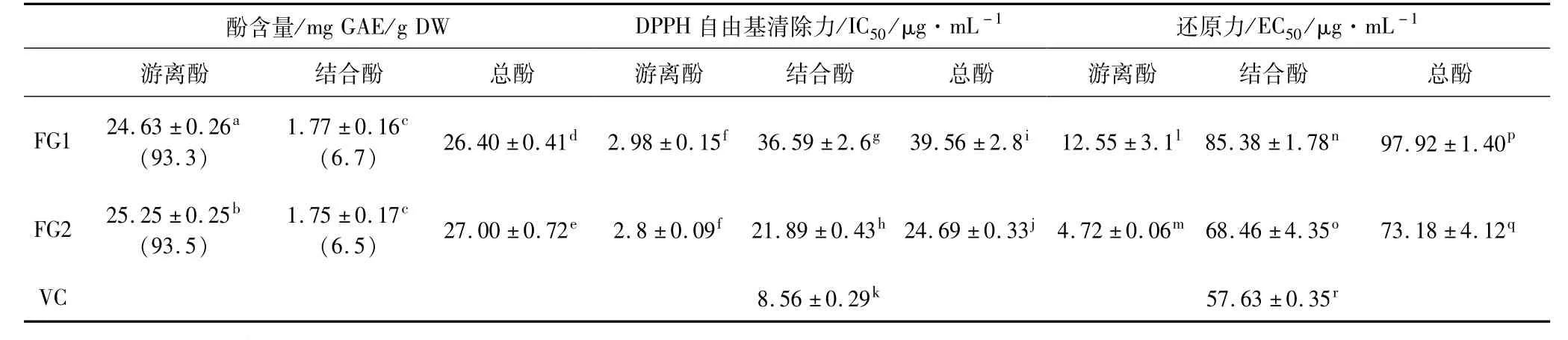
表1 2种苦荞麸皮游离酚和结合酚含量及其DPPH自由基清除力和还原力
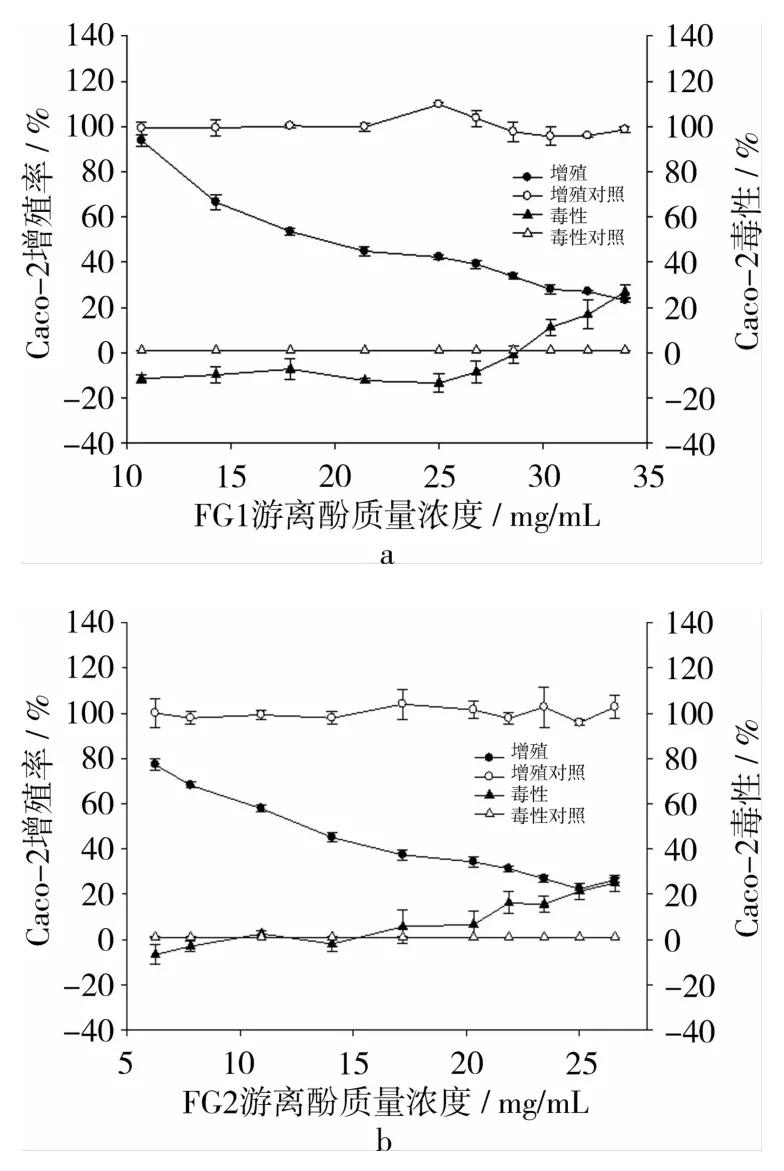
图1 2种苦荞麸皮游离酚对Caco-2细胞的抗增殖作用及毒性作用
相反,在不产生细胞毒性的浓度范围内,苦荞麸皮FG1结合酚(图2a)和苦荞麸皮FG2结合酚(图2b)的生长抑制曲线与对照组细胞相比,并未表现出明显的抑制趋向。在细胞培养孔中,当结合酚样品质量浓度低于42.9 mg·mL-1时反而表现出促Caco-2细胞生长的作用。但当FG1和FG2结合酚质量浓度≧64.3 mg·mL-1时,其抗增殖作用可能主要由细胞毒性作用引起。从整体趋势分析,可认为苦荞麸皮FG1和FG2结合酚样品对Caco-2细胞增殖表现出极弱的抑制作用。
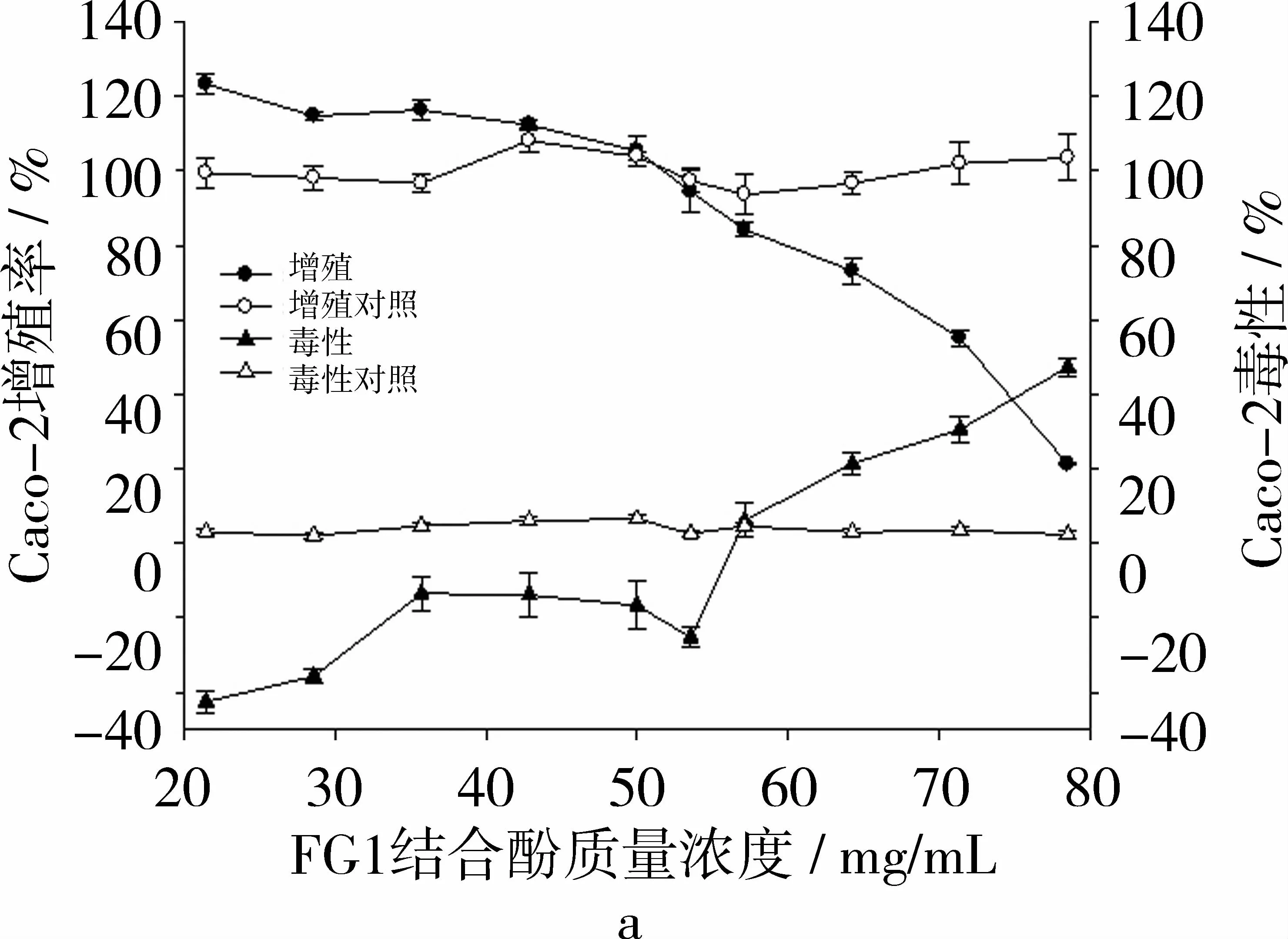
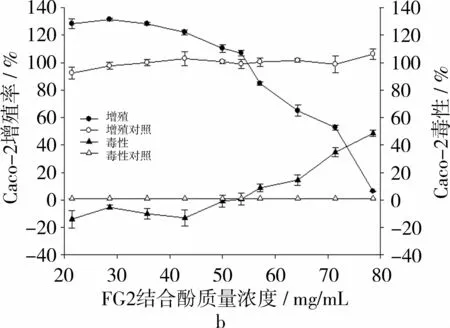
图2 2种苦荞麸皮结合酚对Caco-2细胞的抗增殖作用及毒性作用
3 讨论
本研究发现,FG1和FG2 2种苦荞麸皮中的酚类化合物的含量远高于黑米胚乳、小麦胚乳和荞麦粉部位的总酚含量[10,14,21-22],且主要以游离态存在。但在其他谷物中,如小麦、黑麦、玉米、燕麦及大米中的酚类化合物主要以结合态存在[14,23]。FG1和FG2 2种苦荞麸皮酚类提取物均具有一定体外抗氧化能力,因此苦荞麸皮可作为天然抗氧化剂——酚类化合物的开发资源。在抑制肿瘤细胞增殖试验中,2种游离酚提取物对Caco-2肿瘤细胞的抑制率并不相同,类似的结论在坚果类多酚提取物抗增殖活性的研究中也得到验证[24]。2种苦荞麸皮结合酚提取物对Caco-2细胞增殖仅表现出极弱的抑制作用,但并不能就此忽视荞麦结合态酚的生物活性价值。研究发现,结合态的植物化学物质(如酚类化合物、多糖、植物固醇、木质素等),以未被消化的形态进入结肠部位,最终被肠道微生物分解产生小分子的活性成分。例如谷物麸皮中的二聚阿魏酸,其本身以酯键形式与植物细胞壁组分结合,经肠道微生物分解后,以游离态的形式被肠道吸收并进入机体的循环系统,发挥其生物活性[32]。FG1和 FG22种苦荞麸皮酚提取物抗Caco-2细胞增殖作用的发挥,可能是酚类化合物本身具有的功效,也可能是由于酚类组分与食品基质中的其他成分通过协同、叠加亦或拮抗等综合作用的结果[32]。苦荞麸皮中主要的酚类化合物为黄酮和酚酸类[25],这些酚类化合物的含量及成分组成与细胞抗增殖作用密切相关[34]。研究发现,以单体形式存在的黄酮类化合物(如白藜芦醇、槲皮素、儿茶素和表儿茶素)以及酚酸(如没食子酸、咖啡酸和阿魏酸)能有效抑制肿瘤细胞的增殖和扩散[26]。酚类化合物的化学结构也影响着其细胞抗增殖活性,其中,经二羟基和三羟基丙酯化的咖啡酸和没食子酸对肿瘤细胞的抗增殖活性要强于经甲基和辛基化的咖啡酸和没食子酸[27]。此外,可根据酚类化合物的亲油性、空间位阻效应和(或)抗氧化活性来预测其抗增殖能力[28]。由此,可考虑对苦荞麸皮结合酚进行结构修饰以提高其肿瘤细胞抗增殖活性。
4 结论
研究发现,产自重庆酉阳(FG1)和四川西昌(FG2)的2种苦荞麸皮,其总酚含量分别为(26.40±0.41)和(27.00±0.72)mg GAE/g DW,并且,游离态是2种苦荞麸皮酚类化合物的主要存在形式。
DPPH自由基清除力试验和还原力试验结果均表明,FG1和FG2 2种苦荞麸皮酚提取物均具有一定的抗氧化活性,并且游离酚提取物的DPPH自由基清除力和还原力均强于其结合态的,甚至也强于对照品维生素C(P<0.05)。此外,产自四川西昌的苦荞麸皮FG2的抗氧化活性要强于产自重庆酉阳FG1(P<0.05)。
抑制人结肠癌细胞Caco-2增殖活性试验结果表明,FG1和FG2苦荞麸皮游离酚提取物均能显著抑制人结肠癌细胞Caco-2的增殖,并表现出一定的剂量—效应关系。
[1]Dykes L,Rooney LW.Phenolic compounds in cereal grains and their health benefits[J].Cereal Foods World,2007,52:105-111
[2]Liu R H.Whole grain phytochemicals and health[J].Journal of Cereal Science,2007,46(3):207-219
[3]Schieber A,Stintzing F C,Carle R.By-products of plant food processing as a source of functional compounds-recent developments[J].Trends in Food Science& Technology,2001,12(11):401-413
[4]Lee M Y,Tsai SH,Kuo Y H,et al.Anti-tumor and anti-inflammatory activity of the methano extracts from adlay bran[J].Food Science and Biotechnology,2008,17(6):1265-1271
[5]Flis S,Jastrzebski Z,Namiesnik J,etal.Evaluation of inhibition of cancer cell proliferation in vitrowith differentberries and correlation with their antioxidant levels by advanced analyticalmethods[J].Journal of Pharmaceutical and Biomedical Analysis,2012,62:68-78
[6]左丽丽.狗枣猕猴桃多酚的抗氧化与抗肿瘤效应研究[D].哈尔滨:哈尔滨工业大学,2013
[7]Wolfe K,Wu X Z,Liu R H.Antioxidant activity of apple peels[J].Journal of Agricultural and Food Chemistry,2003,51:609-614
[8]Sun J,Liu R H.Cranberry phytochemical extracts induce cell cycle arrest and apoptosis in human MCF-7 breast cancer cells[J].Cancer Letters,2006,241:124-134
[9]王全逸.马铃薯多酚类化合物对结肠癌和肝癌细胞增殖的影响及花色苷生物合成关键酶基因的研究[D].南京:南京农业大学,2010
[10]Inglett GE,Chen D,Berhowa M,etal.Antioxidantactivity of commercial buckwheat flours and their free and bound phenolic compositions[J].Food Chemistry,2011,125:923-929
[11]Sun T,Ho C T.Antioxidantactivities of buckwheat extracts[J].Food Chemistry,2005,90:743-749
[12]Holasova M,Fiedlerova V,Smrcinova H,et al.Buckwheat—the source of antioxidant activity in functional foods[J].Food Research International,2002,35:207-211
[13]Adom K K,Liu R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry,2002,50(21):6182-6187
[14]Vaher M,Matso K,Levandi T,et al.Phenolic compounds and the antioxidant activity of the bran,flour and whole grain of different wheat varieties[J].Procedia Chemistry,2010,2(1):76-82
[15]Sharma O P,Bhat T K.DPPH antioxidant assay revisited[J].Food Chemistry,2009,113:1202-1205
[16]Ferreira ICFR,Baptista P,Vilas-BoasM,etal.Freeradical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J].Food Chemistry,2007,100:1511-1516
[17]Salawu SO,Akindahunsi A A,Sanni D M,et al.Cellular antioxidantactivities and cytotoxic properties ofethanolic extracts of four tropical green leafy vegetables[J].African Journal of Food Science,2011,5:267-275
[18]Wolfe K L,Liu R H.Cellular antioxidant activity(CAA)assay for assessing antioxidants,foods,and dietary supplements[J].Journal of Agricultural and Food Chemistry,2007,55(22):8896-8907
[19]Guo X D,Ma Y J,John P,etal.Phenolics contentand antioxidant activity of tartary buckwheat from different locations[J].Molecules,2011,16:9850-9867
[20]Yang J,Liu R H,Halim L.Antioxidant and antiprolifera-tive activities of common edible nut seeds[J].LWT-Food Science and Technology,2009,42:1-8
[21]Kong S,Lee J.Antioxidants in milling fractions of black rice cultivars[J].Food Chemistry,2010,120(1):278-281
[22]Li FH,Yuan Y,Yang X L,etal.Phenolic profiles and antioxidant activity of buckwheat(Fagopyrum esculentum Möench and Fagopyrum tartaricum L.Gaerth)hulls,brans and flours[J].Journal of Integrative Agriculture,2013,12,1684-1693
[23]Pereez-jimenez J,Torres J L.Analysis of non-extractable phenolic compounds in foods:the current state of the art[J].Journal of Agricultural and Food Chemistry,2011,59(24):12713-12724
[24]Xu B J,Chang S K C.Comparative study on antiproliferation properties and cellular antioxidantactivities of commonly consumed food legumes against nine human cancer cell lines[J].Food Chemistry,2012,134:1287-1296
[25]Guo X D,Wu CH,Ma Y J,et al.Comparison ofmilling fractions of tartary buckwheat for their phenolics and antioxidant properties[J].Food Research International,2012,49:53-59
[26]Ghasemzadeh A,Ghasemzadeh,N.Flavonoids and phenolic acids:role and biochemical activity in plants and human[J].Journal of Medicinal Plants Research,2011,5:6697-6703
[27]Fiuza SM,Gomes C,Teixeira L J,etal.Phenolic acid derivativeswith potential anticancer properties-a structureactivity relationship study.Part1:Methyl,propy and octyl esters of caffeic and gallic acids[J].Bioorganic&Medicinal Chemistry,2004,12:3581-3589
[28]Harris C S,Migahed FM L,Bennett SA L,et al.Plant phenolics regulate neoplastic cell growth and survival:a quantitative structure-activity and biochemical analysis[J].Canadian Journal of Physiology and Pharmacology,2007,85:1124-1138.
Anti-Proliferative Activity Toward Human Colon Cancer Cell(Caco-2)of Phenolic Compounds in Fagopyrum Tartaricum (L.)Gaertn Brans
Li Fuhua1,2Zhang Xiaoli1Ming Jian1,3
(College of Food Science,Southwest University1,Chongqing 400715)(College of Light Industrial and Food Science,South China University of Technology2,Guangzhou 510640)(Key Laboratory of Agricultural Products Quality Safety and Risk Assessment during Storage,Ministry of Agriculture3,Chongqing 400715)
The extracts from two categories ofFagopyrum tartaricum(L.)Gaertn bran from Youyang County,Chongqing(FG1)and Xichang City,Sichuan(FG2)have been screened for free and bound phenolic content respectively and total phenolic content(TPC),aswell as antioxidant and anti-proliferative activity in the paper.The results showed that the TPC of FG1 and FG2 were(26.40±0.41)and(27.00±0.72)mg GAE/g DW respectively.The free phenolics,which account for about93%of the TPC,were predominant in the two buckwheatbran.Phenolic compounds of FG1 and FG2 both expressed an antioxidant activity with the total IC50(39.56±2.76)and(24.69±0.33)μg·mL-1of DPPH free radical scavenging activity respectively;EC50(97.92±1.4)and(73.18±4.32)μg·mL-1of reducing power respectively.In the anti-proliferative activity assay,the free phenolic extracts of FG1 and FG2 showed significantly anti-proliferative activity toward human colon cancer cell(Caco-2)in vitrowhen compared to the control group(P<0.05).However,the bound phenolics of FG1 and FG2 showed extremely weak inhibitory toward Caco-2 cellswithin non-cytotoxic concentrations.
Fagopyrum tartaricum L.gaertn brans,phenolic compounds,antioxidant activity,human colon cancer cells(Caco-2),anti-proliferation
S517
A
1003-0174(2015)11-0031-06
中央高校基本科研业务费专项(XDJK2012B014),863计划(2011AA100805-2)
2014-04-19
李富华,女,1986年出生,博士,食品化学与营养学
明建,男,1972年出生,教授,食品化学与营养学
