粗硫酸镍溶液净化除杂试验研究
2015-12-16郭学益
李 伟,吴 展,郭学益
(1.中南大学 冶金与环境学院,湖南 长沙 410083;2.大冶有色金属有限责任公司稀贵金属厂,湖北 黄石 435005)
硫酸镍广泛应用于电镀、电池、催化、金属着色、塑料及陶瓷工业。近年来,由于通讯、计算机行业的迅猛发展,硫酸镍的需求量大幅增加[1-2]。目前,国内对硫酸镍的需求存在缺口,随着电池材料行业的发展,市场对硫酸镍的需求更加旺盛[3-4]。
铜冶炼生产过程中产出一种成分复杂的副产品粗硫酸镍,采用不同的净化工艺脱除其中的杂质,最终可得到电池行业采用的高品级硫酸镍。
1 试验原料及试剂
试验用粗硫酸镍为铜冶炼系统的副产品,溶解后的溶液成分见表1。粗硫酸镍成分复杂,杂质较多,其中的铜可加以回收。
试验所用试剂有AD100,P204,磺化煤油,聚合硫酸铁,碳酸钠,双氧水,氟化钠,氢氧化钠,浓硫酸,均为工业级;试验用水为纯净水。

表1 粗硫酸镍溶液成分 g/L
2 试验工艺流程
试验工艺流程如图1所示。
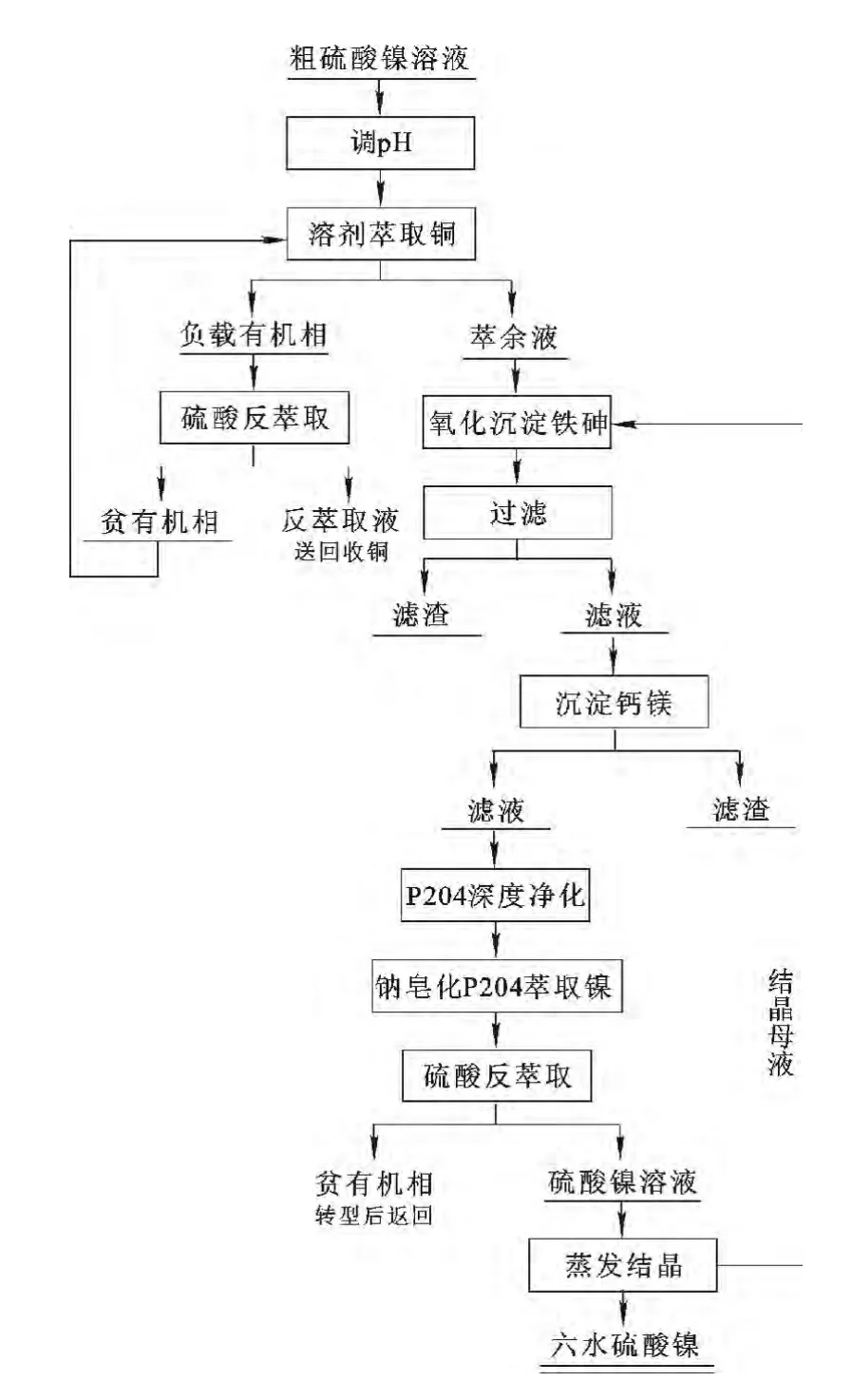
图1 粗硫酸镍溶液净化除杂工艺流程
3 试验结果与讨论
3.1 铜的溶剂萃取
将粗硫酸镍溶液pH调至2.0~2.5,用AD100作萃取剂,磺化煤油为稀释剂,控制相比VO∶VA=1∶3,萃取剂体积分数15%,在室温下萃取10min。3级萃取后得到的萃余液成分见表2。

表2 溶剂萃取铜后的萃余液成分 g/L
由表2看出:溶剂萃取铜后,粗硫酸镍溶液中的铜质量浓度大幅度降低。负载铜的有机相用2 mol/L稀硫酸溶液2级反萃取后,99%以上的铜转入反萃取液中。该反萃取液可送铜回收系统,反萃取后的有机相重新萃取铜,整个流程铜回收率超过95%[5-6]。
3.2 铁、砷的沉淀
采用氧化—水解沉淀法同时去除溶液中的铁、砷。溶液中加入氧化剂将铁、砷氧化到高价,之后加入除砷试剂聚合硫酸铁,利用AsO3-4 与Fe3+形成稳定的FeAsO4沉淀,再调整溶液pH使过量的Fe3+水解,从而实现铁、砷同时去除[7-8]。试验用双氧水作氧化剂,聚合硫酸铁溶液质量浓度为200g/L。
3.2.1 双氧水加入量对砷、铁沉淀率的影响
取除铜后溶液300mL,加入聚合硫酸铁溶液(200g/L)5mL,控制反应终点pH为4.0,在温度70℃下反应1h,双氧水用量对铁、砷沉淀率的影响试验结果如图2所示。
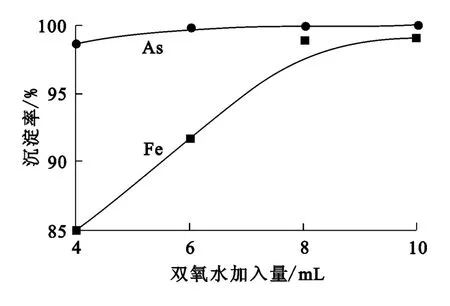
图2 双氧水加入量对砷、铁沉淀率的影响
3.2.2 聚合硫酸铁加入量对砷、铁沉淀率的影响
分别取300mL溶液,控制双氧水加入量为8 mL、终点pH为4.0,在70℃下反应1h,聚合硫酸铁溶液用量对铁、砷沉淀率的影响试验结果如图3所示。

图3 聚合硫酸铁加入量对砷、铁沉淀率的影响
由图3看出:随聚合硫酸铁溶液加入量增加,砷沉淀率增大,而铁沉淀率变化不大;当聚合硫酸铁溶液加入量为5mL时,砷基本沉淀完全,溶液中残余的As质量浓度低于1mg/L,此时铁沉淀率也达99%以上,残余铁质量浓度低于15 mg/L;继续增大聚合硫酸铁溶液用量,铁、砷沉淀率变化不大。综合考虑,确定聚合硫酸铁溶液加入量以5mL为宜。
3.2.3 反应终点pH对砷、铁沉淀率的影响
取溶液300mL,加入双氧水8mL,反应10 min后再加入5mL聚合硫酸铁溶液,在70℃下反应1h,终点pH对铁、砷沉淀率的影响试验结果如图4所示。
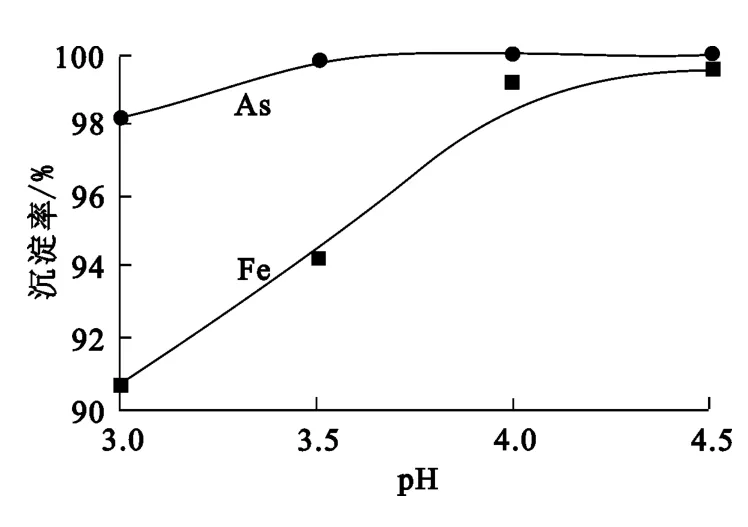
图4 终点pH对砷、铁沉淀率的影响
由图4看出:铁、砷沉淀率均随终点pH升高而升高,且铁沉淀率受终点pH的影响较为明显,当终点pH为4.0时,铁、砷沉淀率达最高;继续提高终点pH,铁、砷沉淀率几乎没有变化。为了保证铁能最大程度水解,同时又保证主金属回收终点pH不低于4.0,故确定适宜的反应终点pH为4.0。
3.2.4 反应温度对砷、铁沉淀率的影响
取溶液300mL,加入8mL双氧水,反应10 min,再加入聚合硫酸铁溶液5mL,控制终点pH为4.0,反应时间1h,反应温度对铁、砷沉淀率的影响试验结果如图5所示。

图5 反应温度对砷、铁沉淀率的影响
由图5看出:铁、砷沉淀率随反应温度升高而逐渐升高;温度为70℃时,砷沉淀率高于99%,铁沉淀率高于98%,溶液中残余的铁、砷质量浓度分别低于1mg/L和15mg/L;继续升高温度,铁、砷沉淀率变化不大,且双氧水分解损失率加大。综合考虑,确定适宜的反应温度为70℃。
3.3 钙、镁的沉淀
利用碱土金属氟化物溶解度较小、而重金属离子氟化物溶解度相对较大的特点,采用氟化钠作沉淀剂,在一定条件下沉淀钙、镁。试验条件为:反应温度70~80℃,反应时间2h,陈化时间1h,氟化钠过量系数1.6~2.0(相对于钙、镁总量),加入少量纯碱控制体系pH为4.0~5.0。在此条件下,除钙、镁后液中钙、镁质量浓度分别低于10mg/L和5mg/L,镍与钙、镁的质量比分别≥5 000和≥10 000。
3.4 溶液的深度净化
深度净化是利用 P204对 Fe3+、Cu2+、Pb2+、Zn2+、Mn2+、Ni2+等金属离子的萃取能力不同,通过控制一定条件将去除砷、铁、钙、镁后的溶液中的Pb2+、Zn2+、Mn2+及残余的少量Fe3+、Cu2+萃取到有机相中而与Ni2+分离。由于P204萃取金属离子是一个以自身碳链上的活性H+来置换重金属离子的过程,故在萃取过程中,H+不断置换金属离子而进入溶液,导致溶液酸度不断增大,进而抑制萃取过程的进行,因此,在萃取之前需要将P204进行转型处理。常用的方法是对P204进行钠皂化或镍皂化,即以Na+或Ni2+替代P204碳链上的 H+[10]。
试验用P204已预先钠皂化,皂化率为50%~60%。试验条件为:常温,有机相组成为20%P204+80%磺化煤油,相比VO∶VA=1∶1,溶液初始pH为4.0~5.0,萃取时间30min。萃取后,溶液中ρ(Cu2+)≤2mg/L,ρ(Fe3+)≤1 mg/L,ρ(Pb2+)≤2mg/L、ρ(Zn2+)≤2mg/L、ρ(Mn2+)≤2mg/L。先用2mol/L稀硫酸溶液洗涤有机相中的 Cu2+、Pb2+、Zn2+、Mn2+等,再用6 mol/L盐酸溶液洗涤其中的Fe3+,经2段洗涤反萃取后,得到纯净有机相,返回皂化后继续使用。
3.5 镍的萃取、反萃取
经过溶剂萃取除铜,氧化水解除铁、砷,沉淀除钙、镁,以及P204萃取深度净化后,溶液得到深度净化,但由于碳酸钠的加入及钠皂化过程中引入了大量Na+,故需要进行洗钠处理。P204对Ni2+的萃取能力大于对Na+的萃取能力,以皂化的P204在一定条件下萃取溶液中的Ni2+,洗涤去除夹带的少量Na+,然后以硫酸溶液反萃取Ni2+,得到纯净的硫酸镍溶液。试验条件为:常温,P204皂化率为80%~90%,萃取相比VO∶VA=1∶2,有机相组成为25%P204+75%磺化煤油,反萃取相比VO∶VA=4∶1,反萃取剂为4mol/L硫酸。上述条件下得到的硫酸镍溶液的成分见表3。

表3 纯净硫酸镍溶液成分 g/L
3.6 浓缩结晶硫酸镍
净化后的纯净硫酸镍溶液密度为1.22 g/mL,加温蒸发使其浓缩至1.60~1.62g/mL,停止加热,自然冷却,结晶六水硫酸镍。分析结果表明,所得硫酸镍产品质量符合HG/T 2824—2009规定的Ⅱ类优等品要求。
4 结论
对铜冶炼副产品粗结晶硫酸镍进行精制,获得了理想的效果。用高效萃取剂AD100分离粗硫酸镍溶液中的铜,用氧化—水解沉淀法净化分离铁、砷,以双氧水为氧化剂、聚合硫酸铁为沉淀剂,碳酸钠为中和剂去除铁、砷,再用化学沉淀法分离溶液中的钙、镁,然后用钠皂化的P204对溶液深度净化处理,采用钠皂化的P204萃取Ni2+使与Na+有效分离,然后对负载Ni2+的有机相进行反萃取得到纯净的硫酸镍溶液,最后对纯净的硫酸镍溶液蒸发浓缩,获得了符合HG/T 2824—2009的Ⅱ类优级硫酸镍产品。
[1]郭学益,吴展,李栋.镍红土矿处理工艺的现状与展望[J].金属材料与冶金工程,2009,37(2):3-9.
[2]张均杰,葛晓明.铜电解脱铜后液提取粗硫酸镍的生产实践[J].中国有色冶金,2011,40(5):15-18.
[3]崔敏.2011年镍市场回顾及2012年展望[J].有色金属,2012(2):22-23.
[4]孙梅君.2012年镍市场回顾及2013年展望[J].有色金属,2013(3):13-14.
[5]吴芳,吕军.铜萃取剂M5640从硫酸镍溶液中分离铜的应用研究[J].五邑大学学报(自然科学版),2004,18(1):25-27.
[6]Gupta B,Deep A,Singh V,et al.Recovery of Cobalt,Nickel,and Copper From Sea Nodules by Their Extraction With Alkylphosphines[J].Hydrometallurgy,2003,70(1):121-129.
[7]吴展,陈志友,候琼英,等.从粗硫酸镍溶液中净化分离铁砷实验研究[J].湿法冶金,2013,32(2):122-124.
[8]Jackson E.Hydrometallurgical extraction and reclamation[M].West Sussex:Ells Horwood Limited,1986:151-153.
[9]傅崇说.冶金溶液热力学原理与计算[M].北京:冶金工业出版社,1989:236-264.
[10]Sarangi K,Reddy B R,Bas R P.Separation of Co(Ⅱ)/Ni(Ⅱ)by the Sodium Salts of D2EHPA,PC88Aand Cyanex 272and Their Mixtures[J].Hydrometallurgy,1999,52(3):253.
