豆豉中抗氧化芽孢杆菌的多样性分析和鉴定
2015-12-16谢昕吕晓腾杨英歌黄继翔
谢昕,吕晓腾,杨英歌,黄继翔
1(徐州生物工程职业技术学院生物工程系,江苏徐州,221006)
2(德州昂立达生物技术有限公司,山东德州,253000)
机体在氧化过程中会产生多种自由基和其他活性氧,当自由基产生过多,超过机体对自由基的清除能力时,多余的自由基会导致DNA、脂质、蛋白质等生物分子的氧化损伤,与机体衰老和多种疾病的发生与发展有密切联系[1]。以大豆或豆粕为原料经微生物发酵提高其抗氧化能力或分离鉴定抗氧化成分已有较多研究,所使用的微生物种类包括霉菌、酵母、细菌等[2]。以枯草芽孢杆菌为代表的芽孢杆菌是研究较多的微生物类群之一,其种类多样且不同来源菌株的代谢多样性高,可产生抗氧化肽[3]、异黄酮类[4]、维生素 E[5]、糖蛋白[6]、胞外多糖[7]、硫醇类化合物[8]、多酚[9]等多种类型的抗氧化物质,是一类有良好应用前景的微生物类群。
芽孢杆菌是自然发酵豆豉中的优势菌群[10],我们从不同来源的自然发酵豆豉中分离纯化芽孢杆菌菌株,使用多种抗氧化性评价方法对菌株发酵豆粕上清液的抗氧化能力进行测量,对菌株及其抗氧化特性的多样性进行分析,为基于大豆或豆粕的功能性成分的开发提供菌株资源。
1 材料和方法
1.1 菌株的分离纯化
本试验室保存的43份自然发酵豆豉样品,称取10 g样品,分散在90 mL无菌生理盐水中,剧烈振荡并梯度稀释后涂布LB平板,37℃培养48 h,挑取形态有差异的不同菌落在LB平板上多次划线纯化,镜检确认产生芽孢后将菌株接种至LB斜面保存备用。
1.2 菌株筛选
1.2.1 发酵上清液制备
本地市售豆粕(凯氏定氮法测含氮量7.46%,含水量8.72%)粉碎并过100目筛。豆粕培养基:豆粕粉0.1 g/mL,蒸馏水余量,300 mL锥形瓶装液量75 mL,1×105Pa灭菌15 min。所保存菌株在LB液体培养基活化48 h后以体积比为3%的接种量接种,37℃,180 r/min振荡液培养24 h。发酵液12 000 r/min离心10 min,取上清用于后续试验。
1.2.2 初筛1,1-二苯基-2-苦肼基(DPPH·)清除率测定
[11]有改动。发酵上清液1.0 mL与0.04 mol/mL DPPH乙醇溶液3.0 mL混合,避光静置30 min,12 000 r/min离心10 min,测517 nm吸光度。以无水乙醇为空白对照。每个菌株重复测定3次。

1.3 复筛
1.3.1 羟基自由基(·OH)清除率测定
按参考文献[6]有改动,稀释10倍的发酵上清液1.0 mL,与6 mmol/L FeSO40.3 mL、6 mmol/L 水杨酸1.5 mL、双蒸水2.0 mL混合并摇匀,加入6 mmol/L H2O20.3 mL启动反应,室温静置10 min测510 nm吸光度。以双蒸水为空白对照。每个菌株重复测定3次。

1.3.2 超氧阴离子自由基(·O2-)清除率测定
按参考文献[6]有改动。取pH 8.2的0.05 mol/L Tris-HCl缓冲液3.0 mL,置于25℃水浴中预热20 min,与稀释10倍的发酵上清液1.0 mL和30 mmol/L邻苯三酚溶液0.6 mL混匀后,25℃水浴中保温5 min,加入1 mol/L HCl 0.5 mL终止反应,于420 nm处测定吸光值。以双蒸水为空白对照。每个菌株重复测定3次。

1.3.3 总抗氧化力测定
使用钼酸铵法[12]。稀释10倍的发酵上清液1.0 mL,与 0.6 mol/L H2SO4、28 mmol/L Na3PO4、4 mmol/L钼酸铵溶液各1.0 mL混匀,95℃水浴60 min,冷却至室温,12 000 r/min离心10 min后取上清液,测695 nm处吸光值,吸光值越大则样品抗氧化能力越强。每个菌株重复测定3次。
1.3.4 Fe3+还原能力测定
按参考文献[12]有改动。稀释10倍的发酵上清液1.0 mL,加入pH 6.6的0.2 mol/L磷酸缓冲液2.0 mL、10 mg/mL铁氰化钾2.0 mL,混匀,50℃水浴20 min,加入100 mg/mL三氯乙酸2.0 mL和0.1%(W/V)FeCl3溶液1.0 mL,混匀,测700 nm吸光值,吸光值越高表明还原能力越强。每个菌株重复测定3次。
1.3.5 Fe2+螯合率测定
按参考文献[13]有改动。稀释10倍的发酵上清液 1.0 mL,加入 1 mmol/L FeCl2溶液 2.0 mL,5 mmol/L Ferozine溶液1.0 mL,混匀,室温下反应10 min,测562 nm吸光值。以双蒸水为空白。每个菌株重复测定3次。

1.3.6 脂质过氧化抑制率测定
使用硫代巴比妥酸法,稀释10倍的发酵上清液1.0 mL,加入0.4%(W/V)大豆卵磷脂溶液7.0 mL,加入10 mmol/L FeSO41.0 mL,混匀,37℃保温20 min,加入20%(W/V)三氯乙酸2.0 mL,5 000 r/min离心10 min,取上清液4.0 mL,加入0.8%(W/V)硫代巴比妥酸溶液2.0 mL,混匀,沸水浴15 min,测532 nm吸光值。以双蒸水为空白。每个菌株重复测定3次。

1.3.7 多肽浓度测定
双缩脲法[14]。
1.4 发酵上清液抗氧化稳定性测定
按1.2.1方法制备的菌株发酵上清液,按1.3.3方法测总抗氧化力后,放入磨口玻璃瓶内并加满至瓶口,具塞密封后在50℃恒温静置存放14 d,每隔2 d取样测总抗氧化力。
1.5 数据分析
使用X-Cluster聚类分析软件[15],对各方法所得数据进行聚类分析。
1.6 菌株鉴定
通过革兰氏染色和芽孢染色观察菌体形态,生理生化试验参照文献[16]。16S rDNA序列测定由华大基因技术有限公司完成,扩增用引物为细菌16S rDNA通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-GGTTACCTTGTTACGACTT-3')。测序结果使用balstn比对初步确定种,使用MEGA5.0对齐并做系统发育分析,参数为NJ法、Kimura2、Pairwise deletion。
2 结果和分析
2.1 菌株纯化与初筛
从43份自然发酵豆豉样品中分离纯化产芽孢细菌247株,对其发酵豆粕上清液测定DPPH·清除率,除1株菌株的清除率为-1.8%外,其余246株菌株的清除率在35.4%~96.6%,分段统计见图1。
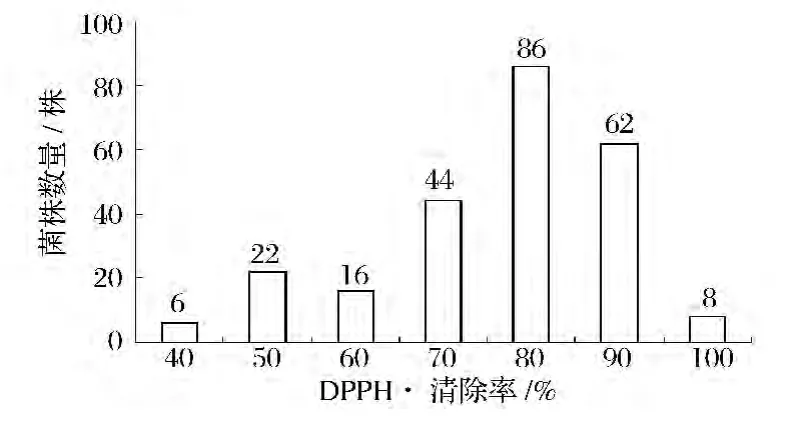
图1 发酵上清液对DPPH·清除率的菌株数量分段计数Fig.1 Thedistribution of DPPH radical scavenging activity for fermented soybean meal supernate
未接种发酵的豆粕培养基上清的清除率为41.2%,与此相比,有97.2%(240株)的菌株发酵豆粕后可提高其对DPPH·的清除率,77.7%(192株)的菌株清除率在60%~90%。按5%的比例挑选清除率最高的 12个菌株,其清除率在 86.2%~96.6%,进行复筛。
2.2 复筛结果分析
12株对DPPH·有高清除率的复筛菌株在另外5种抗氧化性评价方法中表现出不同的抗氧化能力,发酵上清液中多肽质量浓度在1.94~10.46 mg/mL,提示12株菌株在抗氧化能力和有效成分组成上存在差异,抗氧化能力并不完全来自发酵过程中降解豆粕蛋白质产生的多肽。
7种抗氧化性评价方法结果及与多肽浓度间的简单相关系数见表2,仅有总抗氧化力与·OH清除率、·O2-清除率之间具有显著、极显著线性正相关,脂质过氧化抑制率与多肽浓度间有极显著线性负相关[17]。对表2数据使用X-Cluster的UPGMA(线性)算法的聚类分析结果见图2,·OH清除率、·O2-清除率、总抗氧化力、脂质过氧化抑制率因所得结果具有较高相关性而聚为一群,而DPPH·清除率、Fe2+螯合率、Fe3+还原能力3种方法的测试结果聚为一群,多肽浓度与此群在相关性上更高,但无统计意义。各方法和多肽浓度间的线性相关性表明,对于此12株菌株,发酵上清液中多肽浓度并不是决定其抗氧化能力的关键性因素。
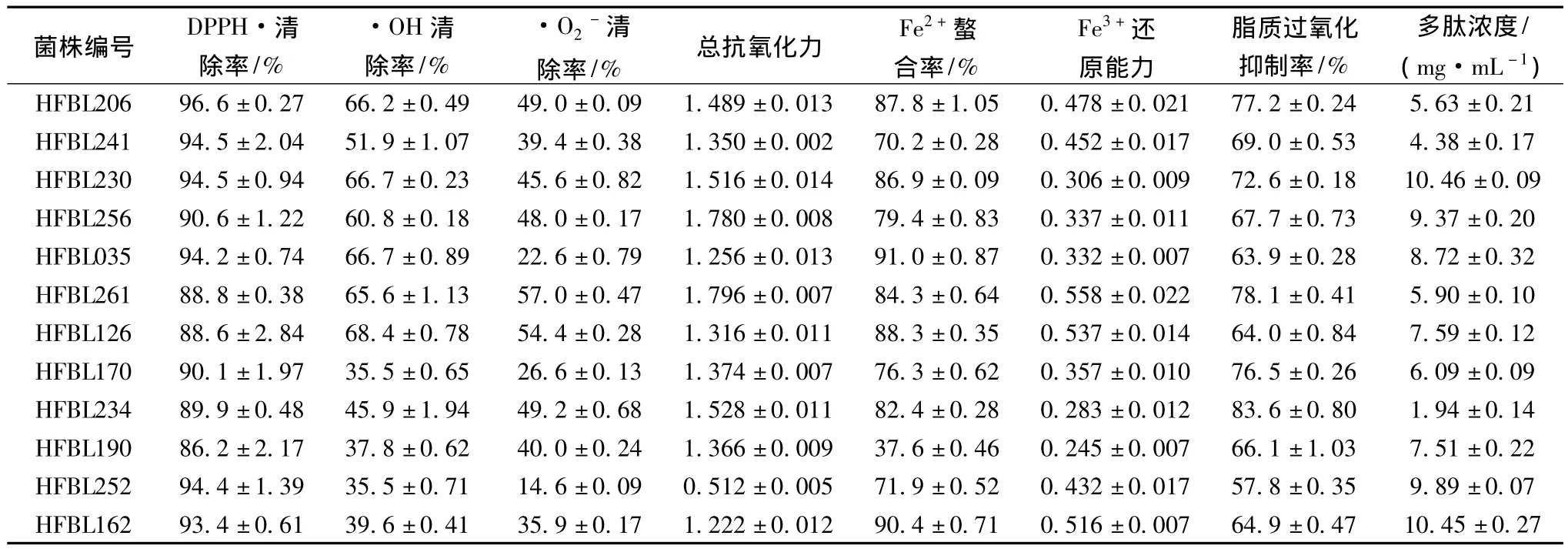
表1 复筛菌株的抗氧化评价方法测量结果Table 1 The results of antioxidant capacity methods used for secondary screening strains
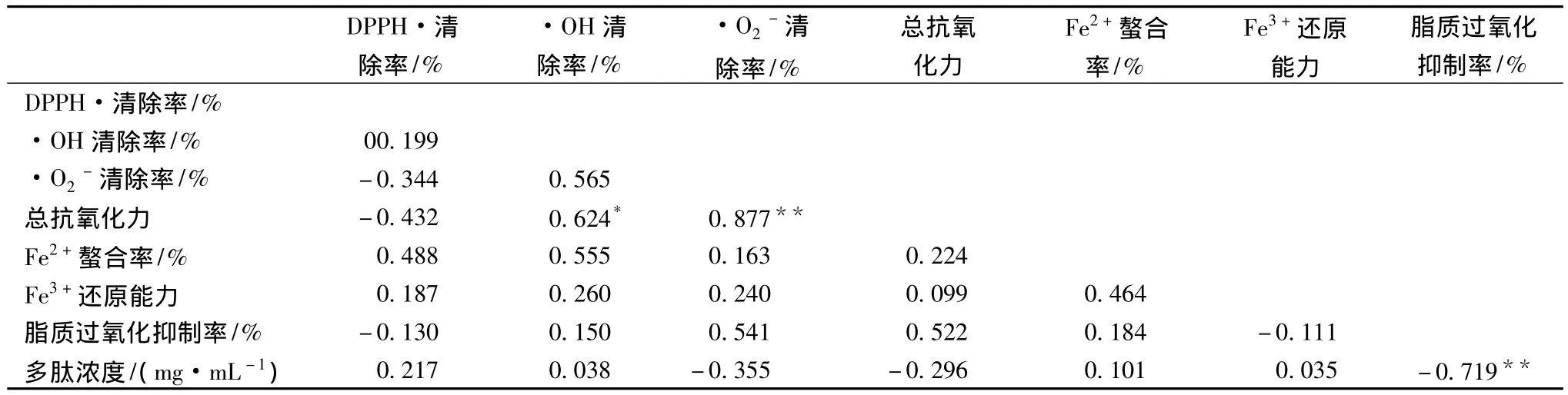
表2 不同抗氧化性测试方法及多肽浓度之间的相关系数Table 2 The coefficient of correlation between different antioxidant capacity methods and peptide concentration
根据表1数据使用X-Cluster对菌株进行聚类分析,算法参数为标准差标准化、夹角余弦系数、UPGMA(线性),结果见图3。在夹角余弦系数为0(表示无任何相关性)水平上分为4个类群。类群1包括HFBL206、HFBL241两个菌株,特点是 DPPH·清除率相对较高,·OH清除率、·O2-清除率、总抗氧化力、多肽浓度中等,类群2包括 HFBL230、HFBL126等4株菌株,分为a、b两个小群,HFBL126所在小群a的·O2-清除率、总抗氧化力、Fe3+还原能力高于HFBL230所在小群b,但DPPH·清除率和多肽浓度低。类群3、类群4与类群1、类群2的主要差别为·OH清除率、·O2-清除率较低。类群3与类群4相比,DPPH·清除率、Fe3+还原能力、多肽浓度较高,而·O2-清除率、总抗氧化力较低。菌株的分群结果提示不同类群的菌株所产生的抗氧化成分在抗氧化机制和种类上具有多样性。
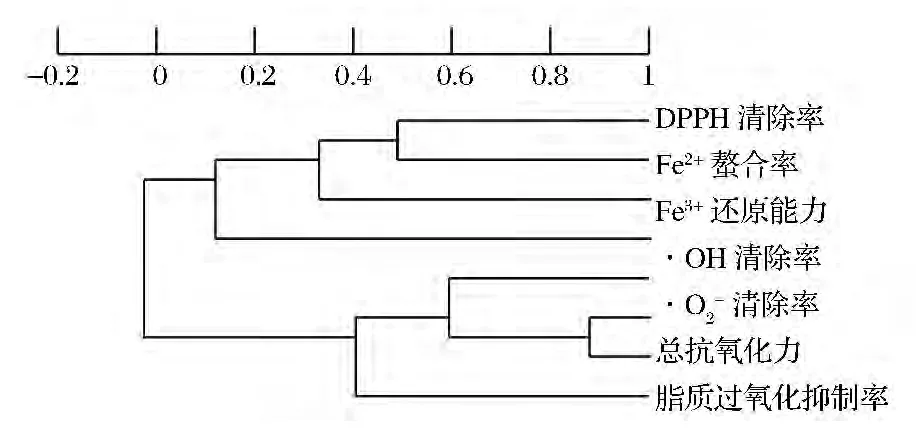
图2 不同抗氧化评价方法所得结果和多肽浓度的聚类分析Fig.2 Cluster analysis for results of different antioxidant capacity methods and peptide concentration
2.3 抗氧化稳定性
12株菌株发酵上清液密封后在50℃环境存放14d内的总抗氧化力均呈下降趋势(表3),活性保存率(%)在69.1%~90.4%,其中HFBL234菌株活性保存率最高,而HFBL261菌株的发酵上清存放14 d后的总抗氧化力数值为1.141,在12株菌株中最高。
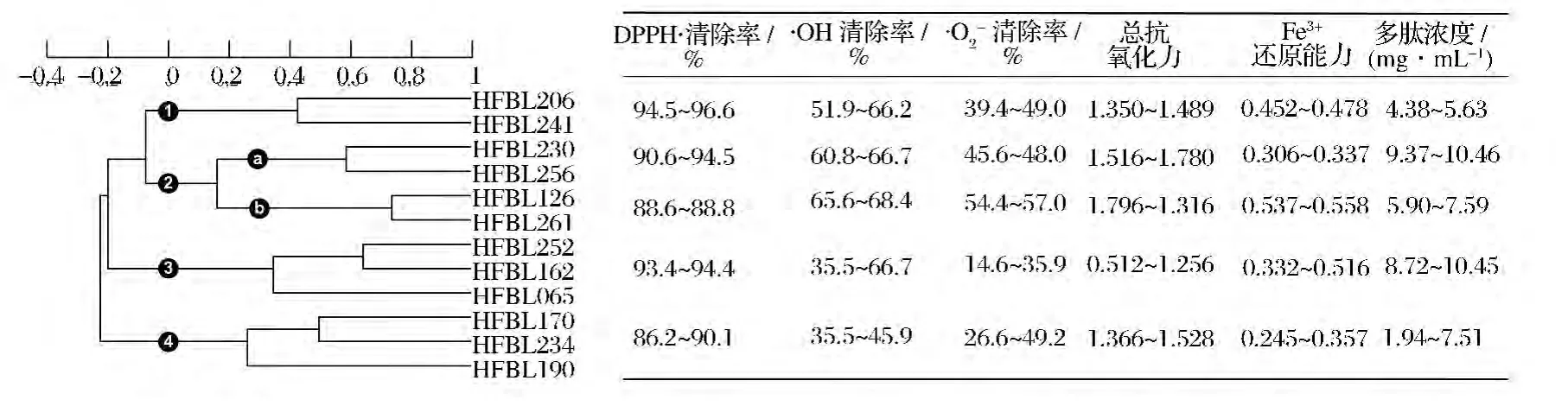
图3 菌株的聚类分析结果和各类群在测试方法上的数值范围Fig.3 The results of cluster analysis for strains and the scales of different antioxidant assay methods
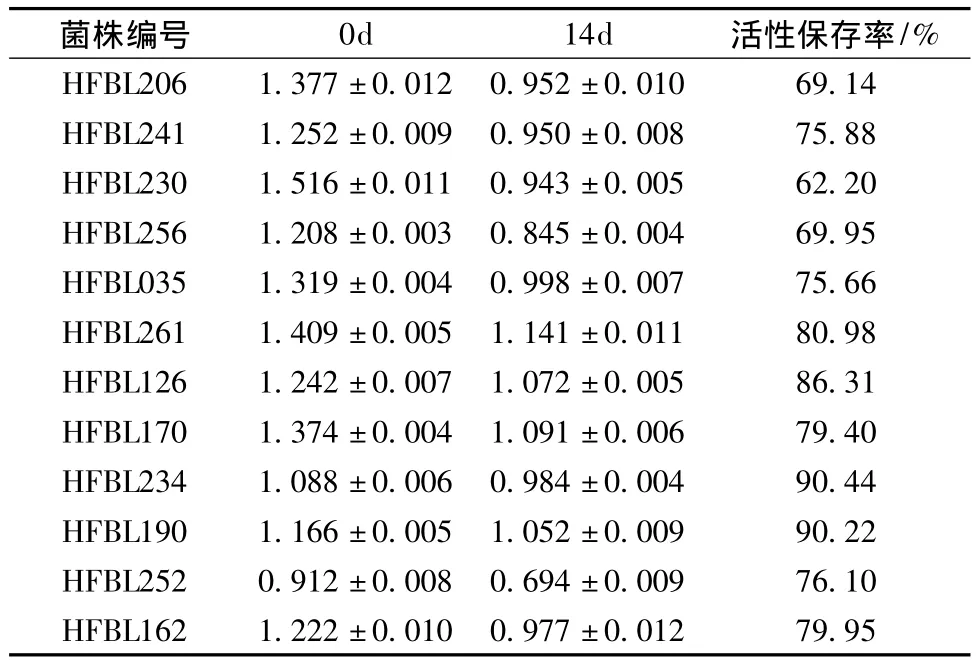
表3 菌株上清液在50℃下存放14 d前后总抗氧化力变化Table 3 The change of total antioxidant capacity for fermented soybean meal supernate stored in 50℃for 14 days
2.4 菌株鉴定
选择50℃存放14d后总抗氧化力残留最高的HFBL261菌株进行鉴定,其表型特性见表4,16S rDNA序列分析结果见图4,与Bacillus subtilis的相似度在99.5%以上。鉴定HFBL261为B.subtilis。
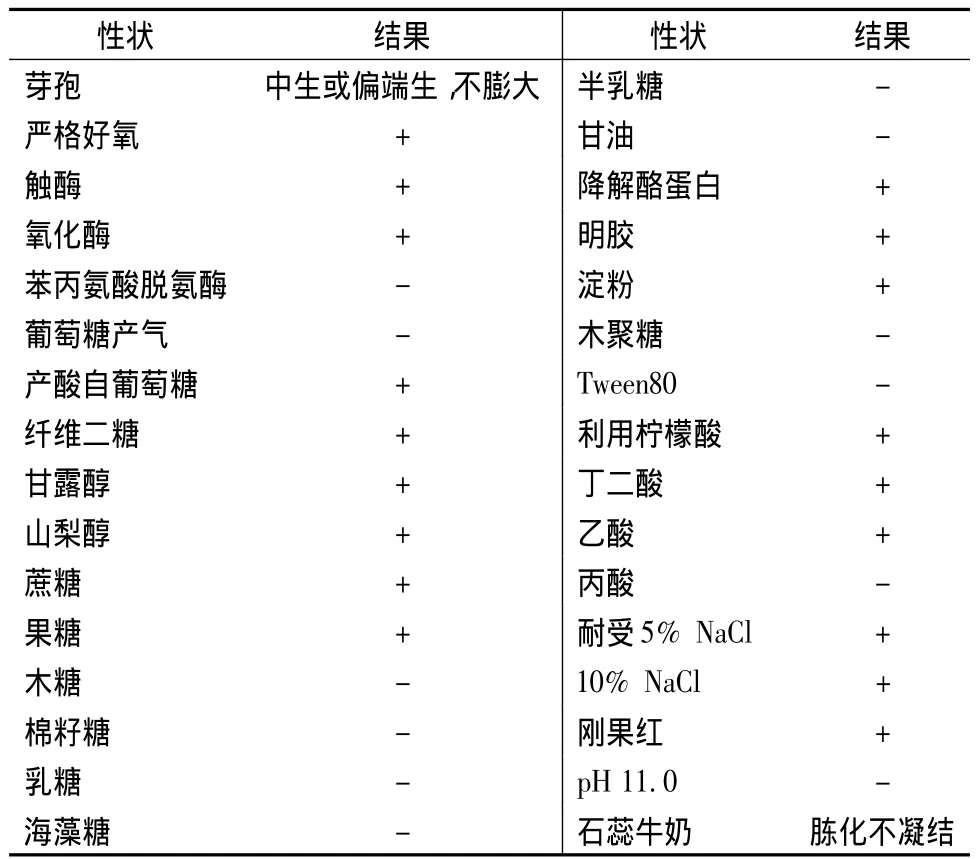
表4 Bacillus sp.HFBL261表型性状Table 4 The phenotypic traits of Bacillus sp.HFBL261
3 讨论
已有多项研究称大豆或豆渣经芽孢杆菌发酵后,其抗氧化能力有显著提高[11,18-19]。本研究中,经初筛发现97%的菌株发酵豆粕后可提高其对DPPH·的清除率,提示以大豆及其加工产品为底物发酵产生抗氧化成分可能是芽孢杆菌的普遍特性。
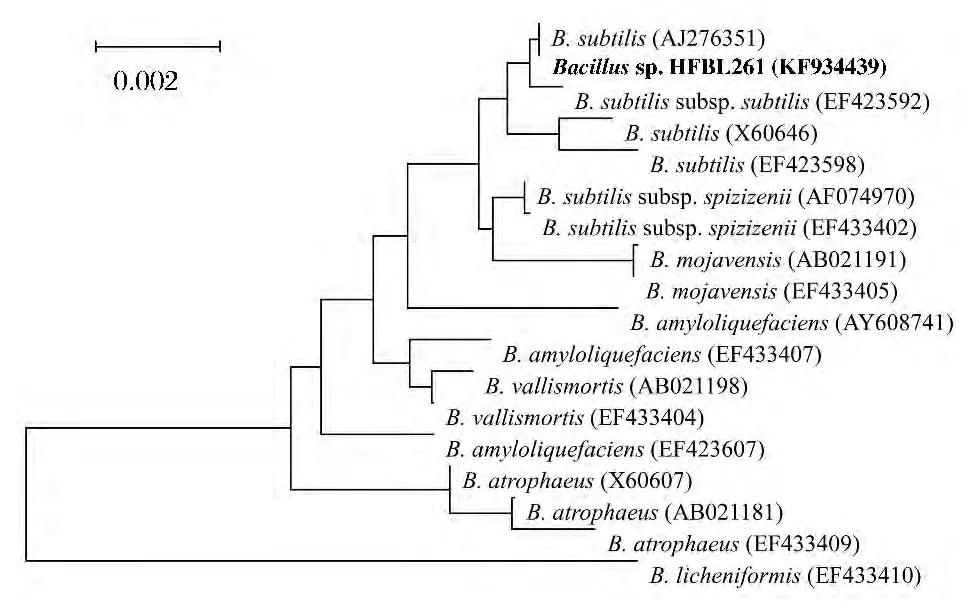
图4 基于16S rDNA序列构建的Bacillus sp.HFBL261与相关菌株的系统发育树Fig.4 Based on the 16S rDNA sequence to build the Bacillus sp.HFBL261 and phylogenetic tree of related strains
目前已报道的抗氧化评价方法众多,但受限于生物体代谢系统的复杂性和成分多样性,并未有公认的、可准确反映一种样品在体内抗氧化能力的标准方法,真实反映其抗氧化能力非常困难[20]。一般认为应同时使用多种不同机制的方法进行检测,以提高结果的客观性。在众多抗氧化能力评价方法中,总氧自由基清除能力(oxygen radical absorbance capacity,ORAC)法与体内抗氧化性有较高相关性[21],但该方法对设备要求高且试剂较贵,不易普及。对ORAC法和其他方法进行的比较研究显示,ORAC法与DPPH法具有较高的相关性[22],因此选择更易操作的DPPH法对菌株进行初筛,复筛采用多种方法进行综合评价。复筛结果表明同一菌株在不同抗氧化评价方法中性能差异明显,如HFBL252菌株,对DPPH·的清除率为94.4%,对·OH、·O2-清除率仅为35.5%、14.6%。其他研究也报道了类似结果,例如YANG等[23]发现不同家族的抗氧化肽对不同类型自由基的清除率存在明显差异。复筛结果中,仅有总抗氧化力与·OH、·O2-清除率之间有显著、极显著线性正相关,脂质过氧化抑制率与多肽浓度间有极显著线性负相关,其他方法所测结果间无显著的线性相关性。一种样品在不同抗氧化评价方法中的差异源于各方法在反应机制和底物选择性等方面的差异,导致不同方法所得结果缺乏可比性,需要使用多种评价方法来尽可能客观地评价一种样品的抗氧化能力。
芽孢杆菌是一个蛋白酶活力较高的类群,以富含蛋白质的大豆、豆粕等为底物,发酵产物中富含多种功能性肽,因此多肽浓度与功能性间可能存在相关性。陈洁梅等[24]使用 Bacillus sp.JM3固态发酵豆粕,认为多肽浓度与总抗氧化活性间有良好相关性(r2=0.8604)。但在本研究中,多肽浓度与任何一种抗氧化评价方法结果均无显著正相关。如HFBL234菌株,发酵上清液中多肽浓度仅为1.94 mg/mL,但对DPPH·、·OH、·O2-的清除率为89.9%、45.9%、49.2%,脂质过氧化抑制率为83.6%。该现象与芽孢杆菌类群的代谢多样性有关。芽孢杆菌是一个代谢多样性较高的类群,除抗氧化肽外,还可产生异黄酮类、维生素E、糖蛋白、胞外多糖、硫醇类化合物、多酚等多种抗氧化成分。多肽浓度与抗氧化性的低相关性也与自抗氧化肽在总肽中的比例有关。并非所有的多肽都具有抗氧化性,只有具有特定氨基酸序列的多肽才具有抗氧化性,例如CHEN等[25]纯化所得抗氧化肽在N端富含Val、Leu、Ile、Pro等特定氨基酸残基。抗氧化肽在总肽中的比例会影响多肽(总肽)浓度与抗氧化性之间的相关性。
对筛选的12株菌株的聚类分析将其在0~0.2水平上分为4~5个类群,不同类群在多肽浓度和不同的抗氧化性评价方法上表现各异,提示其发酵豆粕产生的抗氧化成分在作用机制和类型上的多样性,认为一些菌株产生非多肽类抗氧化成分的可能性很大,对其中活性成分的分离鉴定将是今后的研究方向。
参考文献
[1] 黎观红,晏向华.食物蛋白源生物活性肽-基础与应用[M].北京:化学工业出版社,2010:134-144.
[2] 刘海燕,邱玉郎,魏炳栋,等.微生物发酵豆粕研究进展[J].动物营养学报,2012,24(1):35-40.
[3] Gibbs B F,Zougman A,Masse R,et al.Production and characterization of bioactive peptides from soy hydrolysate and soy-fermented food[J].Food Research International,2004,37(2):123-131.
[4] KUO LC,CHENG WY,WU RY,et al.Hydrolysis of black soybean isoflavone glycosides by Bacillus subtilis natto[J].Applied Biochemistry and Biotechnology,2006,73(2):314-320.
[5] Rebeca F O,Juana F,Rosario M,et al.Fermentation as a bio-process to obtain functional soybean flours[J].Journal of Agricultural and Food Chemistry,2007,55(22):8 972-8 979.
[6] 袁建锋,蔡恒,单咸旸,等.一株芽孢杆菌胞外多糖的分离纯化及其抗氧化性测定[J].微生物学通报,2009,36(10):1 466-1 470.
[7] Kodali V P,Perali R S,Sen R.Purification and partial elucidation of the structure of an antioxidant carbohydrate biopolymer from the probiotic bacterium Bacillus coagulans RK-02[J].Journal of Natural Products,2011,74(8):1 692-1 697.
[8] Newton G L,Rawat M,Clair J J L,et al.Bacillithiol is an antioxidant thiol produced in Bacilli[J].Nature Chemical Biology,2009,5(9):625-627.
[9] WEN Y,WU X,TENG Y,et al.Identification and analysis of the gene cluster involved in biosynthesis of paenibactin,a catecholate siderophore produced by Paenibacillus elgii B69[J].Environmental Microbiology,2011,13(10):2 726-2 737.
[10] 秦礼康,曾海英,丁霄霖.陈窖豆豉粑传统工艺剖析及优势菌群鉴定[J].食品科学,2006,27(6):118-123.
[11] ZHU YP,FAN JF,CHENG YQ,et al.Improvement of the antioxidant activity of Chinese traditional fermented okara(Meitauza)using Bacillus subtilis B2[J].Food Control,2008,19(7):654-661.
[12] 周方,赵宏飞,杨洋,等.高丛蓝莓品种花青素含量与抗氧化能力比较[J].西南林业大学学报,2011,31(5):53-57.
[13] 许淑真,黃易楷,钟冠麟,等.植物来源乳酸菌应用于抗敏化妆品之先期评估[J].远东学报,2013,29(2):153-161.
[14] 蔡武成,袁厚积.生物物质常用化学分析法[M].北京:科学出版社,1982:95-96.
[15] 黄继翔,惠明,齐东梅等.新型数值分类软件X-Cluster的开发及应用[J].微生物学通报,2006,33(1):118-121.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-398.
[17] 袁志发,周静芋.试验设计与分析[M].北京:高等教育出版社,2000:171-175.
[18] YANG XJ,CHEN J,ZHANG CX,et al.Evaluation of antioxidant activity of fermented soybean meal extracts[J].African Journal of Pharmacy and Pharmacology,2012,6(24):1 774-1 781.
[19] Moktan B,Saha J,Sarkar P K.Antioxidant activities of soybean as affected by Bacillus-fermentation to kinema[J].Food Research International,2008,41(6):586-593.
[20] Ishige K,Sehubert D,Sagara Y.Flavonoids protect neuronal cells from oxidant stress by three distinct mechanisms[J].Free Radieal Biology and Medieine,2001,30(4):433-446.
[21] Prior R L,Wu X,Schaich K.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agriculuural and Food Chemistry,2005,53(10):4 290-4 302.
[22] Ichiho M,Minako Y,Hiroshi S,et al.Development and validation of a microplate-based β-carotene bleaching assay and comparison of antioxidant activity(AOA)in several crops measured by β-carotene bleaching,DPPH and ORAC assays[J].Food Science and Technology Research,2009,15(2):171-178.
[23] YANG HL,WANG X,LIU XH,et al.Antioxidant peptidomics reveals novel skin antioxidant system[J].Molecular& Cellular Proteomics,2009,8(3):571-583.
[24] 陈洁梅,徐聪聪,常磊,等.响应面分析法优化豆粕固态发酵工艺生产大豆抗氧化肽的研究[J].中国生物工程杂志,2012,32(12):59-65.
[25] CHEN HM,Muramoto K,Yamauchi F.Structural analys is of antioxidative peptides from soybean β-conglycinin[J].Journal of Agricultural and Food Chemistry,1995,43(3):575-578.
