弱化乙醇途径关键酶活性减少酿酒酵母在丙酮酸发酵过程中副产物乙醇的积累*
2015-12-16吴满珍李鹏越苏珂徐国强蒋伶活
吴满珍,李鹏越,苏珂,徐国强,蒋伶活
1(江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡,214122)
2(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
3(江南大学生物工程学院,江苏无锡,214122)
作为TCA循环的中间产物,苹果酸、延胡索酸和琥珀酸等C4二元羧酸广泛应用于食品、医药和化工等产业。鉴于C4二元羧酸重要的应用价值及潜在的应用前景,2004年,美国能源部专门成立了C4二元羧酸研究组研究这些有机酸的生产工艺和应用[1]。微生物发酵法生产C4二元羧酸因具有原料可再生、生产工艺对环境污染小等优势而备受关注[2-5]。酿酒酵母具有:(1)营养需求简单,下游分离工艺成本低廉;(2)能耐受较低pH条件及高浓度底物产生的渗透压;(3)长期用于食品和酿造等领域,并通过FDA认证,发酵产品具有安全性;(4)遗传信息丰富,代谢改造操作简便[6]。因此,这种微生物被认为是生产C4二元羧酸的潜在最适微生物。
在高糖浓度及有氧条件下,酿酒酵母会产生大量的乙醇,这种现象被称为反巴斯德效应(也称为克勒勃屈利效应)[7]。然而,对于以C4二元羧酸目标产物来说,乙醇的大量产生会导致碳代谢流和辅助因子的损失。因此,如何减少乙醇或消除乙醇的产生,成为酿酒酵母生产C4二元羧酸等羧酸所面临的共同难题[8]。酿酒酵母乙醇合成途径主要涉及到丙酮酸脱羧酶(pyruvate decarboxylase,Pdc)和乙醇脱氢酶(alcohol dehydrogenase,Adh),Pdc 主要有 PDC1,PDC5,PDC6 三个基因编码,Adh由 ADH1,ADH2,ADH3,ADH4,ADH5,ADH6 等基因编码,其中,ADH1编码的产物的作用是将乙醛转化为乙醇[9]。围绕上述两个关键酶及其辅因子,减少或消除乙醇形成的主要策略及进展如下:(1)缺失丙酮酸脱羧酶,通过同时敲除PDC1,PDC5,PDC6三个基因,完全阻止了乙醇的产生,但菌株不能以葡萄糖为唯一碳源进行分批发酵[10-11];(2)缺失乙醇脱氢酶,通过同时敲除ADH1,ADH2,ADH3,ADH4,ADH5,ADH6 同样可以完全阻止乙醇的产生,但这种策略会引起甘油和乙醛的积累,从而导致菌体生长较弱[12-13];(3)调控辅因子水平,硫胺酸是Pdc的辅因子,而THI2和THI3是硫胺素合成途径的调控基因,敲除THI2或THI3均降低了Pdc的酶活,进而减少了乙醇的生成[14],但硫胺酸也是α-酮戊二酸脱氢酶的辅因子,因此,敲除THI2或THI3不利于通过氧化TCA途径积累C4二元羧酸。此外,Tokuhiro等用来源于牛的乳酸脱氢酶基因L-ldh分别替换PDC1和ADH1两个基因,既实现了同时弱化Pdc和Adh的活性,又实现了外源乳酸脱氢酶在酿酒酵母中的表达,获得的工程菌株乙醇产量大幅下降,乳酸产量大幅上升[15]。而通过单纯敲除PDC1和ADH1两个基因来同时弱化Pdc和Adh的活性,进而减少乙醇形成未见报道。
鉴于此,本研究尝试通过敲除PDC1和ADH1两个基因来同时弱化Pdc和Adh的活性,实现减少乙醇形成的目的。在此基础上,通过发酵优化提高双基因缺失突变株的生长特性,以期实现减少乙醇的形成。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
酿酒酵母菌株Saccharomyces cerevisiae CEN.PK2-1C、敲除模板质粒pUG27、标记回收质粒pSH47及PCR引物相关信息见表1。

表1 本研究所用的菌株、质粒、引物Table 1 Lists of S.cerevisiae strains,plasmids and primers used in this study
1.1.2 培养基
YPD培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20(固体培养基加入琼脂粉20),pH自然,121℃灭菌20 min。
SD-HIS培养基(g/L):酵母氮源 1.7,(NH4)2SO45,葡萄糖 20,氨基酸 mix 5.9,亮氨酸0.1,尿嘧啶0.02(固体培养基加入琼脂粉20),pH自然,121℃灭菌 20 min。
SD-URA培养基(g/L):酵母氮源 1.7,(NH4)2SO45,葡萄糖 20,氨基酸 mix 5.9,亮氨酸0.1,组氨酸0.02(固体培养基加入琼脂粉20),pH自然,121℃灭菌 20 min。
种子培养基(g/L):葡萄糖 40,YNB 3.4,(NH4)2SO45,氨基酸 mix 5.9,亮氨酸 0.1,组氨酸0.02,尿嘧啶0.02。装液量20 mL/100 mL。115℃灭菌20 min。
发酵培养基(g/L):葡萄糖 40,YNB 3.4,(NH4)2SO45,氨基酸 mix 5.9,亮氨酸 0.1,组氨酸0.02,尿嘧啶0.02。添加CaCO35 g/L,装液量为40 mL/250 mL。CaCO3单独灭菌后加入。
1.2 实验方法
1.2.1 培养方法[16]
从-80℃菌种保藏管取菌在YPD(含营养标记质粒的转化子在对应的SD缺陷培养基)平板上进行划线活化,30℃培养箱培养48 h;挑取活化的单菌落接种到种子培养基中,30℃、220 r/min摇床培养24 h至饱和;测定每个菌株的OD600值,以起始OD=0.2转接入发酵培养基中,30℃、220 r/min摇床培养发酵96 h。
1.2.2 分析方法
1.2.2.1 生物量测定
取不同时间点的发酵液 0.1 mL,用 0.4 mol/L的盐酸除掉发酵液中的碳酸钙,并稀释适当的倍数,振荡混匀。待溶液澄清后,以稀盐酸为空白,在600 nm波长处测定吸光值,以测得的OD值作为菌体生物量计量单位。
1.2.2.2 代谢物分析
HPLC检测代谢物:HPLC仪器为Waters 1515,葡萄糖、乙醇用RID检测器,丙酮酸用紫外检测器。色谱柱为Aminex HPX-87H,流动相为0.0275%(v/v)H2SO4,流速 0.6 mL/min。
1.2.3 酶活测定
粗酶提取:4℃,8 000 r/min离心1 min收集菌体,去上清液;用预冷双蒸水重悬菌体,并于离心后去掉上清液;加入与菌体等量并预冷的蛋白提取缓冲液PEB,PEB中再加入100×PMSF;加入与菌体体积差不多量的玻璃珠;在振荡混合器上振荡EP管10次,每次30 s,每次振荡后放冰上1 min;12 000 r/min离心10 min,取上清即蛋白液放于冰上保存。
丙酮酸脱羧酶:向比色皿中依次加入40 mmol/L咪唑盐酸0.4 mL、1.5 mmol/L NADH 0.1 mL、880 U/mL乙醇脱氢酶0.1 mL、50 mmol/L MgCl20.1 mL、500 mmol/L丙酮酸钾0.1 mL、细胞破碎上清液0.1 mL(对照加0.1 mL的咪唑盐酸),测定340 nm处吸光度变化。反应起始于丙酮酸钾的加入,在30℃,pH 8.0条件下,每分钟能够催化1 μg分子的辅酶 I的酶量为1个酶活单位。乙醇脱氢酶:吸取0.06 mol/L焦磷酸钠溶液0.5 mL、3 mol/L乙醇溶液0.1 mL、0.005 mol/L NAD 溶液 0.1 mL、蒸馏水 2.2 mL置于石英比色杯中(容量4 mL),加入已稀释的样液或酶制剂1 mL,立即混匀,测定A340,以后每隔15 s测1次,直至A340不变,记下反应时间和A340读数。于另一石英比色杯中,以蒸馏水代替底物,作空白试验。每分钟A340增加0.001为1个活力单位。
1.2.4 基因敲除[16]
以质粒pUG27为模板,利用引物F和R(表1)进行 PCR扩增,PCR条件为95℃ 5 min;9℃ 30 s;55℃ 30 s,72℃ 1.5 min,30 个循环;72℃ 延伸 10 min。获得的 PCR产物即为敲除盒,它含有His标记,loxP位点和PDC1(ADH1)基因同源的序列。然后利用LiAc转化法将敲除盒直接转化到S.cerevisiae CEN.PK2-1C,涂布在SD-His平板上,培养3~5 d。长出的单菌落划线纯化后接入SD-His液体培养基,培养后提取基因组,PCR验证确定为阳性菌落。将用以消除标记的Cre表达质粒pSH47转化到酵母阳性转化子中,切除标记后,并将 pSH47移除,最终获得阳性转化子。
2 结果与讨论
2.1 PDC1和ADH1双基因缺失对菌体生长及耗糖的影响
考察了PDC1单独缺失及PDC1和ADH1双基因缺失对酿酒酵母细胞生长及耗糖的影响,结果如图1所示。PDC1单独缺失对菌体生长影响很小,但减弱了葡萄糖的消耗能力;PDC1和ADH1双基因缺失后,发酵进行到36 h时,酵母细胞的生物量为2.64±0.16 OD600,较野生型菌株下降了75.3%。此时,双基因缺失突变株葡萄糖消耗了22.9±1.9 g/L,对照菌消耗了62.5±0.6 g/L。说明PDC1和ADH1缺失后,在现有的发酵条件下,菌体生长和耗糖较弱。
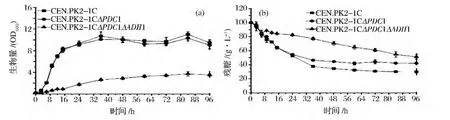
图1 野生型菌株与基因缺失株菌株生物量及葡萄糖消耗Fig.1 Growth(a)and glucose consumption(b)of the wild type,the pdc1 mutant and the pdc1adh1 mutant(Fermentation medium contains 100 g/L glucose)
2.2 PDC1和ADH1基因缺失对Pdc和Adh酶活的影响
考察了PDC1和ADH1基因缺失对Pdc和Adh酶活的影响,研究结果如图2所示。在野生型菌株中,从24 h到48 h,Pdc酶活逐步增加,但是到第60 h又减少,48 h为最大值达到0.28 U/mg。而pdc1缺失株中,Pdc酶活从24 h至60 h都是逐步减少的,相同时间点酶活与野生型菌株相比显著减少,48 h时的Pdc酶活仅有0.12 U/mg,与野生型菌株相比,减少了57.1%。同样,无论在野生型菌株还是缺失株中,Adh酶活都是先增加后减少,在48 h达到最大值,其中野生型菌株Adh酶活达0.58 U/mg,缺失株为0.36 U/mg,而在相同时间点缺失株较野生型菌株相比 Adh酶活都减少,48 h、60 h相差显著,说明ADH1基因缺失导致酶活降低,其中在48 h显著降低40%。
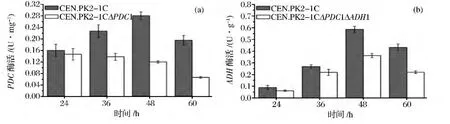
图2 丙酮酸脱羧酶以及乙醇脱氢酶酶活Fig.2 The specific activities of Pdc and Adh in the pdc1 mutant(a)and the pdc1adh1 mutant(b)
由图1和图2可知,PDC1单独缺失对菌体Pdc酶活及菌的生长情况与文献报道的结果基本一致[17]。PDC1和 ADH1基因的缺失,导致了 Pdc和Adh酶活的下降,进而影响了菌体生长和葡萄糖的消耗。NADH主要由胞质里的糖酵解途径等产生,在好氧条件下,酿酒酵母对葡萄糖的吸收速率超过一定的阈值时,NADH产生的速率就会超过其被氧化的速率,导致酿酒酵母通过溢流代谢合成乙醇[7]。Adh1p作用是将乙醛转化为乙醇,同时将 NADH转化为NAD+,因此,ADH1的敲除,会影响到葡萄糖的代谢,进而影响到菌体的生长。
2.3 发酵优化提高菌体生物量
敲除基因PDC1和ADH1后,菌株生长较弱。为了提高菌体生物量,考察了葡萄糖浓度、C/N以及溶氧对双基因缺失菌株生长的影响。重点比较了24 h和48 h的生长情况,结果如图3所示。与高糖浓度相比,40 g/L葡萄糖对生长最有利,在48 h菌体生物量(OD600)达到 3.8,较 100 g/L葡萄糖提高了107.7%。当葡萄糖含量为40 g/L时,考察了不同氮源浓度及C/N对菌体生长的影响。研究发现,氮源为3.4 g/L YNB和5 g/L(NH4)2SO4对生长最有利,48 h时,菌体生物量(OD600)达到6.5,较对照提高了70.3%。此外,溶氧水平也能显著地影响缺失株的生长,此实验通过装液量来实现。考察了40 mL、80 mL、100 mL的装液量对菌株的影响,研究发现,装液量为40 mL时,双基因缺失株的菌体生物量(OD600)达到了9.1,与对照(100 mL)相比,提高了49.2%。综上,本研究通过优化葡萄糖浓度、氮源浓度及C/N、溶氧水平,实现了菌体生物量(OD600)从最开始的1.8±0.15达到优化后的9.1±0.45,提高了4倍,接近于野生型菌株的最大菌体生物量。
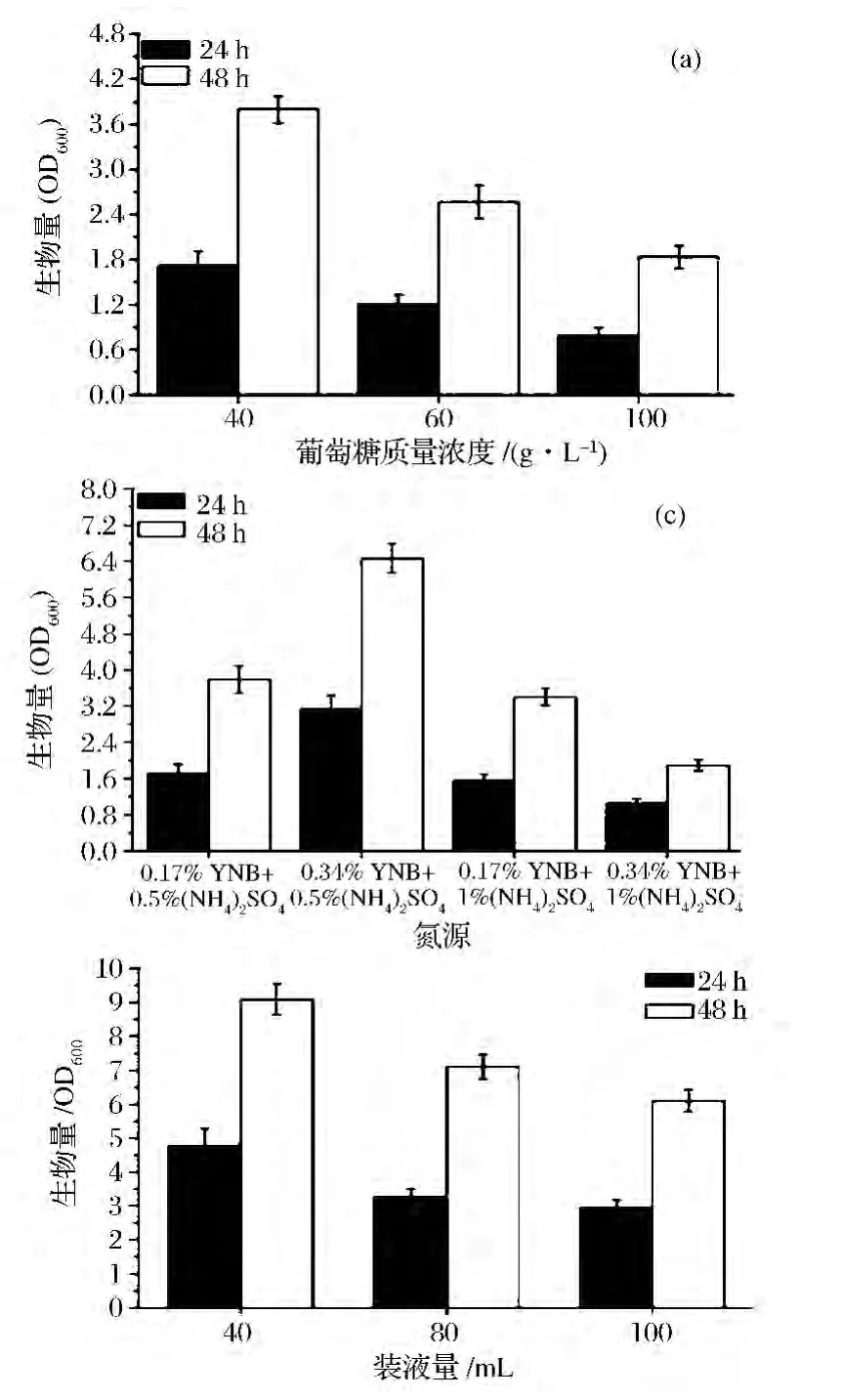
图3 pdc1adh1菌株生物量优化Fig.3 Growth optimization of the pdc1adh1 mutant
在本研究中,通过研究葡萄糖浓度、氮源浓度及C/N及溶氧水平对菌体生长的影响。实际上,PDC1和ADH1的缺失影响了葡萄糖的代谢,进而影响到菌体的生长。提高通风水平,可以明显促进菌体生长,这个现象与Tokuhiro的研究结果(提高搅拌转速,可以提高葡萄糖的消耗速率及菌体生物量)是一致的[15]。这是因为氧是电子受体,提高氧的供应,可以促进NAD+的再生,进而促进葡萄糖的代谢。
2.4 发酵特性研究
在上述最佳培养基及培养条件下,考察了野生型菌株和双基因缺失菌株的发酵特性。如图4所示,双基因缺失菌株的菌体生长弱于野生型菌株,但发酵进行到48 h后,最大生物量接近于野生型菌株;双基因缺失菌株的葡萄糖的消耗速率也低于野生型菌株,发酵进行到48 h时,葡萄糖消耗完;野生型菌株乙醇产量在36 h时达到最大值,为5.8 g/L,而双基因缺失菌株的乙醇产量在48 h达到最大值,为2.1 g/L,较野生型菌株下降了63.8%;野生型菌株几乎不积累丙酮酸,而双基因缺失菌株的丙酮酸产量在48 h达到最大值,为2.0 g/L。由此可见,在优化后的发酵条件下,双基因缺失菌株的菌体生长和葡萄糖消耗情况与野生型菌株接近。同时,通往乙醇的碳流大大减少,部分碳流以丙酮酸的形式积累,为目标产物C4二元羧酸的生产提供了前体物。
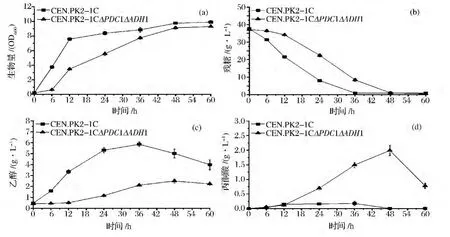
图4 CEN.PK2-1C以及pdc1adh1缺失株发酵特性Fig.4 Fermentation profiles of the wild type and the pdc1adh1 mutant during batch culture under optimal growth conditions
3 结论
同时敲除基因PDC1和ADH1,可以弱化乙醇合成途径中两个关键酶Pdc和Adh两个关键酶的活性,但导致菌体生长较弱;通过培养基优化及培养条件优化,确定了最优的培养基组成为:葡萄糖40 g/L,YNB 3.4 g/L,(NH4)2SO45 g/L。最佳装液量为40 mL/250 mL。在此发酵条件下,菌体最大生物量与对照菌株接近,发酵48 h时,最大乙醇产量为2.1 g/L,较野生型菌株最大乙醇产量下降了63.8%,丙酮酸产量为 2.0 g/L。因此,通过敲除基因 PDC1和ADH1,可以同时弱化Pdc和Adh两个关键酶的活性,进而有效减少乙醇的形成,促进丙酮酸的积累,为研究减少副产物乙醇形成,促进C4二元羧酸形成提供了一个可供选择的策略。
[1] Zelle R M,de Hulster E,van Winden W A,et al.Malic acid production by Saccharomyces cerevisiae:Engineering of pyruvate carboxylation,oxaloacetate reduction,and malate export[J].Appl Environ Microb,2008,74(9):2 766-2 777.
[2] Zelle R M,de Hulster E,Kloezen W,et al.Key process conditions for production of C(4)dicarboxylic acids in bioreactor batch cultures of an engineered Saccharomyces cerevisiae strain[J].Appl Environ Microbiol,2010,76(3):744-750.
[3] CHEN X,WU J,SONG W,et al.Fumaric acid production by Torulopsis glabrata:Engineering the urea cycle and the purine nucleotide cycle[J].Biotechnol Bioeng,2015,112(1):156-167.
[4] Raab A M,Gebhardt G,Bolotina N,et al.Metabolic engineering of Saccharomyces cerevisiae for the biotechnological production of succinic acid[J].Metab Eng,2010,12(6):518-525.
[5] XU G Q,LIU L M,CHENG J.Reconstruction of cytosolic fumaric acid biosynthetic pathways in Saccharomyces cerevisiae[J].Microb Cell Fact,2012,11:24.
[6] Nevoigt E.Progress in metabolic engineering of Saccharomyces cerevisiae[J].Microbiol Mol Biol Rev,2008,72(3):379-412.
[7] Vemuri G N,Eiteman M A,McEwen J E,et al.Increasing NADH oxidation reduces overflow metabolism in Saccharomyces cerevisiae[J].Proc Natl Acad Sci U S A,2007,104(7):2 402-2 407.
[8] Abbott D A,Zelle R M,Pronk J T,et al.Metabolic engineering of Saccharomyces cerevisiae for production of carboxylic acids:current status and challenges[J].FEMS Yeast Res,2009,9(8):1 123-1 136.
[9] Leskovac V,Trivic S,Pericin D.The three zinc-containing alcohol dehydrogenases from baker's yeast,Saccharomyces cerevisiae[J].FEMS Yeast Res,2002,2(4):481-494.
[10] Flikweert M T,van Dijken J P,Pronk J T.Metabolic responses of pyruvate decarboxylase-negative Saccharomyces cerevisiae to glucose excess[J].Appl Environ Microbiol,1997,63(9):3 399-3 404.
[11] van Maris A J,Geertman J M,Vermeulen A,et al.Directed evolution of pyruvate decarboxylase-negative Saccharomyces cerevisiae,yielding a C2-independent,glucose-tolerant,and pyruvate-hyperproducing yeast[J].Appl Environ Microbiol,2004,70(1):159-166.
[12] Drewke C,Thielen J,Ciriacy M.Ethanol formation in adh0 mutants reveals the existence of a novel acetaldehyde-reducing activity in Saccharomyces cerevisiae[J].J Bacteriol,1990,172(7):3 909-3 917.
[13] Skory C D.Lactic acid production by Saccharomyces cerevisiae expressing a Rhizopus oryzae lactate dehydrogenase gene[J].J Ind Microbiol Biotechnol,2003,30(1):22-27.
[14] XU G,HUA Q,DUAN N,et al.Regulation of thiamine synthesis in Saccharomyces cerevisiae for improved pyruvate production[J].Yeast,2012,29(6):209-217.
[15] Tokuhiro K,Ishida N,Nagamori E,et al.Double mutation of the PDC1 and ADH1 genes improves lactate production in the yeast Saccharomyces cerevisiae expressing the bovine lactate dehydrogenase gene[J].Appl Microbiol Biot,2009,82(5):883-890.
[16] 徐国强,陈修来,吴满珍.调控辅因子水平减少酿酒酵母积累副产物乙醇[J].食品与发酵工业,2014,40(10):6-10.
[17] Flikweert M T,Van Der Zanden L,Janssen W M,et al.Pyruvate decarboxylase:an indispensable enzyme for growth of Saccharomyces cerevisiae on glucose[J].Yeast,1996,12(3):247-257.
