保健品合成过程中甘油和甲醇的在线监测*
2015-12-25毛晓婷金尚忠周鹏威李敏超唐海涛
毛晓婷,金尚忠,周鹏威,李敏超,唐海涛
1(中国计量学院光学与电子科技学院,浙江杭州,310018)2(华东理工大学生物工程学院,上海,200237)
3(北京美拓琪科技有限公司,北京,100088)
红外光谱检测方法是一种常用的化学分析方法,无论是对于已知物质化学结构的分析,还是对未知物的鉴定,红外分析方法都显示出其独有的优势[1]。同时,随着近年来红外技术及仪器的发展,傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)以其高精度、高分辨率等优势逐渐替代光栅型的红外光谱仪。相比于近红外光谱检测方法,红外光谱不仅检测速度快,而且吸收峰与成分含量关系直接、数据分析和建模简单[2],检测灵敏度和精度高,更适合于保健品、药品等复杂成分合成的在线检测[3]。配以衰减全内反射(Attenuated Total Reflectance,ATR)探头,使得对于一些先前难以测试的物质(如红外吸收过强的物质、粉末、糊状样品、纤维、微量液体等)的检测成为可能[1]。
本文提出了一种保健品合成过程中,甲醇和甘油在线红外监测方案。应用FTIR光谱检测技术结合多元数据分析方法,对所得的光谱数据进行建模,并将其应用到实际生产中。实验数据显示了反应过程中甲醇和甘油物质含量及变化趋势,结果与实际生产过程中基本相符,甘油和甲醇从其加入反应釜到完全耗尽分别用时约40 h和6 h,为工业上生物反应过程中反应物的过程检测提供一种可行方法。
1 ATR红外光谱分析原理
当样品受到频率连续变化的红外光照射时,分子吸收某些频率的辐射,并由其振动运动或转动运动引起偶极矩的变化,对于不同的分子结构,所产生的化学键的伸缩振动不同,从而出现明显的吸收峰,因此根据甲醇和甘油特有的红外吸收峰对其检测。
中红外光谱区吸收峰与成分含量关系直接。根据朗伯比尔(Lambert-Beer)定律[1],当一束光通过样品时,任意波长光的吸收强度(吸光度)与样品中各组分的浓度成正比,与光程长(样品厚度)成正比。对于非吸收性溶剂中单一溶质的红外吸收光谱,在任一波数(υ,单位cm-1)处的吸光度为:
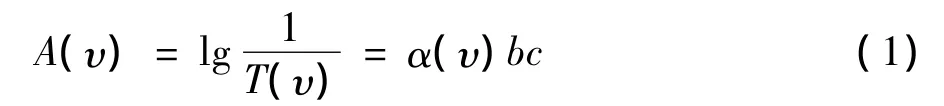
式中:A(υ)和T(υ)为波数υ处的红外吸光度和透射率;α(υ)为υ处的吸收系数;b为光程(样品厚度,cm);c为样品浓度(对液体物质,mol/L)[1]。
对N个组分的混合样品,在波数υ处的总吸光度为:
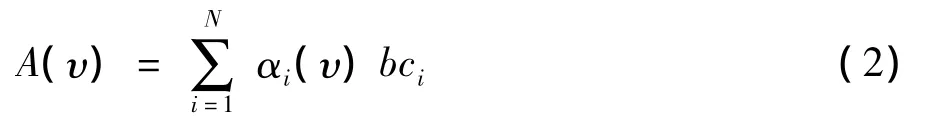
实验过程中只要测得多个波数位置的红外吸光度,通过已建立的红外模型就能反演获得相应的参数测量。从式(1)中可见,物质在各波数处的吸光度值不同,因此测试波段的选择决定实验结果的准确度。
2 实验方法
2.1 实验材料
一定量的毕赤酵母菌培养液、适量的毕赤酵母菌种,甘油和甲醇分别为1 000 g和250 g。在适合该酵母菌生长的环境(由华东理工大学提供)下培养。
2.2 实验装置
2.2.1 ATR附件工作原理
衰减全内反射(ATR)光谱,以光辐射发生在2种介质界面的全内反射为基础,如图1所示。当满足条件:介质1(晶体)的折射率n1大于介质2的折射率n2,当入射角θ大于临界角θc(sinθc=n2/n1)时,发生全反射。红外光在晶体内表面发生全反射时,在晶体的外表面附近产生隐失波。当样品与晶体外表面接触时,每个反射点隐失波都进入样品。从隐失波衰减的能量可以得到吸收信息。常用的ATR探头分为2种,一种是在晶体内部发生多次全内反射,另一种是单次全内反射ATR。多次全内反射ATR探头灵敏度高,价格贵,体积大,对于红外吸收较强的物质易引起饱和,本次实验为防止出现红外吸收过饱和现象,采用单次反射ATR探头[5]。
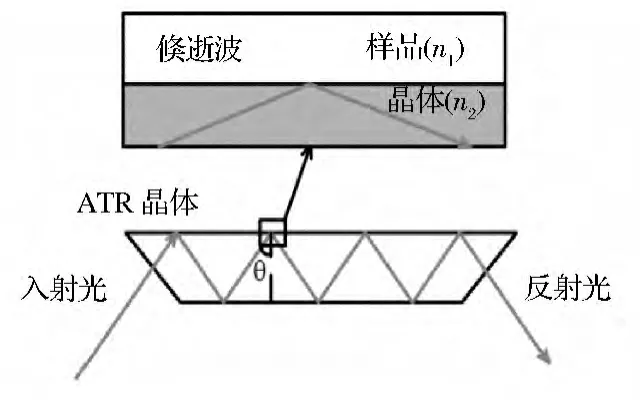
图1 ATR工作原理示意图Fig.1 The scheme of the attenuated total reflection(ATR)
2.2.2 光纤连接装置
红外光谱检测用特殊的硫化物红外光纤(如图2所示)来实现光谱仪器与反应釜的连接,硫化物对于红外吸收区吸收较弱,同时由于光纤特有的柔软性,使其与常见的光导管相比有更高的可操作性,外界的微震动或弯曲不会造成过高的实验误差,更适用于工业环境的实时检测[6]。

图2 光纤连接装置实物图Fig.2 Fiber optic connection device object
2.2.3 FTIR工作原理
FTIR光谱仪由3部分组成:红外光源、干涉仪和探测器,其中干涉仪是最主要部分[7]。FTIR光谱仪工作时,从光源发出连续的红外辐射经分束器后被分为相等的两束光,其中一束经透射后到达动镜M3,另一束经反射到达定镜M2。两束光分别经定镜和动镜反射再回到分束器发生干涉。由于动镜以恒定速度作直线运动,因而产生的干涉图是关于光程差的函数。通过样品池含有样品光信息的干涉光到达检测器,检测器测得的随时间的信号,经信号处理,通过傅里叶变换获得随波数(波长)的信号,最终得到透过率或吸光度随波数(波长)的红外吸收光谱图[8]。相比于色散型的光谱仪,FTIR有更高的分辨率和灵敏度。

图3 FTIR工作原理Fig.3 The scheme of FTIR spectrometer
2.2.4 实验仪器
本实验选用BRUKER FTIR(TENSOR27)光谱仪,分辨率为4 cm-1,波数范围4 000~400 cm-1,维持恒定的环境温度和湿度,每个样品扫描140次共1 min。光谱数据由相应的OPUS软件进行分析。实验装置如图4所示。

图4 在线FT-IR监测酵母菌发酵装置图Fig.4 System for the on-line FT-IR monitoring of yeast fermentation
光源发出红外光通过光纤输入端,入射到红外ATR探头,ATR探头与反应釜密封相连。经ATR探头反射的红外光通过光纤的输出端进入碲镉汞(MCT)探测器,探测器输出的信号经前置放大器、A/D变换,输入到计算机,经傅立叶变换得到红外吸收光谱,通过OPUS软件分析,从而获得甘油(甲醇)的含量。值得注意的是,在实验初期需要调整ATR附件反射镜的角度,使其输出到检测器的能量达到最大,尽量减小损失,提高性噪比。
3 实验数据分析
为实现在线监测,本实验借助外部光纤连接器件,将光谱仪与反应釜相连,改变传统离线检测方法。光纤连接器件采用专用的红外传输光纤,相比于光导管,其柔韧性好,在工业应用中能够在一定程度上减小外界震动引起光路变化损失的光强。在酵母菌培养过程中,甘油作为其发酵过程碳源,实时监控甘油含量的变化,及时进行补料显得尤为重要。同时在甲醇诱导蛋白表达的过程中,过高的甲醇含量会影响酵母菌的生长。所以,准确、快速监测反应釜中甘油和甲醇含量,对于保证酵母菌较好的生长发挥重要的作用。
常用的两种红外光谱定量分析方法:一是测量吸收峰的峰高,另一种是测量吸收峰的峰面积。采用峰面积进行定量分析往往比采用峰高进行定量分析更加准确[7]。而在进行定量分析时,必须从测定的光谱中找出特征峰,求其峰面积从而进行定量分析[9]。
对于不同的培养基,甘油和甲醇的红外吸收峰会发生微弱的变化,即使是相同的基底,在不同的浓度情况下红外吸收峰也会不同(图5)。
通过测量不同浓度情况下甘油和甲醇的毕赤酵母菌溶液,选择出最合适的甘油和甲醇红外积分区域1 060~1 025 cm-1和1 027~1 007 cm-1。从图5中可以看出,对于不同浓度的甘油和甲醇酵母菌溶液,随着浓度的增大,吸光度逐渐增加。
在过程检测中,将某一时刻多次光谱扫描数据的均值作为该时刻甘油(甲醇)的预测值,然而在实际监测过程中,可能由于反应釜搅拌棒的高速转动产生气泡,使得某次扫描红外ATR探头并未与反应物完全接触,而是处于气泡之中,这样在所得的数据中会存在异常值。在建模初期应用格拉布斯统计方法剔除异常值,从而进行后续处理。为了检验所建模型在本次试验条件下的准确度,首先用PLS建立的红外模型对不同浓度下的甘油和甲醇酵母菌溶液进行检测,实验数据如图6所示。
从图6中可以看出,甘油和甲醇的红外模型的预测相关系数分别达到0.985和0.998 7。

图5 不同浓度的甘油(a)和甲醇(b)酵母菌溶液Fig.5 Different concentrations of glycerol and methanol solution of yeast
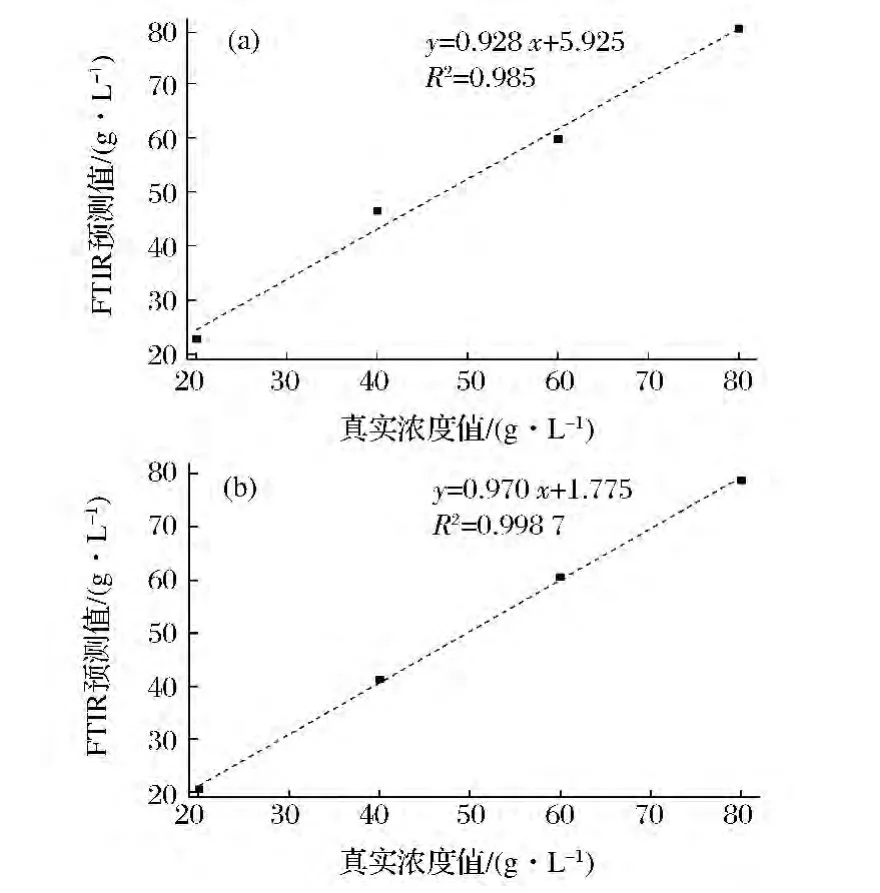
图6 甘油(a)和甲醇(b)相关性特性曲线Fig.6 Glycerol and methanol correlation characteristic curve
目前作为一种离线检测技术,FTIR光谱检测得到广泛的应用,大多应用在生物发酵过程中对光密度、生物量和各种反应物以及中间产物的监测[4,6,10-14]。但是国内对于红外在线的过程监测,相关的研究文献较少,还未成功的应用于实际生产。本实验,应用BRUKER FTIR(TENSOR27)光谱仪外加红外ATR附件对酵母菌培养过程中甘油和甲醇在线含量进行监测。
实验条件:反应釜中搅拌速率200 r/min,通气流量20 L/min,压力约0.3个大气压。
实验结果如图7所示。随着时间的增加,甘油含量从最初4%逐渐下降到1.2%,之后趋于稳定,这是因为随着甘油含量的降低,其红外吸收随之减弱,超出仪器所能探测到的范围。相比于离线红外检测的甘油检出限1%,仪器在线监测灵敏度相对较弱。在甘油完全耗尽之后,向反应釜中加入甲醇溶液刺激酵母菌的生长,图7-b中,甲醇含量逐渐降低直至0.7%左右,同样相比于离线甲醇检测的检出限0.5%,在线甲醇检测的灵敏度低。同时在单位时间内甘油和甲醇的含量变化分别为0.107%和0.226%。

图7 甘油(a)和甲醇(b)含量随时间的变化趋势Fig.7 Glycerol and methanol concentration varying trend with time going
图7中,甲醇和甘油的含量并不是完全严格的线性减少,在某一测试点会出现数据陡然增大或减小。图中实线为不同测试时刻多次测量的平均值,由于多次测量所处的反应状态不同,会出现一定的误差,但是从总体趋势看,随着时间的推移,甘油和甲醇的含量呈下降趋势。除此之外,当甘油(甲醇)浓度过低时,将无法准确的检出。目前,甘油和甲醇的离线检出限分别为1%和0.5%,在线检出限分别为1.2%和0.7%,更低浓度的测量结果不稳定,有待提高。相比于高转速(500 r/min)、短的扫描时间情况下,在低转速(200 r/min)、扫描时间较长的条件下所测得的数据较稳定[15]。
虽然在实验过程中,由于釜体的振动,或通气过程中釜体中气泡的产生,以及其他因素的影响会引起数据监测不稳定。但从甘油和甲醇含量总体趋势的变化,充分相信ATR-FTIR能够用于过程监测的可能性。
4 结论
红外光谱分析技术,作为一种快速、无损检测技术逐渐得到研究人员的关注[9]。在对酵母菌培养的过程中,应用ATR-FTIR对甘油和甲醇进行在线监测,实验结果表明:应用红外光谱分析技术能够成功的监测毕赤酵母菌生长过程中甘油(甲醇)含量的变化情况,甘油和甲醇红外模型相关度分别为0.985和0.998 7;培养开始40 h之后甘油耗尽,加入甲醇6 h之后其含量几乎为0。实验结果充分说明,红外光谱分析技术在工业制药行业在线监测物质含量变化的可行性。同时,随着红外光谱仪器的快速发展,数据分析技术的提升,相信红外光谱检测技术在工业生产过程控制中将发挥重要作用[14]。
[1] 翁诗甫.傅里叶变换红外光谱分析(第二版)[M].北京:化学工业出版,2010.
[2] D.Cozzolino,S.Roumeliotis and J.Eglinton.An attenuated total reflectance mid infrared(ATR-MIR)spectroscopy study of gelatinization in barley[J].Carbohydr Polym,2014,108(8):266-271.
[3] Schenk J,Marison I W,von Stockar U.A simple method to monitor and control methanol feeding of Pichia pastoris fermentations using mid-IR spectroscopy[J].J.Biotechnol.,2007,128(2):344-353.
[4] D.Landgrebe.On-line infrared spectroscopy for bioprocess monitoring[J].Appl Microbiol Biotechnol,2010,88(1):11-22.
[5] Siegfried Wartewig R H H N.Pharmaceutical applications of Mid-IR and Raman spectroscopy[J].Adv Drug Del Rev,2005,57(8):1 144-1 170.
[6] Heise H,Küpper L,Butvina L.Mid-infrared attenuated total reflection spectroscopy of human stratum corneum using a silver halide fiber probe of square cross-section and adhesive tape stripping[J].J Mol Struct,2003,661:381-389.
[7] Roychoudhury P,McNeil B,Harvey L M.Simultaneous determination of glycerol and clavulanic acid in an antibiotic bioprocess using attenuated total reflectance mid infrared spectroscopy[J].Anal Chim Acta,2007,585(2):246-252.
[8] Wartewig S,Neubert R H.Pharmaceutical applications of Mid-IR and Raman spectroscopy[J].Adv Drug Del Rev,2005,57(8):1 144-1 170.
[9] Sivakesava J I a A D S.Monitoring a bioprocess for ethanol production using FT-MIR and FT-Raman sepectroscopy[J].J Ind Microbiol Biotechnol,2001,26(4):185-190.
[10] Roychoudhury P Harvey L M,McNeil B.At-line monitoring of ammonium,glucose,methyl oleate and biomass in a complex antibiotic fermentation process using attenuated total reflectance-mid-infrared(ATR-MIR)spectroscopy[J].Anal Chim Acta,2006,561(1/2):218-224.
[11] Roychoudhury P,Harvey L M,McNeil B.The potential of mid infrared spectroscopy(MIRS)for real time bioprocess monitoring[J].Anal Chim Acta,2006,571(2):159-166.
[12] Macauley-Patrick S,Arnold S A,McCarthy B.Attenuated total reflectance Fourier transform mid-infrared spectroscopic quantification of sorbitol and sorbose during a Gluconobacter biotransformation process[J].Biotechnol Lett,2003,25(3):257-260.
[13] Lazarus L,Bryant S,Attila M.View[J].Amer J Med Sci,1994,308(2):133.
[14] Ennis J I,Veale L,Ali Demirci.An on-line approach to monitor ethanol fermentation using FTIR spectroscopy[J].Biotechnal.Prog.,2007,23(2):494-500.
[15] Mazarevica G,Diewok J,Baena J R.On-line fermentation monitoring by mid-infrared spectroscopy[J].Applied Spectroscopy,2004,58(7):804-810.
