阿维A联合雷公藤及他卡西醇软膏治疗中重度银屑病的临床疗效
2015-12-16牟宽厚张志灵赵恩兵西安交通大学第一附属医院皮肤科西安7006陕西省人民医院皮肤科
周 艳,韩 丹,牟宽厚,武 萌,张志灵,赵恩兵,殷 董(西安交通大学第一附属医院皮肤科,西安7006;陕西省人民医院皮肤科)
银屑病属于一种慢性炎症性皮肤病,临床表现以鳞屑性红斑伴瘙痒为主,可能是遗传、免疫和环境因素共同作用的结果[1]。目前,医学界缺乏理想的根治方法,治疗难度大,且容易反复发作,严重病患可出现其他并发症等,给患者带来很大痛苦。因此,临床上寻求安全、有效的方法显得至关重要。中西医结合治疗常达到增效减毒的目的,极具优势。目前临床上治疗手段很多,特别是口服及外用药物因方便易行应用最广泛。阿维A、雷公藤及他卡西醇均为常用的治疗银屑病药物。目前三药联合治疗中重度银屑病罕见报道,我们首次将三药联合治疗79例中重度银屑病患者资料进行回顾性研究分析,现报告如下。
1 资料与方法
1.1 病例选择
纳入标准:患者来自2011-07~2014-11西安交大一附院及陕西省人民医院皮肤科门诊,均符合寻常型银屑病的诊断标准,皮疹符合之外可合并关节病型银屑病。PASI评分>10分[2],1月内未接受过系统治疗,2周内未使用过治疗银屑病的外用药物。
排除标准:红皮病型银屑病及脓疱型银屑病;孕妇、哺乳期妇女及3年内有生育愿望的妇女;有严重肝、肾功能损害者及神经系统疾病者;脂质代谢异常者;有严重药物过敏者;3月内系统应用过皮质类固醇激素及免疫抑制剂者;正合并使用其他抗银屑病药物者。不能遵医嘱及继续治疗者。
入选病例依从性较好,均能按时复诊及检查。
1.2 分组及治疗方法
将入选的79例中重度银屑病患者进行回顾性分析,并按不同治疗方法将其分为三组。其中雷公藤组23例,雷公藤多苷片(浙江得恩德制药有限公司,国药准字 Z33020422),口服,20 mg/次,2-3 次/d,4 周为1疗程,4周后酌情减量,10-40 mg/d,共治疗8周;阿维A组26例,阿维A(重庆华邦制药有限公司,国药准字 H20010126),口服,20-40 mg/d,4 周为1疗程,4周后酌情减量,10-20 mg/d,共治疗8周;联合组30例,将上述2种口服药联合应用,用法与单独应用相同。三组均外用他卡西醇软膏(帝人制药株式会社,国药准字H20090570),1-2次/d。
1.3 疗效标准
本次研究中,对患者进行PASI评分,将人体表面分为头面、躯干、双上肢、双下肢4部分,然后对红斑、浸润深度、鳞屑的面积和严重程度进行加权评分[3]。所有患者在治疗前、治疗4周、治疗8周分别进行评分。PASI降低指数=(治疗前PASI分值-治疗后PASI分值)/治疗前PASI分值×100%。痊愈:PASI分值降低≥90%;显效:PASI分值降低60%-89%;有效:PASI分值降低20%-59%;无效:PASI评值降低<20%。痊愈+显效例数所占总例数百分比记为有效率。
1.4 安全性评价
尽可能仔细检查和记录患者在用药期间所发生的任何不良事件。
1.5 统计分析
采用SPSS16软件进行统计,年龄、病程及PASI分值为计量资料,三组间比较用One-Way ANOVA;银屑病种类、性别、有效率及并发症比率为计数资料,采用χ2检验。P<0.05有统计学意义。
2 结果
2.1 一般资料比较
三组患者银屑病种类、性别、年龄及病程等指标经过统计学分析发现差异无统计学意义(P>0.05,见表1),具有可比性。
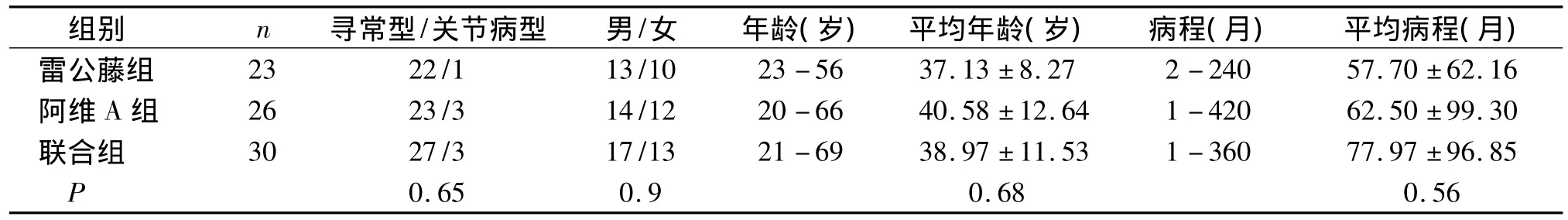
表1 三组患者的一般资料Table 1 General data of patients in three groups
2.2 PASI分值评价
各组治疗4周及8周,PASI分值与治疗前比较差异均有显著性(P<0.001)。三组治疗前及治疗8周时PASI分值差异不显著(P>0.05),而治疗4周时联合组PASI分值与雷公藤组及阿维A组比较差异有显著性(P <0.05,见表2)。
2.3 疗效评价
各组在治疗8周和治疗4周时的有效率均有不同程度提高,但治疗8周和4周有效率相比并无显著提高(P>0.05)。治疗4周时联合组有效率明显高于雷公藤组(P<0.05),联合组有效率与阿维A组比较差异无显著性(P>0.05),雷公藤组与阿维A组有效率差异亦无显著性(P>0.05)。治疗8周时联合组有效率明显高于雷公藤组(P<0.05)及阿维A组(P<0.05),而雷公藤组与阿维A组有效率比较差异无显著性(P>0.05,见表3)。另外,79例患者中有7例合并关节炎型银屑病,其中阿维A组3例,治疗8周后皮疹改善,但关节疼痛无缓解,其余4例则可减轻关节痛,因样本量太小,未做统计分析。

表2 三组患者PASI评分对比Table 2 Comparison of PASI score among three groups
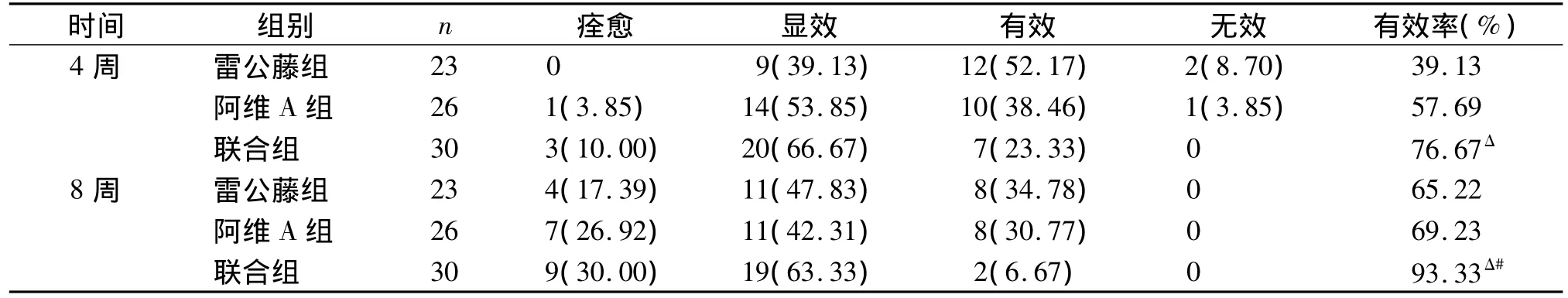
表3 三组患者治疗效果对比 例(%)Table 3 Com parison of efficacy among three groups cases(%)
2.4 安全性评价
本次研究中,三组间血常规、肝功、肾功异常、高脂血症、月经异常、消化道不适、乏力、脱发、皮肤黏膜干燥、光敏感以及瘙痒加重等并发症发生率差异无显著性(P>0.05)。联合组至少一种不良反应发生率最高,但三组间差异无显著性(P>0.05)。2种及以上不良反应发生率三组间差异亦无显著性(P>0.05,见表4)。治疗过程中患者耐受性较好,均完成8周疗程。
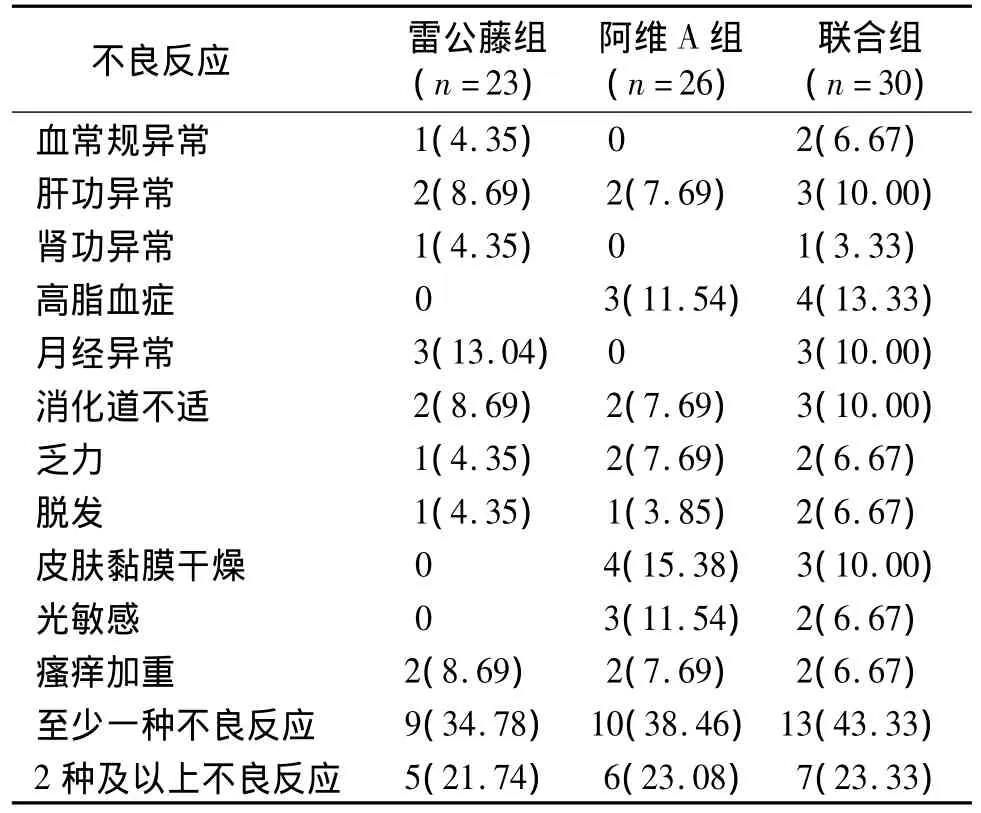
表4 三组患者并发症比较 例(%)Table 4 Com parison of com p lications among three groups cases(%)
3 讨论
阿维A是近年来治疗中重度银屑病使用较多的西药,其治疗银屑病的主要作用是影响角质形成细胞的增殖和终末分化,降低角质层的黏聚力[4]。而传统中药雷公藤已在临床广泛应用,药理研究证明,雷公藤有抗炎、免疫调节等多种作用,从而发挥其治疗银屑病的功效[5]。他卡西醇软膏作为维生素D3衍生物已成为斑块状银屑病局部治疗的一线用药,可直接作用于皮肤抑制角质形成细胞增殖,促进正常角化[6,7]。
本临床研究结果发现三组治疗4周及8周后,PASI分值与治疗前比较差异均有统计学意义(P<0.001),这说明阿维A加他卡西醇软膏、雷公藤加他卡西醇软膏或者三者联合应用治疗重症银屑病均可缓解银屑病症状。治疗4周时联合组PASI分值低于雷公藤组和阿维A组(P<0.05),同时联合组有效率明显高于雷公藤组(P<0.05),而治疗8周时联合组有效率明显高于雷公藤组及阿维A组(P<0.05)。这说明三种药物联合应用疗效更佳,在治疗4周即出现优势,优于雷公藤组;治疗8周优势更明显,优于阿维A及雷公藤组。三药联合治疗,起效较快,治疗4周PASI评分就降为7.98±4.10,下降了70%之多,有效率则达到了76.67%,而且随着疗程延长,PASI评分更降低为4.88±3.32,有效率则升高达93.33%。由此可见,这三种药物可能从抑制增生、调节免疫、改善角化异常等不同方面共同发挥其药理作用,从而缩短了疗程,取得更好效果。研究发现7例合并关节炎型银屑病,其中4例口服雷公藤者治疗后,除皮疹改善外,均可减轻关节痛,而单用阿维A治疗的3例,仅有皮疹改善。尽管样本量较少,也提示雷公藤的抗炎效应优于阿维A。
众所周知,雷公藤具有较大的毒副作用,能引起肾脏、消化、生殖、造血、心血管及神经系统损害,其中,生殖系统受损最为严重。然而因无法监测生殖系统受损,在选择患者时,尽可能避免未生育者。由于有研究证实1月内应用雷公藤每日40 mg,其不育是可恢复的。所以如果遇到适合雷公藤治疗而病情较重的未生育者,尽可能缩短疗程并减少剂量[8]。本次研究中联合组出现的不良反应为血常规、肝功、肾功异常、高脂血症、月经异常、消化道不适、乏力、脱发、皮肤黏膜干燥、光敏感以及瘙痒加重。雷公藤组除高脂血症、皮肤黏膜干燥、光敏感以外其余不良反应均有,符合雷公藤常见并发症[8]。阿维A组除血常规、肾功及月经异常以外其余副反应均可见,这与阿维A常见不良反应一致[9]。但是各种并发症发生率均较低,且各组间差异无显著性(P>0.05)。联合组中至少一种不良反应发生率最高,为43.33%,但三组间差异亦无显著性(P>0.05)。三组间2种及以上不良反应发生率差异亦无显著性(P>0.05)。因此三种药物联合并未增加并发症发生率,这可能与联合治疗疗程短、药物剂量低等因素有关。而他卡西醇软膏在维生素D3衍生物中副作用较少,可以在头面部使用,安全性很高[10]。
综上所述,口服阿维A及雷公藤,联合外用他卡西醇软膏治疗中重度银屑病疗效满意。虽然其并发症较多,但是这些并发症患者均能够承受。在治疗中重度银屑病时,我们应该扩展思维,根据患者情况采用药物联合治疗,在治疗过程中根据患者的临床症状等进行药物增减,从而快速改善病情,更好地提高治愈率,减少并发症。
[1]Nograles KE,Davidovici B,Krueger JG.New insights in the immunologic basis of psoriasis[J].Semin Cutan Med Surg,2010,29(1):3-9.
[2]Mrowietz U,Kragballe K,Reich K,et al.Definition of treatment goals for moderate to severe psoriasis:a European consensus[J].Arch Dermatol Res,2011,303(1):1-10.
[3]Langley RG,Ellis CN.Evaluating psoriasis with Psoriasis Area and Severity Index,Psoriasis Global Assessment,and Lattice System Physician's Global Assessment[J].J Am Acad Dermatol,2004,51:563-569.
[4]Kuenzli S,Saurat JH.Retinoids for the treatment of psoriasis:outlook for the future[J].Curr Opin Investig Drugs,2001,2(5):625-630.
[5] 冯文莉;张荣丽;王丽,等.雷公藤多甙对银屑病患者T淋巴细胞亚群的作用及意义[J].山西医科大学学报,2002,33(5):453-455.
[6]Van de Kerkhof PC,Berth-Jones J,Griffiths CE,et al.Long-term efficacy and safety of tacalcitol ointment in patients with chronic plaque psoriasis[J].Br J Dermatol,2002,146(3):414-422.
[7]Sato-Deguchi E,Imafuku S,Chou B,et al.Topical vitamin D3analogues induce thymic stromal lymphopoietin and cathelicidin in psoriatic skin lesions[J].Br J Dermatol,2012,167(1):77-84.
[8]Han R,Rostami-Yazdi M,Gerdes S,et al.Triptolide in the treatment of psoriasis and other immune-mediated inflammatory diseases[J].Br J Clin Pharmacol,2012,74(3):424-436.
[9]Borghi A,Corazza M,Maria AM,et al.Low-dose Acitretin in Treatment of Plaque-type Psoriasis:Descriptive Study of Efficacy and Safety[J].Acta Derm Venereol,2015,95(2):332-336.
[10]Leone G,Pacifico A.Profile of clinical efficacy and safety of topical tacalcitol[J].Acta Biomed,2005,76(1):13-19.
