番茄红素影响NF-κB表达对脊髓损伤后大鼠神经功能恢复的作用
2015-12-16唐丽娟成都医学院基础医学院基础医学实验教学中心成都610500通讯作者mailyzixjj163com
唐丽娟,陈 勇,杨 拯,李 晓,张 晓(成都医学院基础医学院基础医学实验教学中心,成都 610500;通讯作者,E-mail:yzixjj@163.com)
脊髓损伤(spinal cord injury,SCI)所造成的外伤性截瘫是最严重的外伤之一。据统计,全世界范围内SCI的发病率大约每年(20-40)/100万人。随着现代交通工具使用的增加,临床上脊柱外伤合并SCI的病例有逐渐增多的趋势。因此,SCI的病理生理的实验研究及治疗方法的探索受到了更广泛的关注。研究发现[1],继发性脊髓损伤的机制可能是SCI后免疫炎症反应,其他各种损伤机制均由免疫炎症反应引起,并有发现减轻SCI后早期炎症反应可以起到神经保护和功能恢复的作用[2]。因此,在脊髓损伤早期,有效地控制脊髓的继发性损伤是一个重要的研究方向。
番茄红素(lycopene,LP)是一种开链式的不饱和类胡萝卜素,具有多种优越的生理功能,有着广泛的应用前景。实验研究证实[3],番茄红素可通过其高效猝灭单线氧态和清除自由基的能力,减轻大鼠脊髓损伤后的脂质过氧化反应,还可通过多种途径发挥抗免疫炎症反应的作用。本实验采用免疫组织化学染色检测脊髓损伤模型脊髓组织中NF-κB的表达,以及后肢功能BBB评分,探讨番茄红素治疗脊髓损伤后NF-κB表达对神经功能恢复的影响。
1 材料与方法
1.1 实验动物与分组
健康、清洁级成年SD大鼠36只,雌性(雌性大鼠尿道短,尿道感染、水肿发生概率低,不易形成尿道阻塞,有利于脊髓损伤术后护理,可提高术后大鼠生存率),体重(230±20)g,由四川大学实验动物中心提供,许可证号:SCXK(川)-10-2006。将36只大鼠按Allen法[4]造脊髓损伤模型后采用随机数据表法分为3组:对照组、甲泼尼龙琥珀酸钠治疗组(MP组)和番茄红素组,每组12只。每组再随机按1,3,7 d分成3个亚组,每个时间点4只。
1.2 主要试剂和仪器
6%番茄红素油树脂(新疆瑞德莱福生物科技有限公司),批号:HY1007261;注射用甲泼尼龙琥珀酸钠(天津药业焦作有限公司),批号:10031501;戊巴比妥钠(德国进口分装,北京化学试剂公司),批号:100808;注射用青霉素钠(瑞阳制药有限公司),批号:10013101;NF-κB一抗(武汉博士德生物工程有限公司),批号:D-C1-07C14B;兔抗大鼠二抗试剂盒(武汉博士德生物工程有限公司);批号:07E04AJ;自制数字式脊髓损伤动物模型制备仪。
1.3 模型制备
选取正常SD大鼠,采用腹腔注射麻醉1.5%戊巴比妥钠(30 mg/kg),首先剪除大鼠胸椎区域毛,而后均匀喷洒碘伏溶液两倍备皮区域。以T9棘突为中心做背部正中切口,长约2 cm,逐步暴露浅筋膜、肌肉直到椎骨,再用手术刀小心去除T9椎骨上的肌肉。随后进行椎板切除术,用有齿镊剥离T9棘突和椎间软组织,然后用持针器慢慢剥开锥板(切勿损伤硬脊膜),暴露脊髓,并适当修剪两侧锥板以获得良好显露,用自制数字式脊髓损伤动物模型制备仪打击器制成脊髓损伤模型,打击强度为10 g×25 mm,打击后即刻见大鼠双后肢发生不同程度抽搐,尾巴甩动,随后完全松弛,标志模型制备成功,然后逐层缝合手术创口。术后立即腹腔注射9 ml/kg氯化钠溶液,以减轻手术过程中出血导致的血容量减少。为了避免感染,还要进行青霉素腹腔注射,并在此后3 d每天腹腔注射8×104U青霉素。术后保持大鼠笼具清洁,身体干净,使其自由进食、饮水。并每天在相应时刻对大鼠进行排尿,直至其恢复自主排尿。
1.4 治疗方法
对照组造模成功后不给予治疗。MP组造模成功后30 min采用腹腔注射首次给药,其剂量为30 mg/kg甲泼尼龙琥珀酸钠,此后24 h注射4次甲泼尼龙琥珀酸钠,每6 h注射5.4 mg/(kg·h)进行。番茄红素组造模成功后30 min灌胃溶有番茄红素油树脂的玉米油2 ml(按20 mg/kg番茄红素配制),此后每天灌胃1次。
1.5 评定方法
每组大鼠按1 d、3 d和7 d亚组进行评定。
1.5.1 BBB 评分 于术后1,3,7 d采用 Basso Beattie Bresnahan(BBB)评分[5]法评估大鼠后肢运动功能恢复情况。观察者为非本实验人员,并且对评分标准十分熟悉。评分前应检查所有实验动物的膀胱是否充盈,以免因膀胱肌充盈而影响活动。动物应尽量保持在活动范围的中心区域活动。采用双人双盲法观察其后肢运动情况,联合考察大鼠后肢各关节活动、后肢的步态和协调功能、运动时爪子的精细运动。取左右两侧肢体评分平均值作为最后得分。
1.5.2 组织学分析 术后1,3,7 d,各组分别取7只大鼠,以1.5%戊巴比妥钠麻醉后,开胸暴露心脏和升主动脉,将灌注插管经左心室插入升主动脉,固定插管剪开右心房。快速灌注冰生理盐水冲净血液至肝脏及巩膜苍白为止,立即转换4%多聚甲醛灌注150-200 ml,其中前1/3快速灌注,后2/3缓慢灌注,至鼠体变硬时停止。原路显露并仔细咬除T7-T10棘突和椎板,切取1 cm损伤区域脊髓组织,然后进行石蜡包埋,损伤段做横行切片,片厚5 μm(20 μm),用于免疫组织化学检测 NF-κB。
1.5.3 图像采集与分析 每个免疫组化标本取一张切片,在同等亮度、像素、曝光、对比度等条件下使用Olympus拍照系统用10×40放大倍数,随机选择5个视野,对每个指标进行统一图像拍照。最后用Image-Pro Plus 6.0图像处理系统计算每个视野的平均光密度值,光密度值越大表示NF-κB表达越高。
1.5.4 统计学分析 用SPSS 17.0统计软件处理,实验数据用±s表示,组间比较采用单因素ANOVA进行分析,显著性水平为α=0.05。
2 结果
2.1 一般情况
大鼠术后苏醒,静卧少动,气息较微,双后肢运动功能丧失,肌张力降为零,无食欲,不进水,尿失禁或下腹部膨隆,膀胱发生尿潴留,呈现不完全脊髓损伤的表现。术后前3 d,大鼠活动、进食较少,尿潴留比较严重,部分伴血尿及腹部胀气,此后饮食逐渐增加活动逐渐增多。由于实验期间护理良好,5-7 d后,大部分大鼠能够基本恢复自主排尿,且伤口未见感染,身体未出现褥疮,36只大鼠均进入结果分析。
2.2 BBB 评分
术前所有大鼠评分均为21分。术后1,3,7 d,番茄红素组与对照组相比,BBB评分均明显增高(P<0.05),MP组术后1,7 d评分显著高于对照组(P<0.05,见表1),3 d虽也高于对照组,但差异无统计学意义。
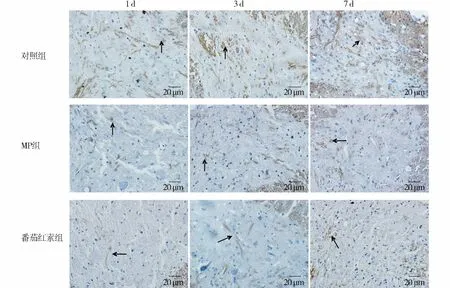
图1 大鼠造模后1 d,3 d和7 d NF-κB核转移情况 (免疫组化染色,×400)Figure 1 NF-κB nuclear transfer at 1 d,3 d and 7 d after SCI (immunohistochemical staining,× 400)

表1 脊髓损伤大鼠BBB评分结果 (分)Table 1 Com parison of BBB scores of rats after spinal cord injury (scores)
2.3 NF-κB 检测结果
术后1 d番茄红素组的NF-κB表达与对照组NF-κB表达比较(P<0.001)。术后3 d和7 d MP组和番茄红素组NF-κB的表达均明显低于对照组(P <0.001,见表2)。对照组 NF-κB 的表达随时间而增多,7 d最多;MP组和番茄红素组NF-κB的表达随时间而减少,7 d最少。对照组可见大量NF-κB阳性表达颗粒,颗粒着色深。MP组和番茄红素组NF-κB阳性表达颗粒较模型组少,着色较浅(图1,见第608页)。
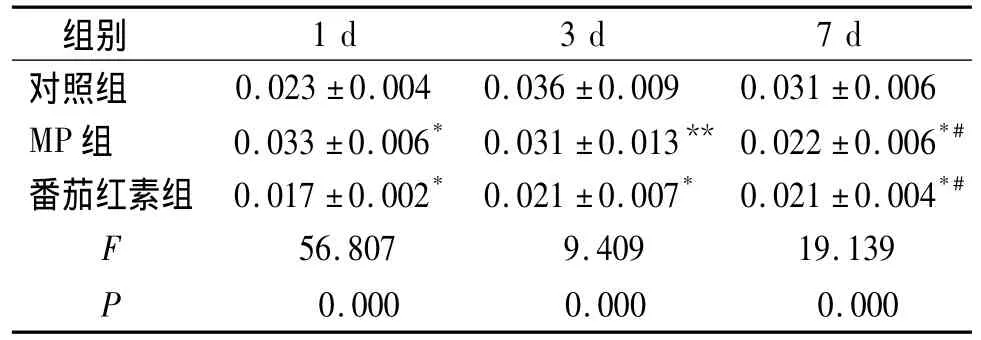
表2 脊髓损伤大鼠NF-κB的变化Table 2 Com parison of expression of NF-κB after spinal cord injury
3 讨论
研究发现,免疫炎症反应对继发性脊髓损伤有着直接的影响[6],而炎性细胞因子的表达更是贯穿炎症反应的始终。炎性细胞因子主要是由机体的免疫细胞分泌,正常情况下,炎症细胞因子含量极低,但在各种因素刺激如感染、外伤、缺血后其表达可急剧增加,过度表达可导致或加重组织损伤[7]。因此,减轻SCI后的早期炎症反应是治疗脊髓损伤的有效途径之一。
NF-κB被认为是调控机体炎症反应的总源头[8]。正常情况下,NF-κB是普遍存在于真核细胞中的一种快反应转录因子,在静息状态下与抑制性蛋白IκB结合并以非活性状态存在于胞质内。经一定的刺激后,IκB磷酸化和随后的泛素化降解。NF-κB自由易位到细胞核内,与DNA结合,激活反应的靶基因导致各种各样的炎症反应,活化后并上调各种炎症介质,如:TNF-α、IL-1、IL-6、IL-8 及氧自由基等一系列物质[9]。近年来许多研究表明,SCI后产生一些氧自由基和细胞因子可刺激神经细胞、微血管内皮细胞和胶质细胞中的NF-κB激活进入胞核并与靶序列结合,调节相关基因的转录活性,如ICAM-1、TNF-a、IL-1、IL-6 等,其基因的增强子和启动子中均含有与NF-κB的结合位点,形成一种正反馈增加损伤区的炎症反应,增加组织损害程度。因此,在脊髓损伤的早期抑制NF-κB的激活可以减轻免疫炎症反应,促进损伤后神经功能的再生与修复,加快脊髓损伤大鼠运动功能的恢复。
番茄红素(lycopene,LP)是一种开链式的不饱和类胡萝卜素,抗氧化性能是天然类胡萝卜素中最强的,其抗氧化能力是β-胡萝卜素的2倍,维生素E的100倍[10]。最早的有关番茄红素生物活性的报道是在1959年,Ernster和他的同事们发现在辐射后的小鼠腹腔内注射番茄红素后生存率提高了,并能抵抗细菌的感染。我们在前期的实验中已经证实,番茄红素通过其高效猝灭单线氧态和清除自由基的能力,减轻了大鼠脊髓损伤后的脂质过氧化反应[2]。大量研究还显示,番茄红素还能通过多种途径发挥其抗免疫炎症反应的作用[11,12]。Feng 等[13]发现番茄红素通过抑制巨噬细胞中ERK,p38MAPK和NF-κB激活来抑制脂多糖(LPS)诱导NO和IL-6的产生,从而减少免疫炎症反应。研究报道[14]番茄红素能抑制脂肪组织中 TNF-α、NF-κB、IL-1β、IL-6和 MCP-1等致炎细胞因子和趋化因子的表达,以预防和限制与肥胖有关的疾病。番茄红素还可通过抑制PI3K/Akt/mTOR信号通路,抑制人大肠癌细胞HT-29细胞的细胞增殖,发挥其抗癌活性[15]。综上所述,番茄红素可以通过清除自由基、抑制氧自由基的产生,抑制 IL-1、TNF-α、IL-6等炎性因子的产生和NF-κB的激活,减轻炎症反应对组织细胞的伤害。
本研究结果显示,番茄红素能有效促进大鼠脊髓损伤后运动功能的恢复,番茄红素组的BBB评分在造模后各时间点均高于同时间点SCI模型组,且差异有显著性。同时,番茄红素组NF-κB核转运在各时间点均明显少于SCI模型组,在损伤后3 d,各组NF-κB表达量最多。随着时间的延长,甲泼尼龙琥珀酸钠治疗组和番茄红素治疗组NF-κB的表达明显降低,且番茄红素组比表达最少,这表明番茄红素可通过在SCI后抑制NF-κB激活,减轻炎症反应脊髓血管及神经细胞等的继发损伤,起到对神经组织的保护作用,从而有效促进脊髓损伤大鼠运动功能的恢复。本实验为番茄红素临床应用提供了理论基础,它作为新型功能性天然营养素,具有抗氧化和抗炎等多种生物学功能,用于治疗脊髓损伤安全、副作用小,有望成为临床治疗SCI的备选药物之一,但其保护作用的具体机制还不清楚,有必要进一步深入探讨和研究。
[1]Rowland JW,Hawryluk GW,Kwon B,et al.Current status of acute spinal cord injury pathophysiology and emerging therapies:promise on the horizon[J].Neur Focus,2008,25(5):E2.
[2]David S,Kroner A.Repertoire of microglial and macrophage responses after spinal cord injury[J].Nat Rev Neurosci,2011,12(7):388-399.
[3]李晓,罗晨禹,杨拯,等.番茄红素抗氧化应激效应对大鼠脊髓损伤后运动功能恢复的影响[J].中国康复理论与实践,2013,19(2):132-135.
[4]Allen AR.Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocaion of spinal colum[J].JAMA,1911,57(4):878-880.
[5]Rivlin AS,Tator CH.Objective clinical assessment of motor function after experimental spinal cord injury in rat[J].J Neurosurg,1977,47:577-581.
[6]Leal-Filho MB.Spinal cord injury:Frominflammation to glial scar[J].Surg Neurol Int,2011,2:112-121.
[7]Hanada T,Yoshimura A.Regulation of cytokine signaling and inflammation[J].Cytokine Growth Factor Rev,2004,13(4):413-415.
[8]Flohe SB,Bruggemann J,Herder C,et al.Enhanced proinflammatory response to endotoxin after priming of macrophages with lead ions[J].J Leukoc Biol,2002,71:417-424.
[9]Shishodia S,Shrivastava A,Sodhi A.Protein kinase C:a potential pathway of macrophage activation with cisplatin[J].Immunol Lett,1998,61:179-186.
[10]仲伟鉴.β-胡萝卜素的癌症化学预防机理研究进展[J].卫生研究,2002,31(5):398-401.
[11]Rossella E,Marco R,Assunta C.Lycopene inhibits NF-κB-Mediated IL-8 expression and changes redox and PPARc signalling in cigarette smoke-stimulated macrophages[J].PLos One,2011,6(5):1-11.
[12]Paola P,Rossella S,Assunta C,et al.Lycopene prevention of oxysterol-induced proinflammatory cytokine cascade in human macrophages:inhibition of NF-κB nuclear binding and increase in PPARγ expression[J].Nutr Biochem,2011,22:259-268.
[13]Feng D,Ling WH,Duan RD.Lycopene suppresses LPS-induced NO and IL-6 production by inhibiting the activation of ERK,p38MAPK,and NF-κB in macrophages[J].Inflamm Res,2010,59:115-121.
[14]Gouranton E,Thabuis C,Riollet C,et al.Lycopene inhibits proinflammatory cytokine and chemokine expression in adipose tissue[J].Nutr Biochem,2011,22:642-648.
[15]Tang FY,Cho HJ,Pai MH,et al.Concomitant supplementation of lycopene and eicosapentaenoic acid inhibits the proliferation of human colon cancer cells[J].J Nutr Biochem,2009,20(6):426-434.
