EPHB6的缺失突变del915-917促进非小细胞肺癌细胞的迁移
2015-12-16张学策陈宝莹西安医学院第二附属医院中心实验室西安7008西安交通大学医学院第一附属医院麻醉科第四军医大学唐都医院放射科通讯作者mailpclampercom
于 军,铁 茹,张学策,常 盼,赵 鸽,陈宝莹(西安医学院第二附属医院中心实验室,西安 7008;西安交通大学医学院第一附属医院麻醉科;第四军医大学唐都医院放射科;通讯作者,E-mail:pclamper@6.com)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要病理类型[1,2],而远端转移是NSCLC患者的主要死亡原因。受体型酪氨酸蛋白激酶(receptor tyrosine kinases,RTKs)在NSCLC 的转移过程中发挥重要的作用[3,4]。目前,大家最熟悉的与肿瘤转移表型相关的RTK是表皮生长因子受体(epidermal growth factor receptor,EGFR)及其家族的成员 ERBB2/Her2、ERBB3和 ERBB4。因此,以EGFR为代表的RTKs成为肿瘤分子靶向治疗的靶点[3,5]。EPH 是RTKs中最大的一个亚家族。到目前为止,脊椎动物中发现了16种EPH分子,分为EPHA受体1-10(EPHA1-A10)和EPHB受体1-6(EPHB1-B6)[6,7]。EPHB6 受体与其配体 Ephrin相互作用。当与其配体Ephrin相互作用后,EPH受体调控一系列的细胞生物学行为,包括细胞与细胞的相互作用、细胞迁移等[8,9]。EPHB6缺失与晚期的NSCLC和癌症的进展密切相关[10-16]。有报道显示,EPHB6高表达是神经母细胞瘤预后良好的标记[10,12]。而且,在转移的黑色素瘤和具有转移特性的乳腺癌细胞系中EPHB6的mRNA表达降低[14-16]。在功能上,EPHB6抑制培养的乳腺癌细胞的侵袭、生长和克隆形成[17-18],调控细胞黏附与迁移[19]。
一些RTKs的表达水平与早期NSCLC的转移密切相关,多数RTKs的mRNA高表达与NSCLC转移正相关,而EPHB6高表达与NSCLC的转移负相关[20]。最近,我们 EPHB6在 NSCLC中甲基化沉默,而且其再激活能够抑制NSCLC转移[21]。我们通过测序筛查 EPHB6编码区的序列,发现了EPHB6 一个新的突变 del915-917[22],但其功能不明,本研究在肺腺癌细胞系A549中评价EPHB6的缺失突变del915-917的功能。
1 材料和方法
1.1 细胞培养
本研究用到的NSCLC细胞的培养按照以往的方法进行[21]。A549肺腺癌细胞培养于37℃、5%CO2的孵箱中,采用 DMEM(Dulbecco’s Modified Eagle’s medium,Invitrogen,Carlsbad,CA)培养基。培养基补充10%胎牛血清(fetal calf serum,FCS)、1%的青链霉素。HTB56、HTB58细胞于37℃、5%CO2的孵箱中,采用 MEM(Modified Eagle’s medium,Invitrogen,Carlsbad.CA)培养基。补充10%FCS、1%的青链霉素、1%的谷氨酰胺、1%的丙酮酸钠和1%的非必需氨基酸。
1.2 定点突变
将人EPHB6的cDNA编码区(base 833-3853 NCBI Accession No.NM_004445)克隆进入pcDNA4 To/myc/hisA表达载体(Invitrogen,Carlsbad,CA,USA)。EPHB6的突变采用QuickChange XL定点突变试剂盒(Stratagene,La Jolla,CA,USA)。以pcDNA4-EPHB6作为模板,上游引物为:5'-AGGCTGGCGGGGAAAGGCCTTCCCAGG,下游引物为:5'-CCTGGGAAGGCCTTTCCCCGCCAGCCT。测序 Big-Dye Terminator V3.1 Cycle Sequencing Kit(Applied Biosystems),在 ABI3730xl自动 DNA测序仪上完成。测序得到的EPHB6编码区序列与参考序列(GenBank accession No.NM_004445)进行比对,确认序列的正确性。
1.3 细胞转染和目的基因的表达
采用转染试剂Nanofectin(PAA,Austria)转染A549细胞,操作按照说明书进行。pcDNA4(空载体)、野生型EPHB6表达载体(pcDNA4-EPHB6-wt)或突变型EPHB6表达载体与EGFP的表达载体(pcDNA3.1-GFP,表达绿色荧光蛋白 EGFP)共转染。为了得到稳定转染的细胞,用700 μg/ml的G418(Sigma,St.Louis,MO,USA)和 400 μg/ml的Zeocin(Invitrogen,Carlsbad,CA,USA)进行筛选。利用流式细胞仪FACS对EGFP表达阳性的细胞进行分选。对得到的稳定转染细胞采用Western blot对于EPHB6的表达水平进行确认。
1.4 Western blot检测EPHB6及其突变体的表达
采用Western blot检测EPHB6及其突变体的表达,参照以往报道的方法进行[21,23]。小鼠抗人EPHB6 单克隆抗体(1 μg/ml,Abnova Corporation,Neihu,Taipei,Taiwan)、兔抗人 β-actin多克隆抗体(40 ng/ml,Sigma,USA)作为一抗,羊抗小鼠或羊抗兔多克隆抗体(Dianova,Hamburg,Germany)作为二抗。
1.5 细胞活力检测
用含10%胎牛血清的DMEM培养液配成单个细胞悬液,以每孔5×103个细胞接种于96孔培养板中,每孔体积200 μl。将培养板移入CO2孵箱中,在37℃、5%CO2及饱和湿度条件下培养24 h。每孔加入MTT溶液(5 mg/ml)20 μl,37℃孵箱中继续孵育4 h,终止培养,小心吸弃孔内培养上清液。每孔加入150 μl二甲基亚砜(DMSO),振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫检测仪上测定各孔光吸收值,记录结果。
1.6 细胞迁移的检测
将每孔5×105个A549细胞(悬浮于100 μl含5%FCS的DMEM培养基中)接种在用于细胞迁移检测的Transwell®小室(滤膜直径6.5 mm,滤孔的孔径 6.5 mm,Corning Inc,Corning,NY)的上层。小室的下层加入600 μl含20%FCS的DMEM培养基。孵育(37℃、5%CO2)16 h,采用流式细胞仪对小室下层中的细胞计数。独立的实验至少重复3次,每次做3个复孔。
1.7 划痕实验
将A549细胞接种于25 ml的细胞培养瓶,接种密度为每瓶350 000个细胞,培养3 d,用10 μl移液器头在单层融合细胞上面划痕。更换新鲜的培养基,采用显微录像拍摄观察伤痕的愈合过程。共拍摄观察 17 h,每间隔 10 min拍摄一次,摄像机(ZEISS light microscope Axiovert 40C)连接于 CCD摄像机(Hamamatsu)。图像的采集采用HiPic 32图像处理系统和WASAB软件(Hamamatsu Imaging Software),图像分析采用Image J软件。独立的实验重复3次。
1.8 细胞大小分析
分别将空载体对照、稳定表达野生型、突变性EPHB6的A549细胞接种于预包被胶原的细胞培养瓶。培养5 h,使细胞贴壁,采用显微录像拍摄系统观察细胞。摄像机(ZEISS light microscope Axiovert 40C)连接于CCD摄像机(Hamamatsu)。图像的采集采用HiPic 32高效图像控制系统(High Performance Image Control System)和 WASAB软件(Hamamatsu Imaging Software)。对于细胞大小(μm2)的分析采用Image J软件,按照以往的报道进行[24]。
1.9 统计学分析
2 结果
2.1 野生型EPHB6和突变体在A549细胞中的稳定表达
为了研究EPHB6突变体的功能,我们分别构建了EPHB6-wt、EPHB6-del915-917表达载体,分别转染A549肺腺癌细胞,筛选得到稳定表达的细胞。如图1所示,以β-actin为内参照,采用Western blot的方法检测EPHB6及其突变体的表达情况,其中A549为没有经过转染的细胞,A549-control为转染空载体pcDNA4的 A549细胞,A549EPHB6-wt和 A549EPHB6-del915-917分别为转染EPHB6-wt、EPHB6-del915-917表达载体的A549细胞。结果 显示,EPHB6-del915-917和EPHB6-wt的表达水平稳定。

图1 野生型和突变型EPHB6在A549细胞中的表达Figure 1 Expression of wild type and mutant EPHB6 in A549 cells
2.2 EPHB6-del915-917促进A549细胞的迁移
细胞迁移实验采用美国Corning公司生产的细胞转移培养板(Transwell migration plates),将待测细胞接种于上下小室之间的膜上,比较穿过 Transwell®小室的细胞数发现:和对照组比较,迁移到下层小室的A549EPHB6-wt和A549EPHB6-del915-917细胞均显著增多(P<0.05)。特别是,表达EPHB6突变体的细胞显著多于表达野生型EPHB6的A549细胞(P <0.05,见图2)。
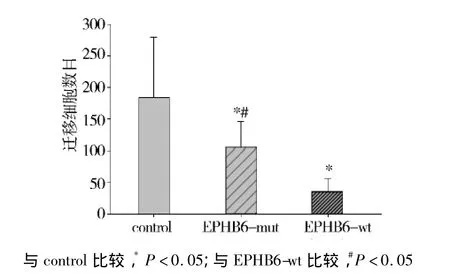
图2 突变型EPHB6对A549细胞的迁移的影响Figure 2 Effects of mutant EPHB6 on the migration of A549 cells
为了进一步确认细胞的体外迁移能力,我们进行了划痕实验。造成划痕8 h后,稳定转染EPHB6-del915-917的A549细胞愈合3%,野生型EPHB6细胞划痕愈合1.6%,转染空载体的对照细胞愈合2%(见图3)。与空载体对照相比,野生型的EPHB6能够显著抑制A549细胞的体外划痕愈合,而稳定转染EPHB6-del915-917的A549细胞划痕愈合速度显著加快(见图3)。表明 EPHB6突变不仅导致EPHB6抑制划痕愈合的效应完全消失,而且其突变体具有显著促进划痕愈合的效应。

图3 突变型EPHB6对NSCLC细胞划痕愈合的影响Figure 3 Effects of mutant EPHB6 on the wound healing of A549 cells
2.3 EPHB6-del915-917不改变 A549细胞的增殖活力,但影响细胞大小
为了明确EPHB6突变是通过何种方式促进细胞迁移,我们进一步检测了EPHB6突变对于细胞活力与细胞大小的影响。实验结果显示,各组细胞的MTT光吸收值无显著差异(P>0.05,见图4),表明EPHB6突变并不改变细胞的增殖活性(见图4),但明显使细胞变小(P<0.05,见图5)。表明EPHB6通过改变细胞的大小,增强其迁移能力。

图4 突变型EPHB6对A549细胞增殖活性的影响Figure 4 Effects of mutant EPHB6 on the proliferation of A549 cells
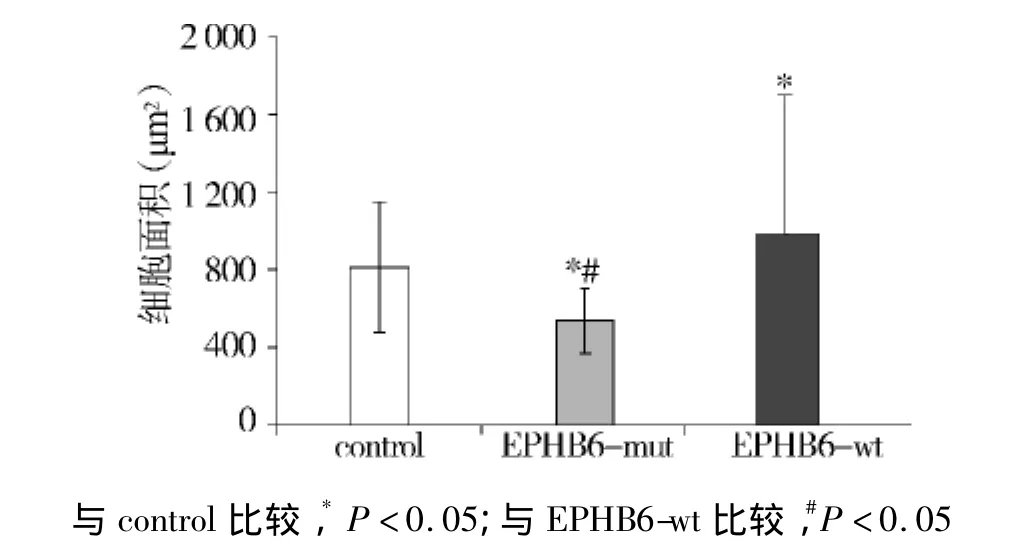
图5 突变型EPHB6对细胞大小的影响Figure 5 Effects of mutant EPHB6 on the size of A549 cells
3 讨论
EPH作为受体型酪氨酸蛋白激酶中最大的一个亚家族,其突变在肿瘤当中的发生比较频繁。EPHB6 的体突变位点以往在结直肠癌[25,26]、肺癌[27]、卵巢癌[28]和神经胶质瘤[26]中以往都有报道,但突变的功能不明。一项大样本的测序研究发现肺腺癌中有10种EPH基因发生了突变[27]。由于EPH相关细胞信号网络的复杂性,对于EPH突变的功能性作用及其后果还知之甚少,尤其缺少直接的实验证据[29]。
我们以前的研究筛查了80例NSCLC患者和3例NSCLC细胞系,首次发现了3个未见报道的EPHB6突变位点[22]。其中,缺失突变 del915-917位于EPHB6酪氨酸激酶结构域与SAM结构域之间。在结直肠癌中也报道此区域有EPHB6的突变发生[25,26]。这些研究均提示,该区域可能与肿瘤的发生、发展密切相关。本研究通过细胞水平实验发现:EPHB6突变使NSCLC细胞跨膜迁移能力和划痕愈合能力均显著增强,表明 EPHB6突变促进NSCLC细胞迁移。该结果首次明确了EPHB6缺失突变del915-917在NSCLC转移中的功能,且证实该突变位点所在的区域确实与肿瘤转移有密切关系,这可能成为NSCLC诊断和治疗的新靶点。
另外,本研究显示 EPHB6突变不但造成EPHB6原有的肿瘤转移抑制效应消失,更重要的是其突变体具有促发肿瘤细胞转移的作用。其中一种可能的机制为突变体通过“显性失活”的方式对野生型EPHB6产生抑制效应。另外,突变体还可能激活促细胞迁移的信号通路及其网络,但这需要进一步的实验验证。
总之,NSCLC中多发EPHB6突变,并且EPHB6突变会促进NSCLC细胞迁移。这可能归因于突变导致的EPHB6原有抗转移功能的缺失,也可能是突变体具有新的促转移功能,其确切机制还有待于进一步研究。
[1]Jemal A,Siegel R,Xu J,et al.Cancer Statistics[J].Ca Cancer J Clin,2010,60(5):277-300.
[2]van Zandwijk N,Mooi WJ,Rodenhuis S.Prognostic factors in NSCLC.Recent experiences[J].Lung Cancer,1995,12(Suppl 1):S27-S33.
[3]Ansari J,Palmer DH,Rea DW,et al.Role of tyrosine kinase inhibitors in lung cancer[J].Anticancer Agents Med Chem,2009,9(5):569-575.
[4]Santos ES,Blaya M,Raez LE.Gene expression profiling and nonsmall-cell lung cancer:where are we now[J].Clin Lung Cancer,2009,10(3):168-173.
[5]Heist RS,Christiani D.EGFR-targeted therapies in lung cancer:predictors of response and toxicity[J].Pharmacogenomics,2009,10(1):59-68.
[6]Menzel P,Valencia F,Godement P,et al.Ephrin-A6,a new ligand for EphA receptors in the developing visual system[J].Dev Biol,2001,230(1):74-88.
[7]Eph Nomenclature Committee.Unified nomenclature for Eph family receptors and their ligands,the ephrins[J].Cell,1997,90(3):403-404.
[8]Castaño J,Davalos V,Schwartz S Jr,et al.EPH receptors in cancer[J].Histol Histopathol,2008,23(8):1011-1123.
[9]Campbell TN,Robbins SM.The Eph receptor/ephrin system:an emerging player in the invasion game[J].Curr Issues Mol Biol,2008,10(1-2):61-66.
[10]Tang XX,Evans AE,Zhao H,et al.Association among EPHB2,TrkA,and MYCN expression in low-stage neuroblastomas[J].Med Pediatr Oncol,2001,36(1):80-82.
[11]Tang XX,Evans AE,Zhao H,et al.High-level expression of EPHB6,EFNB2,and EFNB3 is associated with low tumor stage and high TrkA expression in human neuroblastomas[J].Clin Cancer Res,1999,5(6):1491-1496.
[12]Tang XX,Zhao H,Robinson ME,et al.Prognostic significance of EPHB6,EFNB2,and EFNB3 expressions in neuroblastoma[J].Med Pediatr Oncol,2000,35(6):656-658.
[13]Fox BP,Kandpal RP.Invasiveness of breast carcinoma cells and transcript profile:Eph receptors and ephrin ligands as molecular markers of potential diagnostic and prognostic application[J].Biochem Biophys Res Commun,2004,318(4):882-892.
[14]Fox BP,Kandpal RP.Transcriptional silencing of EphB6 receptor tyrosine kinase in invasive breast carcinoma cells and detection of methylated promoter by methylation specific PCR[J].Biochem Biophys Res Commun,2006,340(1):268-276.
[15]Hafner C,Bataille F,Meyer S,et al.Loss of EphB6 expression in metastatic melanoma[J].Int J Oncol,2003,23(6):1553-1559.
[16]Hafner C,Schmitz G,Meyer S,et al.Differential gene expression of Eph receptors and ephrins in benign human tissues and cancers[J].Clin Chem,2004,50(3):490-499.
[17]Fox BP,Kandpal RP.EphB6 receptor significantly alters invasiveness and other phenotypic characteristics of human breast carcinoma cells[J].Oncogene,2009,28(14):1706-1713.
[18]Truitt L,Freywald T,DeCoteau J,et al.The EphB6 receptor cooperates with c-cbl to regulate the behavior of breast cancer cells[J].Cancer Res,2010,70(3):1141-1153.
[19]Matsuoka H,Obama H,Kelly ML,et al.Biphasic functions of the kinase-defective Ephb6 receptor in cell adhesion and migration[J].J Biol Chem,2005,280(32):29355-29363.
[20]Müller-Tidow C,Diederichs S,Bulk E,et al.Identification of metastasis-associated receptor tyrosine kinases in non-small cell lung cancer[J].Cancer Res,2005,65(5):1778-1782.
[21]Yu J,Bulk E,Ji P,et al.The EPHB6 receptor tyrosine kinase is a metastasis suppressor that is frequently silenced by promoter DNA hypermethylation in non-small cell lung cancer[J].Clin Cancer Res,2010,16(8):2275-2283.
[22]于军,铁茹,赵鸽,等.非小细胞肺癌中EPHB6基因突变的筛选和功能预测[J].山西医科大学学报,2014,45(7):557-560.
[23]Schwäble J,Choudhary C,Thiede C,et al.RGS2 is an important target gene of Flt3-ITD mutations in AML and functions in myeloid differentiation and leukemic transformation[J].Blood,2005,105(5):2107-2114.
[24]Nechyporuk-Zloy V,Dieterich P,Oberleithner H,et al.Dynamics of single potassium channel proteins in the plasma membrane of migrating cells[J].Am J Physiol Cell Physiol,2008,294(4):C1096-C1102.
[25]Gylfe AE,Sirkiä J,Ahlsten M,et al.Somatic mutations and germline sequence variants in patients with familial colorectal cancer[J].Int J Cancer,2010,127(12):2974-2980.
[26]Balakrishnan A,Bleeker FE,Lamba S,et al.Novel somatic and germline mutations in cancer candidate genes in glioblastoma,melanoma,and pancreatic carcinoma[J].Cancer Res,2007,67(8):3545-3550.
[27]Ding L,Getz G,Wheeler DA,et al.Somatic mutations affect key pathways in lung adenocarcinoma[J].Nature,2008,455(7216):1069-1075.
[28]Greenman C,Stephens P,Smith R,et al.Patterns of somatic mutation in human cancer genomes[J].Nature,2007,446(7132):153-158.
[29]Pasquale EB.Eph receptors and ephrins in cancer:bidirectional signaling and beyond[J].Nat Rev Cancer,2010,10(3):165-180.
