速激肽受体1基因启动子近端E盒点突变对下游基因调控的影响
2015-12-16陈玲群王练红怀化市第二人民医院检验科怀化48000湖南医药学院检验系
陈玲群,王练红,周 金,王 林(怀化市第二人民医院检验科,怀化 48000;湖南医药学院检验系)
速激肽受体(neutokinin receptor,NKR1-3)属于G蛋白偶联跨膜受体家族,主要表达在中枢神经细胞、骨髓基质和乳腺细胞等组织[1],其中NK1R基因转录成两种mRNA,分别翻译成全长型(NK1R-Fl)和截断型(NK1R-Tr)受体,两型受体翻译起始点一样,mRNA前1 520 nt序列相同,二者所不同的是表达产物C端不一样,而C末端在细胞内,不同的C末端直接造成了两类受体截然不同的信号传导通路[2]。NK1R受体基因转录起始点上游调控区存在E盒结构。我们初步对NK1R基因转录起始点上游近段E盒结构进行点突变,通过荧光素酶报告基因载体[3],研究E盒结构的突变是否会影响下游基因的表达。
1 材料和方法
1.1 材料
胎牛血清(Fetal bovine serum.FBS)与 DMEM/F12培养液购自美国Hyclone公司;胰酶消化液购自北京天润善达生物制品有限公司;Promega限制性核酸内切酶:mluⅠ、HxoⅠ,LB 液体培养基(pH7.4)与动物组织/细胞基因组DNA提取试剂盒(D1700)购自北京索莱宝科技有限公司;Biospin胶回收试剂盒BSC02M1、去内毒素质粒提取试剂盒(QIAGEN)、Roche FuGene转染试剂、双荧光素酶检测试剂盒、PGL4.74 hluc内参质粒购自 Promega公司;PGL3-basic荧光素酶报告基因载体系列;HBL-100、MCF-7细胞系来自湖南医药学院。
1.2 克隆含近端E盒结构启动子
1.2.1 野生型NK1R启动子的克隆 定位近端E盒“CACATG”结构位点,根据近端E盒位置利用Primer Premier 5.0和Oligo 6.0设计引物,扩增含一个近端E盒结构的DNA序列。
HBL-100细胞用含100 ml/L胎牛血清的DMEM,置于37℃、50 ml/L CO2细胞培养箱中培养,提取基因组DNA,作为扩增模板。巢式PCR扩增目的DNA片段,外向引物(nkw1上游引物:CAGGATTCTGGAGCTTCGTAT,nkw1下游引物:CTACCGTTTGAAATGGTCTTG)。扩增程序:94℃预变性120 s,然后以94℃ 30 s,52℃ 复性30 s,68℃ 延伸70 s进行35个循环,68℃ 延伸10 min,4℃保存。以外向扩增产物为模板,用内向引物(NK1R上游引物:CGCCCTCGAGAGTTTCGCGGGCACCTCT,NK1R下游引物:AGCCACGCGTCTGAGCGACAAGCTGCCTA)扩增,具体程序同前,延伸时间设为60 s。对第二轮PCR产物纯化回收,得到NK1R野生型启动子,产物长度为827 bp。
1.2.2 重叠延伸PCR对NK1R启动子近端E盒点突变 将巢式PCR产物纯化回收后作为模板,进行重叠延伸PCR,引入点突变CACAT G→CACAC G。第 一 轮 PCR 用 p1,p2引 物(p1:CGCCCTCGAGAGTTTCGCGGG CACCTCT,p2:CATCGCCCCCACACACGACCGTTTCCCATTG)扩增短片段,p3,p4 引物 (p3:CAATGGGAAACGGTCGTGTGTGGGGGCGATG,p4:CACAACGCGTACCTCTTGTGCAGCCGCTCTA)扩增长片段;完成扩增后,纯化回收。第二轮PCR:把纯化后的长、短片段放到同一个反应管中,相互作为模板和引物,反应4个循环。第三轮PCR:以第二轮全长PCR产物为模板进行扩增,用p1,p4引物,即扩增出带有点突变的启动子。将PCR最后产物电泳,纯化回收。
1.2.3 野生型和突变型荧光素酶报告基因构建把纯化的野生型和突变型NK1R启动子PCR产物以及PGL3-basic分别进行mluⅠ和HxoⅠ双酶切,酶切产物用1%琼脂糖凝胶电泳,切胶纯化回收。然后用T4 Ligase对PGL3-basic分别与NK1R野生型和突变型启动子进行连接,连接反应体系为:T4 Ligase(Trans)3.5 μl,NK1R 8 μl,ddH2O 7 μl,5 ×buffer(Trans)5 μl,PGL3-basic 6 μl,16 ℃ 连接过夜,另设PGL3-basic自连反应体系,确保酶切后的PGL3-basic不自连。转化感受态细菌DH5α,用灭菌玻璃棒把连接产物转化的菌液均匀涂布到100 μg/ml氨苄青霉素LB固体培养基上,37℃培养12-16 h。每个平板挑取4个菌落,分别置入100 μg/ml氨苄青霉素LB液体培养基培养过夜。每支LB菌液取1 ml送北京奥科生物公司测序,序列比对合格的菌落再进行培养。提取去内毒素质粒。用测序和XhoⅠ/mluⅠ 双酶切电泳对启动子片段进行鉴定,测得浓度为 360 μg/ml,A260/280=1.847。
1.3 双荧光素酶检测试剂检测启动子活性
复苏MCF-7乳腺癌细胞,为了确保细胞良好状态接受转染,从复苏到细胞转染至少传至两代。设定MCF-7组,MCF-7-NK1R野生组,MCF-7-NK1R突变组;质粒为 PGL3-basic-NK1R+PGL4.74 hluc,PGL4.74 hluc作为内参加入到所有试验组,PGL3-basic空载体转染 MCF-7作为对照,PGL3-basic-NK1R野生型转染野生组,PGL3-basic-NK1R突变型转染突变组。把消化后的细胞转移至96孔板,每组5孔,细胞培养至70%-80%融合时即开始转染。转染前2 h,把每孔培养基调节至100 μl。FuGene Reagent和质粒DNA平衡至室温,用前混匀。吸取85 μl Opti-MEM1 Reduced Serum Medium 至各个稀释孔中,按质粒(μg):FuGene Reagent(μl)=2∶7 的比例配制质粒DNA(包括内参质粒)和FuGene Reagent混合物,室温放置15 min。每孔加7 μl FuGene Reagent和质粒DNA混合物,培养板水平充分混匀后置入细胞培养箱培养。转染后培养30 h检测荧光素酶表达情况。检测试剂Dual-Glo Luciferase Buffer与Luciferase Substrate混匀;Stop Glo Substrate与Stop Glo Buffer按1∶100混合混匀。检测前把待测细胞孔内的培养基调至75 μl,平衡至室温,每孔加 75 μl Dual-Glo Luciferase Buffer& Luciferase Substrate混合液,混匀后室温静置10 min,检测OD值,作为数据1。每孔再加75 μl Stop Glo Substrate&Stop Glo Buffer混合液,混匀后室温静置10 min,检测OD值,作为数据2。数据整理按以下公式(Rate表示相对荧光素酶活性):

1.4 数据分析
采用SPSS 15.0软件进行统计学分析,比率值采用非参数检验(Mann-Whitney U),以P<0.05为有差异统计学意义。
2 结果
2.1 各类荧光素酶报告基因载体酶切电泳和测序图
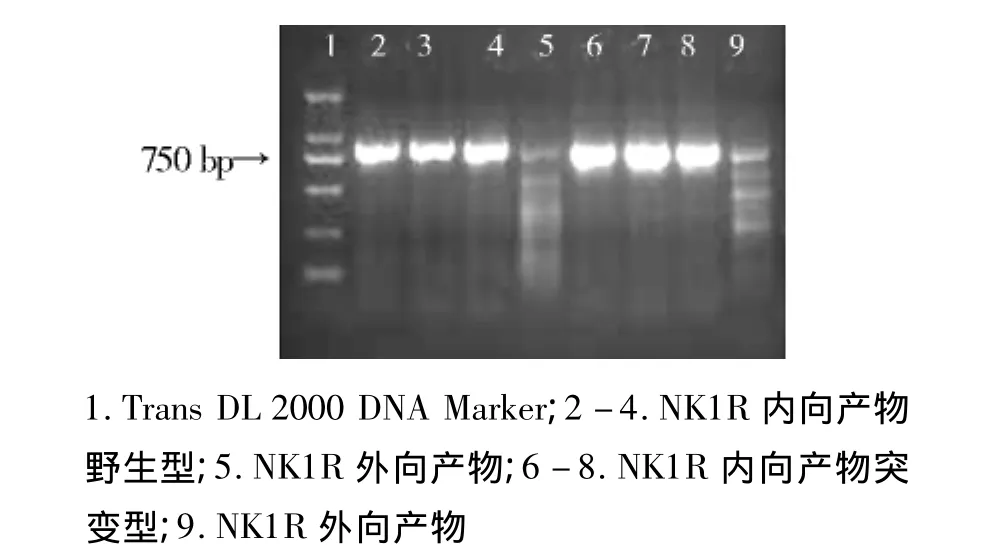
图1 NK1R巢式PCR扩增启动子电泳图Figure 1 NK1R promoters amplified by nested PCR
各类PCR扩增产物和质粒通过1%琼脂糖凝胶电泳,各条带均出现在目的位置(见图1);各类载体及PCR纯化产物A260/280均在1.8-2.0。野生型和突变型荧光素酶报告基因载体构建完成后,经测序和酶切鉴定显示两类载体构建成功(见图2 -4)。
2.2 荧光素酶活性检测
PGL3野生型组和PGL3突变型组荧光素酶相对活性明显高于PGL3-basic组(P<0.01);PGL3突变型组低于PGL3野生型组(P<0.05,见表1)。结果 说明克隆的NK1R基因部分启动子DNA序列能够启动下游基因表达,E-box序列点突变能够影响该DNA序列的转录活性。
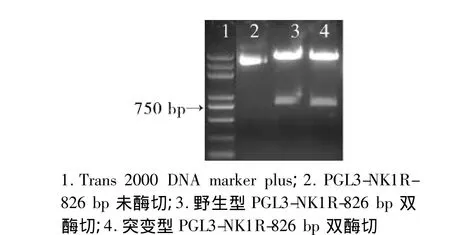
图2 NK1R荧光素酶报告基因载体酶切Figure 2 NK1R luciferase report gene vectors digested by restriction enzyme
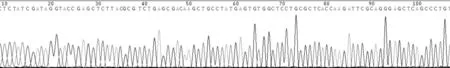
图3 PGL3-basic-NK1R 826 bp荧光素酶报告基因载体部分序列Figure 3 The partial sequences of PGL3-basic-NK1R 826 bp luciferase report gene vector
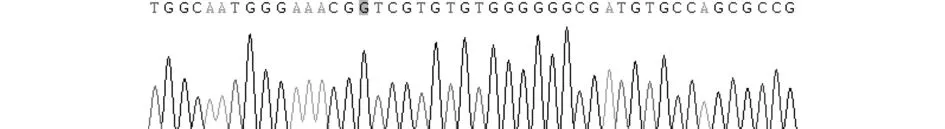
图4 点突变型NK1R荧光素酶报告基因载体测序Figure 4 The partial sequences of pGL3-basic-NK1R promoter point-mutated luciferase report gene vector
表1 野生型和突变型报告基因载体相对荧光素酶活性(±s)Table 1 The luciferase activity of wild and mutated report gene vectors(±s)

表1 野生型和突变型报告基因载体相对荧光素酶活性(±s)Table 1 The luciferase activity of wild and mutated report gene vectors(±s)
组别 相对荧光素活性PGL3空载组0.38 ±0.05 PGL3 野生型组 0.75 ±0.05 PGL3突变型组0.60 ±0.07
3 讨论
在正常乳腺细胞膜提取物中,NK1R-Tr水平非常低,有时甚至难以检出,有研究表明,乳腺癌细胞P物质过量表达,导致了NK1R-Tr表达水平也上调,具体的中间过程,有可能P物质直接作用,也有可能P物质通过其他细胞因子激活NK1R-Fl表达,总之P物质和NK1R,尤其是NK1R-Tr在乳腺上皮细胞共同高水平表达,暗示细胞恶变[4-6]。通过对NK1R转录起始上游序列的分析,发现有几处E盒结构,鉴于转录起始点上游第一和第二个E盒相距较远,我们选择性克隆了只含第一个E盒结构的DNA序列,片段大小为826 bp,通过对E盒第5个碱基T置换为C,我们发现含突变E盒的DNA序列对下游荧光素酶基因的转录活性有所下降,我们的研究揭示近段第一个E盒结构的完整对下游基因的转录活性有一定的影响。
[1]岳发贵,孙薇,梁迪,等.神经激肽1受体拮抗剂研究进展[J].国际药学研究杂志,2010,37(3):203-208.
[2]周云丽,姚智.P物质及其受体的研究进展[J].国际免疫学杂志,2011,34(3):190-194.
[3]薛秀花,黄晨西.荧光素酶基因的研究进展[J].生物学通报,2013,48(9):1-4.
[4]周云丽,付正,李金萍,等.P物质及其受体在乳腺癌中的表达和临床意义[J].中华微生物学和免疫学杂志,2014,34(11):874-880.
[5]Singh D,Joshi DD,Hameed M,et al.Increased expression of preprotachykinin-I and neurokinin receptors in human breast cancer cells:Implications for bone marrow metastasis[J].Proc Natl Acad Sci USA,2000,97(1):388-393.
[6]Bandari PS,Qian J,Oh HS,et al.Crosstalk between neurokinin receptors is relevant to hematopoietic regulation:cloning and characterization of neurokinin-2 promoter[J].J Neuroimmunol,2003,138(1-2):65-75.
