活性开环移位聚合在制备功能大分子中的应用
2015-12-16张延武
李 凯,徐 梵,冯 露,张延武
郑州大学化工与能源学院,河南 郑州 450001
活性开环移位聚合在制备功能大分子中的应用
李 凯,徐 梵,冯 露,张延武
郑州大学化工与能源学院,河南 郑州 450001
首先介绍了活性开环移位聚合的机理、特点和 Grubbs催化剂的发展,然后综述了近年来活性开环移位聚合在功能均聚物及共聚物合成中的应用,以及使用该方法合成的功能聚合物在材料、能源、生物和医疗等领域的应用,最后指出了开环移位聚合所面临的主要挑战。
活性聚合 开环移位聚合 功能大分子 降冰片烯
开环移位聚合(Ring-Opening Metathesis Polymerization,ROMP)是指环状烯烃在特定催化剂作用下,分子中的双键发生开裂,然后以头尾相接的方式生成主链上带有双键的不饱和聚合物的聚合过程[1],该法具有聚合物分子量分布较窄,聚合物的端基、组成、结构和分子量都可控的优点,并且聚合后主链上仍含有不饱和的双键,可与其他聚合方法相结合,进一步对聚合物进行功能化修饰。移位过程的反应机理及过渡产物的明确带动了人们对催化剂的研究,促进了活性ROMP的发展[2]。特别是Schrock等[3]合成的结构明确且稳定高效的催化剂,使这种聚合反应可以在常温常压等温和条件下进行,给该方法增添了新的活力。
功能高分子是指其主链上或侧链上具有某种功能的基团,具有某种特定功能(如化学活性、光敏性、导电性、催化活性、生物相容性、药理性能和选择分离性能等)的一类高分子。其功能性的显示往往是很复杂的,不仅取决于高分子链的化学结构、结构单元的顺序、分子量及其分布、支化和立体结构等一级结构,还取决于高分子链的构象以及高分子链在聚集时的高级结构等。
虽然传统的自由基聚合和离子聚合也可用于功能大分子的制备,但传统的自由基聚合分子量分布的可控性较差,离子聚合操作条件较为苛刻,适用的单体种类较少,通常还需要先对官能团进行保护,因此,与自由基聚合和离子聚合相比,开环移位聚合更适合制备功能大分子。本工作分别对近年来活性开环移位聚合在功能均聚物及共聚物合成中的应用进行了简要综述。
1 开环移位聚合的反应机理及特点
ROMP的一般机理如图1所示。过渡金属亚烷基化合物与环烯烃的双键进行配位,形成了金属环丁烷过渡态,进一步断裂生成聚合物增长链,随后单体不断插入,聚合物链继续增长,直到单体完全消耗完全,聚合过程终止。聚合过程中的副反应主要是分子内链转移和分子间链转移(又称链回咬),严重影响着聚合的“活性”行为,导致一些聚合物链失活,增大了分子量分布[4]。
与其他开环聚合一样,ROMP反应的驱动力来自环张力的释放。环丁烯和降冰片烯的环张力大于63 kJ/mol,是进行ROMP反应的理想单体。环张力稍低的环戊烯、环辛烯和双环戊二烯也可以进行ROMP反应,但环己烯是个例外,它的环张力很小,没有足够的焓变进行ROMP反应[5]。

图1 ROMP一般机理Fig.1 A general mechanism of ROMP
2 Grubbs催化剂
早期的 ROMP催化剂由两种或者多种组分构成,虽然容易制备,但是结构不明确,使活性中心位置难以判断,给机理研究造成困难,且不能进行活性聚合[7-11]。科学家们对催化机理进行详细研究后提出了金属卡宾的概念,促进了卡宾型催化剂的发展,主要分为Ti,Ta,W,Mo和Ru几种类型。其中,Schrock[12-14]合成的Mo系催化剂和Grubbs[15]合成的Ru系催化剂已经商业化,为实用催化剂的开发做出了重要贡献。Schrock催化剂的显著特点是其具有很高的活性和立构选择性,但是这种催化剂所要求的反应条件较为苛刻,对水和氧非常敏感,且官能团耐受性差,限制了其广泛应用。而Grubbs催化剂的官能团耐受性强,在空气和湿气中具有良好的稳定性,并且在常温常压下即可反应,为其大规模工业应用提供了基础。
1992年,Grubbs合成了结构明确的单组分Ru催化剂(PPh3)2Cl2Ru=CH-CH=CPh2,如图2(a)所示,并将其成功地应用于降冰片烯的ROMP反应中[16,17]。通过进一步的研究,Grubbs在1996年得到了活性更高的催化剂(PCy3)2Cl2Ru=CHPh,称为Grubbs一代催化剂,如图2(b),其用量可低至0.01%(摩尔分数)且具有良好热稳定性[18-20]。在以上研究的基础上,Grubbs基于膦配体在解离移位过程中的关键,采用具有更强给电子能力和稳定性的 N-杂环卡宾(NHC)取代一个膦配体,制得了二代催化剂(IMesH2)(PCy3)(Cl)2Ru=CHPh,如图2(c)[21-23],该催化剂在保留一代催化剂稳定性的同时,具有更高反应活性和功能基团耐受性,特别适用于那些低环张力的烯烃以及位阻较大的多取代烯烃的ROMP反应[24]。2001年,Grubbs三代催化剂面世,如图2(d),这种催化剂活性更高,链引发速率很快,适用单体范围广,所得聚合物分散指数(PDI)较小,大都在 1.1以下[25-30]。值得注意的是,使用此催化剂时,需要在-20 ℃下进行反应以抑制副反应的发生。

图2 Grubbs催化剂Fig.2 Grubbs catalysts
3 活性开环移位聚合制备功能聚合物
活性聚合的分子量随转化率线性增加,分子量分布较窄,聚合物的端基、组成、结构和分子量都可以控制,尤其适合制备功能大分子。与活性自由基聚合,如氮氧稳定自由基聚合(NMP)、原子转移自由基聚合(ATRP)和可逆加成-断裂链转移自由基(RAFT)聚合相比,活性ROMP有以下显著优势:首先,聚合后主链上仍含有不饱和的双键,可与其他聚合方法相结合,可进一步对聚合物进行功能化修饰[31];其次,Grubbs催化剂可使活性ROMP在常温常压等温和条件下进行,且链引发和增长速率快,反应时间短;与Schrock催化剂相比,Grubbs催化剂对官能团的耐受性强,适合含有N,O,Si和S等杂原子单体的聚合[32-34]。以下针对ROMP在功能均聚物和共聚物合成中的应用分别进行综述。
3.1 功能均聚物
用活性ROMP制备功能性均聚物时存在两种情况:一是单体上只有一个可以进行移位的双键,那么此单体开环后就会以头尾相接的方式形成直链聚合物;二是单体上有多个可以进行移位的双键,此类单体聚合后就会形成三维网状结构。在这两种情况中,比较具有代表性的分别是降冰片烯(NBE)和双环戊二烯(DCPD)。冰片烯单元的环张力比环戊烯单元大,因此更易进行移位反应,进行ROMP的单体多为降冰片烯的衍生物。利用不同的侧基,可合成具有光、电和生物等特性的功能均聚物。
Allcock等[35]通过降冰片烯环上引入含磷聚乙二醇侧基,制备了一种玻璃化转变温度低至-96 ℃凝胶电解质(图 3),由于每个单体由双键连接,主链上存在的大量双键使得聚合物链具有较强的刚性,电子离域程度大,因此其作为电解质具有良好的力学性能和导电性。另外由于侧基上的环三磷腈官能团,使其具有耐高温的特性,而磷元素作为阻燃元素赋予该聚合物一定程度的阻燃效应。Manning等[36]将含糖侧基的降冰片烯进行ROMP,制备了具有生物相容性均聚物(图4),并用GlyCAM-1力场模拟其在细胞表面的聚集行为。Sattigeri等[37]首先合成了侧链包含有机发色团的降冰片烯单体,然后聚合得到了具有二阶非线性光学性质的间规立构聚合物,证实了以刚性较强的降冰片烯为主链可以提高光学聚合物的非线性。

图3 含磷侧基均聚物Fig.3 Homopolymer of norbornene with side group containing P

图4 含糖侧基均聚物Fig.4 Homopolymer of norbornene with side group containing sugar
Slugovc等[38]分别用第一代(G1)和第二代(G2)Grubbs引发剂进行侧链含腈基的液晶化合物的ROMP反应,化合物结果如图5(a)所示,由于腈基和引发剂钌中心的强配位作用造成引发剂失活,G1不能使含腈化合物进行ROMP反应,G2的引发效率也大幅降低,仅能得到PDI大于2的侧链液晶聚合物。当腈基被相邻基团屏蔽时,如图5(b)所示双官能团降冰片烯衍生物,G2引发此单体的ROMP反应,收率可达90%,由此得到了具有立构选择性的双官能团功能聚合物[39,40]。

图5 含腈基降冰片烯衍生物Fig.5 Norbornene derivatives containing nitrile group
3.2 功能共聚物
两种或者多种单体进行活性 ROMP反应,有时也与其他聚合方法联用,可根据单体的类型、单体与引发剂的比以及引发剂的不同得到嵌段、梳型或者星型共聚物。
采用活性ROMP反应制备的嵌段共聚物可用于能源和生物工程领域。Bullock等[41]用G2引发3种功能单体进行嵌段共聚,得到一种本身具有阳极、电解质和阴极的三嵌段共聚物,如图6所示。其中,含金属钴的第一嵌段是阳极,不饱和的聚醚作为第二嵌段是电解质,可以吸收金属盐的第三嵌段是阴极。Gibbs等[42]分别合成了侧链为低核苷酸的降冰片烯单体和侧链含二茂铁的降冰片烯单体,在G1引发下进行嵌段共聚,得到双嵌段共聚物(图7)和三嵌段共聚物,共聚物与DNA进行耦合可得到聚合物-DNA杂化材料,此材料可作为电化学探针用来检测DNA。Yang等[43]先用降冰片烯二醇与ε-己内酯反应,在异辛酸亚锡催化下,ε-己内酯进行开环聚合,得到侧链含有聚 ε-己内酯的降冰片烯单体,然后与含一个腈基的降冰片烯进行嵌段共聚,得到一种具有形状记忆功能的新型材料(图8)。

图6 多功能三嵌段共聚物Fig.6 Multi-functional triblock copolymers

图7 含茂铁嵌段共聚物Fig.7 Block copolymer containing ferrocene

图8 含腈基嵌段共聚物Fig.8 Block copolymer containing nitrile group
梳型共聚物由于分子结构规整,显示良好的结晶性,在超强纤维、光学透镜、高强度膜分离材料及透明涂层等方面有重要用途。Feast等[44,45]先进行活性阴离子聚合得到具有活性的聚苯乙烯增长链,再用环氧丙烷封端获得支链,最后与 5-降冰片烯-2,3-二酰氯反应,将聚苯乙烯链接枝到降冰片烯上获得大分子单体,进而通过活性ROMP即得梳型共聚物。由于每个聚合物链的“梳柄”和“梳齿”几乎等长,其PDI值仅为1.09。此共聚物每个重复单元上有两个支链,“梳齿”较密集,若是将聚苯乙烯侧链与5-降冰片烯-2-酰氯反应,就可得到单侧链的降冰片烯单体,从而得到“齿距”较宽的梳型共聚物[46]。梳型共聚物由于“梳齿”可设计,自组装性能良好,在药物递送领域也有较广应用。Thanh-Huyen等[47]将胆固醇和聚乙二醇接到片烯上获得大分子单体(图 9),进行活性ROMP,得到的两亲性梳型共聚物自组装形成纳米胶囊,用来封装抗癌药阿霉素,取得了较高载药量。

图9 药物递送梳型共聚物Fig.9 Brush-like block copolymers for drug delivery
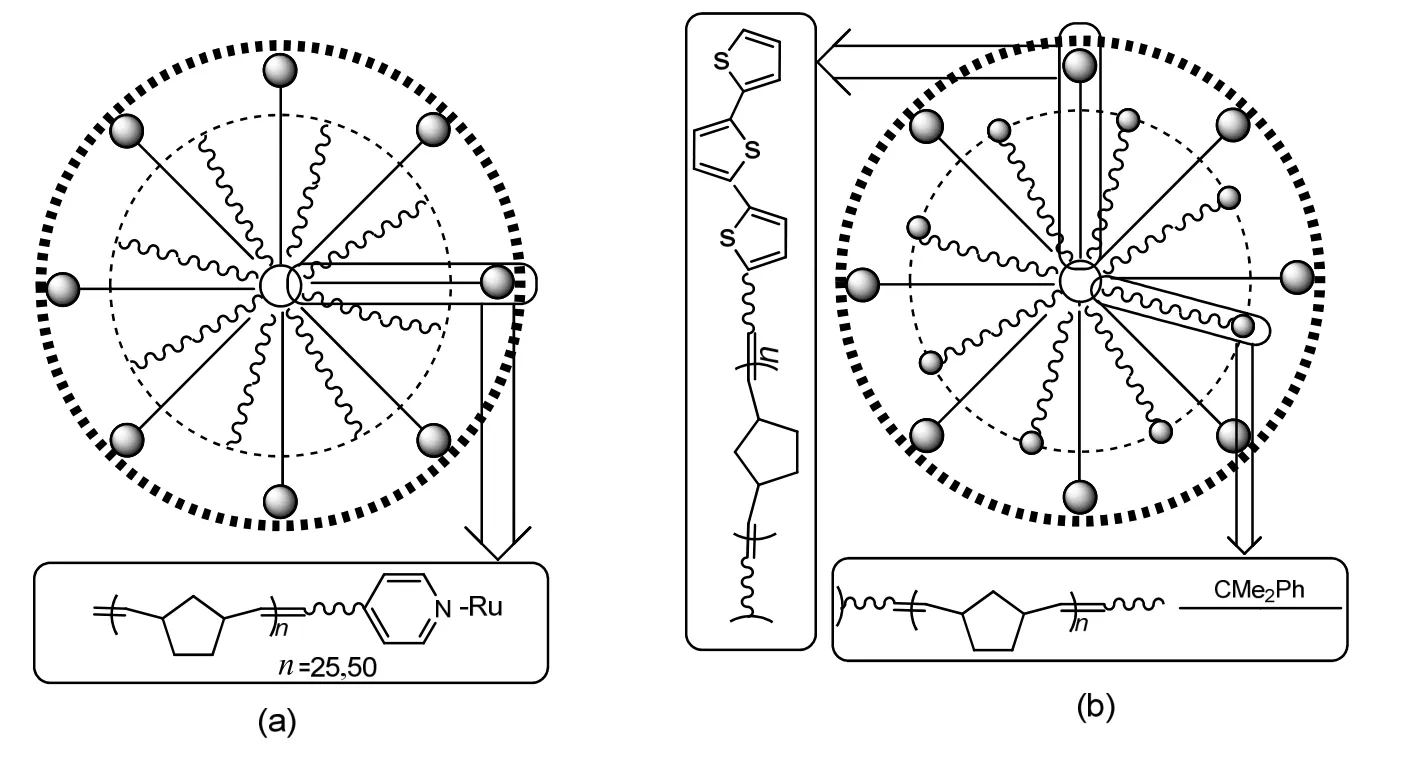
图10 两种星型共聚物Fig.10 Two star-shaped copolymers
星型共聚物是一种带有多长支链的聚合物,有一个中心,支链从此中心出发,向四面八方展开。其物理交联区域密度大,耐热性和弹性模量较高,具有良好的机械强度,并且因为它不用化学交联,制品可以回收利用,常用作热塑性弹性体和硬塑料等。ROMP常与其他方法连用来制备星型共聚物。Nomura等[48]通过ROMP制备链端具有吡啶配合基的降冰片烯聚合物,再通过先核后臂法形成星型聚合物,如图10(a),这种方法使制备催化剂能够恢复和再利用,并且不降低活性与选择性。Takamizu等[49]运用向已通过 ROMP形成的聚合物链中加入降冰片烯衍生物单体的方法,使之交联,制备了支臂末端为低聚噻吩的功能星型共聚物,如图 10(b),由于分子内能量转移,此聚合物具有独特的发光性能,通过调节支臂末端的官能团,可以将蓝光发射变为白光发射。
4 结 论
ROMP作为一种非自由基聚合方法,具有聚合物分子量分布较窄,聚合物的端基、组成、结构和分子量都可控的优点,尤其适合于制备序列结构可控或主链含不饱和键的功能聚合物,并且聚合后主链上仍含有不饱和的双键,可与其他聚合方法相结合,进一步对聚合物进行功能化修饰。随着引发剂的不断完善及商业化,此法在单体选择方面也越来越广。其面临的主要挑战为引发剂合成困难,成本较高,不利于商业化;单体的选择存在一定局限性;同时也和其他活性聚合方法一样,引发剂的利用率较低;引发剂的回收和再利用成为活性 ROMP工业化应用的关键。在今后的研究过程中,引发剂耐水耐氧及其回收再利用将依然是研究热点。同时,ROMP与其他活性聚合方法相结合制备功能化大分子的领域也将越来越受到关注。
[1]Baughman T W, Wagener K B. Recent advances in ADMET polymerization[M]// Buchmeiser M R, eds. Advances in Polymer Science: Metathesis Polymerization. Berlin: Springer Berlin Heidelberg, 2005: 1-42.
[2]Grubbs R H. Olefin-metathesis catalysts for the preparation of molecules and materials(Nobel lecture)[J]. Angewandte Chemie International Edition, 2006, 45(23): 3760-3765.
[3]Bielawski S W, Grubbs R H. Living ring-opening metathesis polymerization[J]. Progress in Polymer Science, 2007, 32(1): 1-29.
[4]Buchmeiser M R. Heterogeneous C-C coupling and polymerization catalysts prepared by ROMP[J]. Bioorganic & Medicinal Chemistry Letters, 2002, 12(14): 1837-1840.
[5]Grubbs R H. Handbook of metathesis[M]. Morlenbach: Strauss Offsetdru ck GmbH, 2003: 1-23.
[6]Sidney W B ,Cruickshank F, Golden D, et al. Additivity rules for the estimation of thermochemical properties[J]. Chemical Reviews, 1969, 69(3): 279-324.
[7]Scholl M, Ding S, Lee C W, et al. Synthesis and activity of a new generation of ruthenium-based olefin metathesis catalysts coordinated with 1,3-dimesityl-4,5-dihydroimidazol-2-ylidene ligands[J]. Organic Letters, 1999, 1(6): 953-956.
[8]Dimonie M, Coca S, Teodorescu M, et al. Stereoselectivity of cycloolefin polymerization with WCl6-based catalytic systems[J]. Journal of Molecular Catalysis, 1994, 90(1/2): 117-124.
[9]Cho I, Moon G S. Ring-opening metathesis polymerization of 9-phenyl-1,5-cyclododecadiene[J]. Journal of Polymer Science Part A: Polymer Chemistry, 1995, 33(11): 1823-1828.
[10]Ivin K J, Reddy B S, Rooney J J. Role of dioxygen as an activator in olefin metathesis[J]. Journal of the Chemical Society, Chemical Communications, 1981, 20: 1062-1064.
[11]Schrock R R, DePue R, Feldman J, et al. Preparation and reactivity of several alkylidene complexes of the type W (CHR')(N-2,6-C6H3-i-Pr2)(OR)2and related tungstacyclobutane complexes. controlling metathesis activity through the choice of alkoxide ligand[J]. Journal of the American Chemical Society, 1988, 110(5): 1423-1435.
[12]Schrock R R. Recent advances in the chemistry and applications of high oxidation state alkylidene complexes[J]. Pure and Applied Chemistry, 1994, 66(7): 1447-1454.
[13]Schrock R R. The alkoxide ligand in olefin and acetylene metathesis reactions[J]. Polyhedron, 1995, 14(22): 3177-3195.
[14]Schrock R R, Murdzek J S, Bazan G C, et al. Synthesis of molybdenum imido alkylidene complexes and some reactions involving acyclic olefins[J]. Journal of the American Chemical Society, 1990, 112(10): 3875-3886.
[15]Vougioukalakis G C, R H Grubbs. Ruthenium-based heterocyclic carbene-coordinated olefin metathesis catalysts[J]. Chemical Reviews, 2010, 110(3): 1746-1787.
[16]Nguyen S T, Johnson L K, Grubbs R H, et al. Ring-opening metathesis polymerization(ROMP) of norbornene by a group VIII carbene complex in protic media[J]. Journal of the American Chemical Society, 1992, 114(10): 3974-3975.
[17]Wu Z, Benedicto A D, Grubbs R H. Living ring-opening metathesis polymerization of bicyclo[3.2.0]heptene catalyzed by a rutheniumalkylidene complex[J]. Macromolecules, 1993, 26(18): 4975-4977.
[18]Schwab P, Grubbs R H, Ziller J W. Synthesis and applications of RuCl2(CHR')(PR3)2: the influence of the alkylidene moiety on metathesis activity[J]. Journal of the American Chemical Society,1996, 118(1): 100-110.
[19]Trnka T M, Grubbs R H. The development of L2X2Ru=CHR olefin metathesis catalysts: an organometallic success story[J]. Accounts of Chemical Research, 2001, 34(1): 18-29.
[20]Ulman M, Grubbs R H. Ruthenium carbene-based olefin metathesis initiators: catalyst decomposition and longevity[J]. The Journal of Organic Chemistry, 1999, 64(19): 7202-7207.
[21]Scholl M, Trnka T M, Morgan J P, et al. Increased ring closing metathesis activity of ruthenium-based olefin metathesis catalysts coordinated with imidazolin-2-ylidene ligands[J]. Tetrahedron Letters, 1999, 40(12): 2247-2250.
[22]Weskamp T, Kohl F J, Hieringer W, et al. Highly active ruthenium catalysts for olefin metathesis: the synergy of N-heterocyclic carbenes and coordinatively labile ligands[J]. Angewandte Chemie International Edition, 1999, 38(16): 2416-2419.
[23]Huang J, Stevens E D, Nolan S P, et al. Olefin metathesis-active ruthenium complexes bearing a nucleophilic carbene ligand[J]. Journal of the American Chemical Society, 1999, 121(12): 2674-2678.
[24]Schrodi Y, Pederson R L. Evolution and applications of second-generation ruthenium olefin metathesis catalysts[J]. Aldrichimica Acta, 2007, 40(2): 45-52.
[25]Sanford M S, Love J A, Grubbs R H. A versatile precursor for the synthesis of new ruthenium olefin metathesis catalysts[J]. Organometallics, 2001, 20(25): 5314-5318.
[26]Love J A, Morgan J P, Trnka T M, et al. A practical and highly active ruthenium-based catalyst that effects the cross metathesis ofacrylonitrile[J]. Angewandte Chemie International Edition, 2002, 41(21): 4035-4037.
[27]Love J A, Sanford M S, Day M W, et al. Synthesis, structure, and activity of enhanced initiators for olefin metathesis[J]. Journal of the American Chemical Society, 2003, 125(33): 10103-10109.
[28]Slugovc C, Demel S, Stelzer F. Ring opening metathesis polymerisation in donor solvents[J]. Chemical Communications, 2002, 21: 2572-2573.
[29]Frenzel U, Weskamp T, Kohl F J, et al. N-heterocyclic carbenes: application of ruthenium-alkylidene complexes in ring-opening metathesis polymerization[J]. Journal of Organometallic Chemistry, 1999, 586(2): 263-265.
[30]Fürstner A, Ackermann L, Gabor B, et al. Comparative investigation of ruthenium-based metathesis catalysts bearing N-heterocyclic carbene (NHC) ligands[J]. Chemistry-A European Journal, 2001, 7(15): 3236-3253.
[31]Madkour A E, Koch A H, Lienkamp K, et al. End-functionalized ROMP polymers for biomedical applications[J]. Macromolecules, 2010, 43(10): 4557-4561.
[32]Cho H N, Choi S K. Ring-opening polymerization of 2-azabicyclo-[2,2,1]-hept-5-en-3-one using metathesis catalysts[J]. Journal of Polymer Science: Polymer Chemistry, 1985, 23(5): 1469-1475.
[33]Thu C T, Bastelberger T, Höcker H. On the polymerization of 2,3-dihydrofuran with tungsten and chromium carbenes[J]. Die Makromolekulare Chemie, Rapid Communications, 1981, 2(6/7): 383-386.
[34]Feast W J, Harper K. Metathesis polymerisation of some heteropolycyclic alkenes[J]. Journal of Molecular Catalysis, 1985, 28(1): 293-311.
[35]Allcock H R, Laredo W R, Morford R V. Polymer electrolytes derived from polynorbornenes with pendent cyclophosphazenes: poly(ethylene glycol) methyl ether (PEGME) derivatives[J]. Solid State Ionics, 2001, 139(1): 27-36.
[36]Manning D D, Hu X, Beck P, et al. Synthesis of sulfated neoglycopolymers: selective P-selection inhibitors[J]. Journal of the American Chemical Society,1997, 119(13): 3161-3162.
[37]Sattigeri J A, Shiau C W, Hsu C C, et al. Remarkable enhancement of second-order nonlinear optical properties of polynorbornenes having pendant chromophores. use of hyper-Rayleigh scattering to estimate the tacticity of rigid rod polymers[J]. Journal of the American Chemical Society, 1999, 121(7): 1607-1608.
[38]Demel S, Riegler S, Wewerka K, et al. Ruthenium-initiated ROMP of nitrile monomers[J]. Inorganica Chimica Acta, 2003, 345(10): 363-366.
[39]Nishihara Y, Inoue Y, Nakayama Y, et al. Comparative reactivity of exo-and endo-isomers in the Ru-initiated ring-opening metathesis polymerization of doubly functionalized norbornenes with both cyano and ester groups[J]. Macromolecules, 2006, 39(22): 7458-7460.
[40]Nishihara Y, Inoue Y, Itazaki M, et al. Palladium-catalyzed cyanoesterification of norbornenes with cyanoformates via the NC-Pd-COOR (R=Me and Et) intermediate[J]. Organic Letters, 2005, 7(13): 2639-2641.
[41]Bullock S E, Kofinas P. Synthesis of an A/B/C triblock copolymer for battery materials applications[J]. Macromolecules, 2004, 37(5): 1783-1786.
[42]Gibbs J M, Park S J, Anderson D R, et al. Polymer-DNA hybrids as electrochemical probes for the detection of DNA[J]. Journal of the American Chemical Society, 2005, 127(4): 1170-1178.
[43]Yang D, Huang W, Yu J, et al. A novel shape memory polynorbornene functionalized with poly(ε-caprolactone) side chain and cyano group through ring-opening metathesis polymerization[J]. Polymer, 2010, 51(22): 5100-5106.
[44]Feast W, Gibson V, Johnson A, et al. Well-defined graft copolymers via coupled living anionic and living ring opening metathesis polymerisation[J]. Journal of Molecular Catalysis A: Chemical, 1997, 115(1): 37-42.
[45]Feast W, Gibson V, Johnson A, et al. Tailored copolymers via coupled anionic and ring opening metathesis polymerization. synthesis and polymerization of bicyclo[2.2.1]hept-5-ene-2,3-trans-bis(polystyrylcarboxylate)s[J]. Polymer, 1994, 35(16): 3542-3548.
[46]Breunig S, Heroguez V, Gnanou Y, et al. In ring-opening metathesis polymerization of ω-norbornenyl polystyrene macromonomers and characterization of the corresponding structures[J]. Macromolecular Symposia, 1995, 95(1): 151-166.
[47]Thanh-Huyen T, Chi Thanh N, Laura G, et al. Long circulating self-assembled nanoparticles from cholesterol-containing brush-like block copolymers for improved drug delivery to tumors[J]. Biomacromolecules, 2014, 15(11): 4363-4375.
[48]Nomura K, Tanaka K, Fujita S. Use of pyridine-coated star-shaped ROMP polymer as the supporting ligand for ruthenium-catalyzed chemoselective hydrogen transfer reduction of ketones[J]. Organometallics, 2012, 31(14): 5074-5080.
[49]Takamizu K, Nomura K. Synthesis of oligo(thiophene)-coated star-shaped ROMP polymers: unique emission properties by the precise integration of functionality[J]. Journal of the American Chemical Society, 2012, 134(18): 7892-7895.
Application of Ring-Opening Metathesis Polymerization in Synthesis of Functional Macromolecules
Li Kai, Xu Fan, Feng Lu, Zhang Yanwu
School of Chemical Engineering and Energy, Zhengzhou University, Zhengzhou 450001, China
Firstly the mechanism of ring-opening metathesis polymerization(ROMP) and the development of Grubbs catalyst were introduced in this review. Then, the application of ROMP in synthesis of functional homopolymers and copolymers, and the application of these copolymers in the area of material, energy, biology and medical treatment were reviewed. Finally, the challenge of ROMP in future was pointed out.
living polymerization; ring-opening metathesis polymerization; functional macromolecule; norbornene
O643.32;TQ316.3
A
1001—7631 ( 2015 ) 06—0515—07
2015-03-30;
2015-11-06。
李 凯(1989—),男,硕士;张延武(1976—),男,副教授,通讯联系人。E-mail: zhangyanwu@zzu.edu.cn。
国家自然科学基金(50903074)。
