玉米醇溶蛋白膜研究进展
2015-12-16魏东伟刘贵金江燕斌
魏东伟,刘贵金,江燕斌
华南理工大学化学与化工学院,广东 广州 510640
玉米醇溶蛋白膜研究进展
魏东伟,刘贵金,江燕斌
华南理工大学化学与化工学院,广东 广州 510640
介绍了玉米醇溶蛋白(Zein)的组成及结构,总结了Zein膜的制备方法、性能及用途,详述了为满足Zein膜在各种用途中的性能而进行的各种修饰改性,如提高机械性能、增强亲/疏水性、增强隔氧阻水性、增大载药量和载药效率及增强药物控缓释等。今后的工作,将围绕新的制备和复合改性方法、拓展Zein膜的应用领域、复合改性机理的研究及改善Zein膜用于药物控缓释时初期的爆发性释放等方面展开。
玉米醇溶蛋白膜 性能 用途 修饰改性 载药效率 药物控缓释
近年来,石油衍生品塑料包装膜的环境污染问题引起越来越多的关注,研究者开始重视研究由可再生的、生物可降解的和来自农业的天然植物大分子制备的功能膜,主要包括多糖、脂类和蛋白质或多肽功能膜[1,2]。玉米醇溶蛋白(Zein)是湿式玉米淀粉加工的副产物,是主要的谷物储存蛋白,1897年首次被人们所认识[3],并被美国食品及药物管理局定义为无过敏性及安全食品。Zein分子富含硫氨基酸,这些氨基酸可以形成很强的分子二硫键,并和分子之间的疏水键一起构成 Zein成膜特性的分子基础[4]。Zein以其优良的成膜特性,生物可降解性,高温、高湿条件下的良好稳定性及安全性而引起人们的重视[5]。在众多的可食性薄膜中,唯有Zein可在无需添加剂和鞣制剂的条件下制成薄膜,并且具有良好抗菌性[6]、抗氧气和水蒸气透过[7,8]、良好的生物相容性[9]及显著的药物控缓释[10]等特性,因此可用于食品保鲜[11]、包装[12]、制药[13]及组织工程[6]等行业。然而,Zein膜易脆以及较差的表面特性使其应用受到一定程度的限制[4]。近年来,Zein膜的复合改性研究备受关注,如利用小分子有机物[14]、合成聚合物[15]、糖类[16]、脂类[17]和蛋白类[18]等对Zein膜进行修饰改性,成功制备各种性能不同的复合膜,Zein膜的制备方法和复合改性正在成为研究热点[19-21]。本工作简述了Zein的组成、结构及成膜机理,对 Zein膜的制备方法如流延成膜法、挤压成膜法、静电纺丝成膜法和浸出成膜等进行了分析和比较,介绍了Zein膜在包装、组织工程及药物载体方面的用途,总结了Zein膜在制备方法、复合改性及应用方面存在的不足,并从提高机械性能、增强亲/疏水性、增强隔氧阻水性、增大载药量和载药效率及增强药物控缓释等方面介绍了对Zein膜的修饰改性,并对其发展方向进行展望。
1 Zein膜的制备
1.1 Zein的组成及结构
Zein是玉米的主要存储蛋白,是一种天然的生物大分子,通常以粉末状存在。乙醇是公认的一种Zein的优良溶剂,根据Zein在不同乙醇浓度中的溶解情况,可将Zein分为α-Zein和β-Zein。α-Zein可溶于体积分数为95%的乙醇,在玉米醇溶蛋白中占约80%的比例,且α-Zein含有两种分子量,分别为24 000和22 000;β-Zein溶于体积分数为60%的乙醇而不溶于95%的乙醇,相对不稳定,常发生沉淀和团聚,故市售Zein主要成分是α-Zein。Zein之所以溶于乙醇而不溶于水,主要是由于Zein分子中存在大量的亮氨酸、谷氨酸、丙氨酸和脯氨酸[22,23],即 Zein分子中存在着大量的疏水性氨基酸和较多的含硫氨基酸,但缺乏能带电的酸性、碱性和极性基团氨基酸。
Zein的可能结构模型如图1所示,Argos等[24]通过圆二色性光谱发现Zein在体积分数为70%乙醇溶液中的分子结构可能是由9个重复单位反平行排列而成,之间形成氢键以保持稳定,具有扭曲圆筒状结构。Matsushima等[25]通过小角X射线散射指出Zein在体积分数为70%乙醇溶液中的结构为细长的棱柱状。该棱柱的侧面具有疏水性,而上下表面则由于富有谷氨酸而具有亲水性[26,27]。可见,Zein具有两亲性,可通过挥发诱导自组装方法自组装形成膜[28,29]。
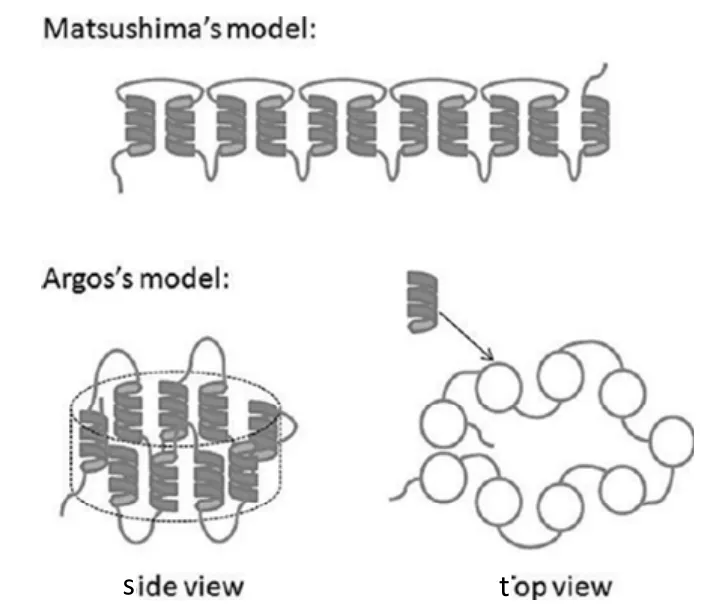
图1 Argos等[24]和Matsushima等[25]提出的Zein可能结构模型Fig.1 Zein structural models as proposed by Argos[24]and Matsushima[25]
1.2 Zein膜的制备
Zein分子中含有疏水性氨基酸,在适当的溶剂中可通过自组装形成微球、颗粒或膜,因此 Zein膜的制备较易。根据不同的实验目的和膜的用途,制备Zein膜的方法可分为流延法成膜、挤压成膜、静电纺丝成膜和浸出成膜等。
流延成膜,是将Zein溶解于某种溶剂,然后倒入成膜的容器中,将溶剂蒸发后制得Zein膜。流延法成膜是根据Zein分子自组装成膜的特点形成的方法,该方法制备的Zein膜内部没有特殊结构,表面无特殊性能要求,是最常用、最简单的制膜方法,但是对Zein膜的性能和要求也是最低的。
挤压成膜,一般是指将 Zein和另外一种很难共溶的物质通过加热熔融方法或直接混合,然后倒入挤压机中,在一定的挤压和操作条件下,挤出成膜的过程。挤压成膜是针对与 Zein难共溶的物质采用的一种方法,可将难溶物质对 Zein进行改性并成膜,但是该方法要求各组分处于熔融状态,较高的温度很可能破坏各组分的分子结构而使其变性;同时,该方法制备的 Zein膜与添加剂很难达到分子水平的混合,成膜结构不均匀,与其他成膜方法相比,成膜性能可能会有所降低。因此,挤压成膜法一般是在难以找到共溶剂的情况下所采用的技术。
静电纺丝成膜,是指在一定的电压和填料速率的条件下,利用静电纺丝装置将事先准备的 Zein溶液通过电压的作用制备成纤维丝,然后将这些纤维丝放置在一定装置上形成纤维膜的过程。静电纺丝成膜是一种新兴成膜技术,其特点是操作和装置相对简单,成膜的性能好,孔隙率高,且可针对不同的要求(膜的厚度和纤维的粗细等)进行有效改性,用途较广,特别是医药行业用于制备药物载体。但是一般对要制备膜材料有一定的限制,如带电,是否可旋转等;同时,由于静电纺丝制备的膜微结构是纤维丝,因此作为药物载体时,很难避免药物在初期的爆发性释放,针对此缺点可从改性材料,以及与其他方法合用等方面考虑解决此问题。
浸出成膜,是指将 Zein和亲水性的固体物质混合均匀,置于一定形状的模具中压实,用水淋洗的方法将混合物中的亲水物质溶解,之后冷冻干燥成膜的过程。浸出成膜法是一种制备多孔膜的方法,其孔结构和大小可根据要求加入不同大小和形状的致孔剂进行调整,灵活性强,可有效制备多孔微结构用于药物载体系统和组织工程领域,但是该方法成膜的内部孔结构可能不规整,且需要专门的压实装置进行压实和稳固,现有的研究材料单一,可根据不同的膜性能要求,考虑同时采用多种不同性能的材料,以拓宽该方法的应用领域,提高其在各个领域的应用性能。
2 Zein膜的性能及应用
Zein作为天然生物大分子,具有可再生性、生物降解性和无污染等优良性能,除了可用于食品添加剂、增色剂、化妆品、创伤贴[30]和传感器[31]等领域,Zein膜主要用于包装、生物医药和组织工程等领域。Zein制备的包装膜,具有明显的隔氧阻水性[32]。用作组织工程支架时,Zein膜表现出良好的生物相容性[33]。Zein膜用作药物控缓释中的载体时,除可保护药物不受外界环境的影响、防止药物降解以提高药物的吸收度和稳定性以及减少毒副反应外,可很好地延缓药物释放,降低药物在局部组织的浓度,从而有效地提高药物疗效,满足长效和低毒等要求。
2.1 包装膜
在包装行业,石油副产品制成的塑料因不可生物降解而导致严重的环境污染,因此,将天然可降解的生物材料应用于包装膜具有很好的应用前景。有研究者将Zein膜对榛子仁[34]、苹果[35]、核桃仁[36]、草莓[7]和黄金梨[37]等的保鲜作用进行了实验,结果表明,Zein膜有良好的隔氧阻水性,从而起到很好的保鲜作用。Park等[38]将抗氧化剂加入到Zein膜和线性聚乙烯层压膜中,发现抗氧化剂的释放速率和该膜的机械强度和阻水性能有关,该层压膜能明显抑制脂肪氧化。
2.2 组织工程
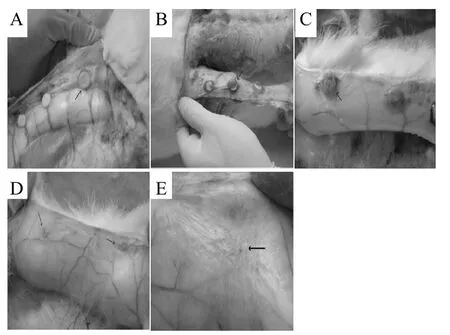
图2 Zein膜多孔支架在兔子皮下移植模型分析[39]Fig.2 Gross analysis of scaffolds after subcutaneous implantation in rabbits[39]
Zein具有可降解、良好的生物相容性和生物稳定性,可开发作为生物材料,特别是可用于组织工程,而用于组织工程材料必需具有足够的机械强度、良好的生物相容性、较强的亲水性和多孔结构等。Wang等[39]通过加入添加剂和致孔剂制备出机械性能良好的Zein膜多孔支架,并进行了体内实验,以兔子皮下移植为模型检测了该膜的生物相容性。如图2所示,组织学分析结果表明,该膜表现出很好的组织回应,该膜可在 8个月内完全降解,且血管可在支架内形成,显示出良好的机械性能和生物相容性。借助Zein膜优异的生物相容性,Wu等[13]利用溶剂浸出法制备出Zein和聚己内酯(PCL)的多孔复合支架用于生物医药领域,其中NaCl作为致孔剂,如图3所示。图3A和3B为Zein/PCL-40未浸入磷酸缓冲溶液中进行体外降解的SEM图,图3C和3D为浸入PBS溶液中28 d降解之后的SEM图。可见,体外降解对支架的表面形态影响很大,且由于 Zein的降解,在其表面可观察到更加不规整的大孔结构(如图3C);而在图3D中可观察到在支架的微孔壁上有细小的裂纹和小孔出现。结果表明,Zein/PCL支架的降解比PCL支架快,因此Zein/PCL生物支架可应用于骨生物工程领域。Zein膜应用于组织工程,要求其具有足够的机械强度、良好的生物相容性、较强的亲水性和多孔结构等,而纯Zein膜机械强度差、亲水性弱,因此需对Zein膜进行相应的修饰改性,以满足其组织工程上的应用。
2.3 药物载体
医学理疗有效的前提是负载的活性组分能从载体上可控释放,目前已有 Zein作为多种药物载体进行药物控制释放的报道,如团聚体、微球(中空或实球)、纳米颗粒和膜等[40],见图 4。由于Zein富含非极性氨基酸,因此可形成团聚体或通过形成稳定的蛋白-药物复合体的形式网捕药物,进而可减缓药物释放。同时,若将 Zein膜进一步处理,如利用超临界反溶剂法和静电纺丝法制备载药膜,则其缓释效果会更加明显。Li等[9]采用共轴静电纺丝法制备Zein膜(图5),用于药物控缓释特性研究,在共轴静电纺丝过程中,随着外部填料速率比的增大,纤维丝直径发生变化,同时影响载药效率(由图5A中载药率的15.7%增加到图5D中的94.5%)。可见,共轴静电纺丝的内、外填料速率比会影响药物的封装,进而影响膜的缓释效应,结果表明该静电纺丝膜可明显抑制药物的初始爆发释放。
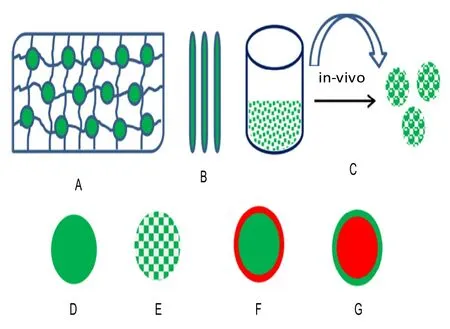
图4 药物传递和组织工程中用Zein制备常见载体原理[40]Fig.4 Schematic presentation of common carriers developed from Zein in drug delivery and tissue engineering[40]
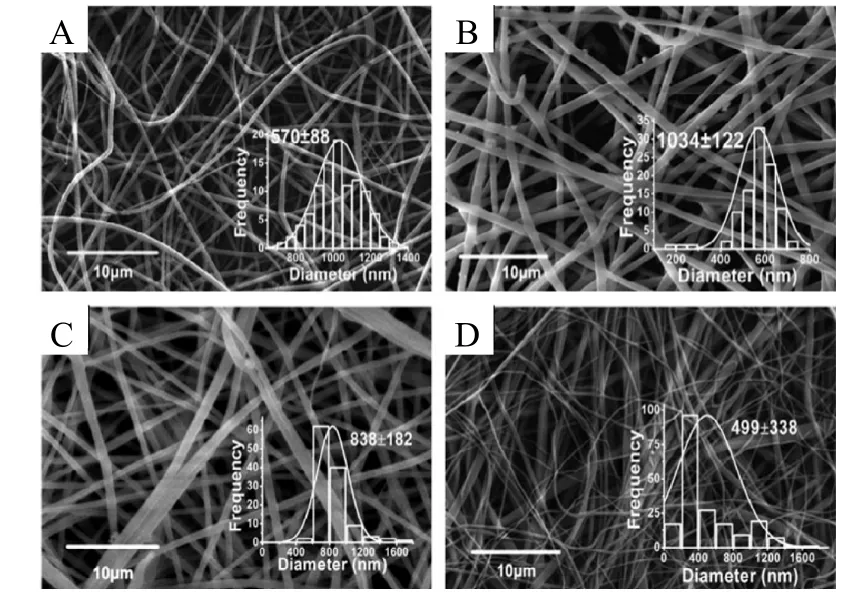
图5 不同的内外填料速率比制备的静电纺丝纤维的SEM[9]Fig.5 SEM images of coaxial fiber prepared with different inner/outer ratio of feeding rate[9]
Zein膜在药物传递中有诸多优点,如较大的负载面积、易制备、表面改性较易、较好的组织粘性、活性组分较易储藏和控缓释效果好等,但Zein膜机械性能较差[41]、载药量和载药效率较低及药物释放初期的爆发性释放等问题并未解决,因此Zein膜在药物载体系统中的应用还需深入研究。
3 Zein膜的修饰改性
Zein分子中含有大量疏水性氨基酸,在一定的溶剂中可通过自组装成膜,但是,形成的膜脆且硬,载药量低,控缓释及稳定性不好,不能满足包装、组织工程和药物载体系统等的应用要求,因此,有必要按不同应用领域,针对Zein膜在应用过程中性能方面的不足,进行修饰改性。本工作总结Zein膜的复合改性的思路见图6。对Zein膜的复合改性按照性能提高的方向进行了分类,包括提高机械性能、增强亲/疏水性、隔氧阻水性、载药量及载药效率和控缓释及稳定性等。
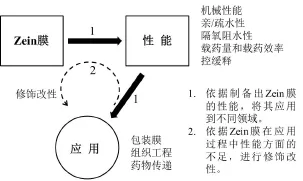
图6 Zein膜的复合改性Fig.6 Composite modification of Zein films
3.1 提高机械性能
Zein膜在包装、载药和组织工程等方面的应用,都需要Zein膜具有一定的机械性能,如抗拉强度、伸长率和可塑性等,但是 Zein分子在成膜的过程中,分子之间通过疏水链纠缠在一起,形成的膜硬且脆,因此在制备Zein膜的过程中,多采用共混改性的方法加入各种塑化剂以提高其机械性能。塑化剂一般是小分子有机物,可通过氢键或其他键作用力影响Zein分子链之间的相互作用和动力学,降低膜分子间作用力,增加分子链的移动性,从而使 Zein的玻璃化温度降低,柔韧性增加。常见的共混改性塑化剂有丙三醇、油酸、聚乙烯醇[42]、糖类[43-45]、脂肪酸[46]和三乙二醇[47]等。也有研究者采用戊二醛[48]、二苯基甲烷二异氰酸酯、六亚甲基二异氰酸酯[49]和柠檬酸等对Zein分子中的-OH,-NH2和-COOH等基团进行化学改性,生成酯类或酰胺类等,都不同程度地提高了其机械性能。
采用单一的塑化剂很难达到满意的效果,实验证明,可综合考虑不同塑化剂自身的特点,同时采用两或三种塑化剂进行复合改性。Xu等[50]采用油酸和丙三醇复合改性的方法以提升Zein膜的机械性能,研究了不同的油酸和丙三醇比例对Zein膜的抗拉强度和伸长率等的影响。可见,Zein膜的抗拉强度和伸长率随着油酸/丙三醇含量的增加而增大,直至其含量达到Zein质量的20%。当油酸和丙三醇复合使用,油酸和丙三醇的质量比为3:1时,Zein膜的抗拉强度达到最大值。对于化学改性提高机械性能的文献不多,因为进行化学改性时难免要加入一些有毒或者毒性较小的溶剂,而这些溶剂在成膜后很难完全除去,阻碍了Zein膜在食品包装和医药等领域的应用。Shi等[51]采用月桂酰氯对Zein进行酰化改性,其化学反应式见式(1)。结果表明,Zein和月桂酰氯之间无微相分离产生,其玻璃化温度降低了25.8 ℃,且在月桂酰氯浓度较高时,Zein膜的断裂伸长率达到空白Zein膜的7倍以上,但是机械强度稍微有所下降。Wu等[52]采用聚己酸内酯和环己烷-二异氰酸酯的预聚物改性 Zein膜,结果显示,当该预聚物的质量比达到20%~50%时,Zein膜的机械性能较好。Zein和预聚物进行化学改性的反应式如式(2)所示。
3.2 增强亲/疏水性
Zein分子含有少量的亲水性基团,但含有大量的疏水性氨基酸,因此表现出较强的疏水性特点。根据改性目的的不同,通过不同的物质复合改性,可提高其亲水性或疏水性能。例如,在 Zein膜用于药物载体时,若药物的亲水性比较强,为了增大载药量和载药效率,提升 Zein膜的控缓释效果,需增大Zein膜的亲水性,提高Zein分子和药物的作用力;反之,应增大Zein膜的疏水性,提高Zein分子和药物的结合力。较常见的亲水性复合物包括丙三醇、聚乙二醇[53]、水蒸气[54]、亚油酸[55]、糖类[56-60]、聚乳酸[61]、亲水性蛋白质和酯类等,疏水性复合物包括油脂类、聚己内酯[62]、二异氰酸酯、疏水性蛋白质和酯类[63]等。也有研究者采用聚己酸内酯和环己烷-二异氰酸酯对Zein进行化学改性,生成酯类,从而提高其疏水性能。Ghanbarzadeh等[64]研究了果糖、半乳糖和葡萄糖等糖类对Zein膜接触角的影响,结果表明,上述所有样品用乙醇测得的接触角最小,用水测得的接触角最大,并且在含有糖类的所有样品中,含有半乳糖的Zein膜有最大的水接触角。和含有半乳糖和葡萄糖的Zein膜相比,纯Zein膜和含有果糖的Zein膜有更高的表面张力,因此糖类可使Zein膜的亲水性增加。
3.3 增强隔氧阻水性
影响 Zein膜的隔氧阻水性的因素很多,如物理状态、塑化剂分子量、塑化剂和氧气的化学反应以及膜结构的类型(聚合物的结晶度、密度和分子连接情况)等。纯 Zein膜的隔氧性能优良,但是阻水性能较差。Zein膜优良的隔氧性能可能是由于Zein分子排列紧密、且有规律,氧气通过Zein的螺旋形结构阻力较大,而Zein分子中的谷氨酸使其具有一定的亲水性,从而降低其阻水性能。此外,Zein膜作为包装膜使用时,纯Zein膜硬且脆,可塑性差。Ghanbarzadeh等[65]将山梨醇、甘露醇和丙三醇作为塑化剂对Zein膜改性,并和纯Zein膜进行对比,研究3种塑化剂对Zein膜的隔氧效果。结果表明Zein膜的透氧率明显增大,且随着塑化剂的加入而发生变化。
3.4 增大载药量和载药效率
Zein膜在药物载体方面的研究和应用不断深入,作为评价药物载体性能好坏的重要标准—载药量和载药效率,对其深入研究具有重要意义。Zein膜的载药量和载药效率,与很多因素有关,如 Zein分子和药物之间的吸附作用力与氢键作用、Zein膜的内部结构、Zein膜的制备方法、载药方式、操作温度、溶液pH值、药物分子大小、药物和溶剂的作用力以及药物分子之间吸附力等。Xu等[66]在50和90 ℃下,将小麦谷蛋白粗纤维浸入pH值为3、浓度为1 mg/mL的双氯芬酸溶液中得到的Zein膜,其载药效率要高。引起药物吸附的主要推动力是静电作用力,在pH值为3的酸性条件下,在Zein纤维表面形成很多正的药物吸附点,对双氯芬酸上处于去质子化的羧基形成吸引,因此 Zein纤维可能比小麦谷物蛋白的正电位点多。Yang等[67]采用共轴静电纺丝的方法制备出 Zein/阿魏酸的复合纤维膜,该膜和单流体静电纺丝膜相比,纤维更圆且在粒径和分布方面质量更高,其红外光谱数据表明,阿魏酸和Zein纤维作用力来自于两者的氢键作用。
3.5 药物控缓释
药物控缓释是指负载在 Zein膜中的药物,从膜内部逐渐扩散到膜表面,从而完成释放的过程。一般来说,药物在 Zein膜中的释放过程,包括两个阶段:一是释放初期的爆发性释放,二是平稳释放。药物释放初期的爆发性释放是指药物在 Zein膜中释放初期,药物突发性的释放,在较短时间内释放较多药物。爆发性释放既浪费药物,药物的大量释放又可能对治疗部位造成伤害,因此,如何减少药物的初期爆发性释放量,成为药物控缓释的关键部分。现有提高药物控缓释效率的方法主要是从制备方法上改进,如共轴静电纺丝法、复合膜结构及加入和药物作用力较强的塑化剂等。
Li等[9]以烯丙基三苯基溴化膦(ATTPB)为模型药物,采用共轴静电纺丝法制备出Zein膜,并测试其药物控缓释。结果表明,药物在 Zein膜上的控缓释,与内、外填料的速率有很大的关系,也影响Zein膜纤维的直径。当内、外填料速率比为1∶2时,Zein膜上的药物在溶剂中第1个小时的释放量为其总质量的15%,该值明显小于采用单一流体静电纺丝法制备的载药Zein膜的药物释放量(约为45%)。共轴静电纺丝法制备的载药Zein膜,不仅在药物释放初期的爆发释放量较少,而且在接下来的24 h内释放速度也更慢。
综上所述,由于 Zein膜作为生物材料的诸多优点,其在生物医药和组织工程方面的应用及修饰改性已成为研究热点,Zein膜具体的修饰改性可用图7来总结。先通过修饰改性,然后确定改性后的各种性能,再通过性能的好坏改善修饰改性方法。Zein的修饰改性总结起来有两种,一种是化学改性,另一种是共混改性。通过化学改性后残留的化学试剂很难全部去除,残留的毒性影响了 Zein纤维的生物相容性,而共混改性需要考虑共混物质的各种性质,且纺丝条件相对比较复杂,对纺丝液的要求也比较高。目前,对 Zein的修饰改性并用于药物控缓释的研究还处于初步阶段,对其修饰改性结果还不是很理想,药物的初期爆发性释放问题还没有得到根本的解决,药物的释放周期仍旧较短,因此,以后的发展方向应从膜内部结构的改造(如内部成孔状结构且孔口很小和比表面积大的结构等)、添加剂的选取(如添加剂对药物有较强的吸附作用等)及膜表面的结构改性(如膜表面孔较少且有较多阻碍药物输出的材料等)等方面进行。

图7 Zein膜的修饰改性-微结构-性能关系Fig.7 Relationship of modification-microstructure-characteristic in Zein films
4 结束语
Zein作为一种天然可食性植物大分子,除具有天然可降解性、无毒性和优良的生物相容性外,还有很强的疏水性、耐高热性、可修饰性和高硬度等特点,因此 Zein膜可用于包装及药物载体、组织工程支架等生物医药和工程领域。但是,纯Zein膜硬且易碎,可塑性差,因此对Zein膜需进行修饰改性。对Zein膜的复合改性,可提高其机械性能、亲/疏水性、载药量和载药效率及控缓释等性能,从而满足其在生物医药和工程中的应用,目前已经取得一定的进展。
但迄今为止,Zein膜从制备方法、复合改性到应用都存在不足。Zein膜的制备方法一般包括铺膜、挤压成膜、静电纺丝成膜和浸出成膜等,每个方法各有其优势,如何从 Zein膜的具体应用出发,开发出更加先进和有成效的制膜方法,或者将两、三种方法复合使用,成为研究者思考的一个问题。对Zein膜的复合改性研究已经很多,但是对其原理或者达到分子水平的理论研究还较少,对其理论的深入研究可从根本上指导 Zein膜的复合改性方法,更快、更准确地提高其性能。近年来,生物改性方法正在逐步兴起,酶法改性是一种很好的生物改性方法。酶促反应速率快,条件温和,专一性强,更重要的是一些低廉微生物酶的出现为研究提供了条件。作为药物载体,Zein膜的应用剂型过少,目前有微胶囊膜、喷雾膜和直接贴膜等,有待进一步开发新的剂型。同时,药物在 Zein膜中控缓释初期的爆发性释放、载药量少和载药效率低的问题,一直未能有效解决。因此,未来 Zein膜在生物医药和工程方面的研究,主要针对以上问题展开。
总的来说,Zein膜修饰改性的方法、性能和用途等方面的研究还有待深入,修饰改性的原理还不是很透彻,这都有待进一步的研究。随着科学技术的发展和研究者的不断努力,Zein膜的开发与应用将得到进一步提升和拓展。
[1]Kaplan D L, Mayer J M, Ball D, et al. Fundamentals of biodegradable polymers[J]. Biodegradable Polymers and Packaging, 1993, 8(5): 1-42.
[2]Pol H, Dawson P, Acton J, et al. Soy protein isolate/corn-zein laminated films: transport and mechanical properties[J]. Journal of Food Science, 2002, 67(1): 212-217.
[3]Shukla R, Cheryan M. Zein: the industrial protein from corn[J]. Industrial Crops and Products, 2001, 13(3): 171-192.
[4]Lawton J W. Zein: a history of processing and use[J]. Cereal Chemistry, 2002, 79(1): 1-18.
[5]Kang Y J, Lee S D, Lee G H, et al. Antibacterial activity of Zein hydrolysate with pepsin[J]. Journal of the Korean Society of Food Science and Nutrition, 2006, 35(2): 127-131.
[6]Paramawati R, Yoshino T, Isobe S. Properties of plasticized-Zein film as affected by plasticizer treatments[J]. Food Science and Technology Research, 2001, 7(3): 191-194.
[7]李云捷, 陈列勤, 张雪莲, 等. 玉米醇溶蛋白复合膜在草莓保鲜中的应用研究[J]. 食品研究与开发, 2009, 30 (12): 157-159. Li Yunjie, Chen Lieqin, Zhang Xuelian, et al. The applied research of zein composite membrane in strawberry preservation[J]. Food Research and Development, 2009, 30(12): 157-159.
[8]Qu Z H, Wang H J, Tang T T, et al. Evaluation of the zein/inorganics composite on biocompatibility and osteoblastic differentiation[J]. Acta Biomaterialia, 2008, 4(5): 1360-1368.
[9]Li J, Feng H, He J, et al. Coaxial electrospun zein nanofibrous membrane for sustained release[J]. Journal of Biomaterials Science, Polymer Edition, 2013, 24(17): 1923-1934.
[10]陈义勇, 邓克权, 王 伟, 等. 玉米醇溶蛋白膜的制备及其在保鲜中的应用[J]. 常熟理工学院学报, 2007, 21(10): 75-77. Chen Yiyong, Deng Kequan, Wang Wei, et al. Preparation of zein film and its application in preserving freshness[J]. Journal of Changshu Institute of Technology(Natural Sciences), 2007, 21(10): 75-77.
[11]Beck M I, Tomka I, Waysek E. Physico-chemical characterization of zein as a film coating polymer: a direct comparison with ethyl cellulose[J]. International Journal of Pharmaceutics, 1996, 141(1): 137-150.
[12]Katayama H, Kanke M. Drug release from directly compressed tablets containing zein[J]. Drug Development and Industrial Pharmacy, 1992, 18(20): 2173-2184.
[13]Wu F, Wei J, Liu C, et al. Fabrication and properties of porous scaffold of zein/PCL biocomposite for bone tissue engineering[J]. Composites Part B: Engineering, 2012, 43(5): 2192-2197.
[14]Bromberg L. Blends and semiinterpenetrating networks of zein and poly(N,N-dimethylacrylamide)[J]. The Journal of Physical Chemistry, 1996, 100(32): 13811-13814.
[15]Wongsasulak S, Puttipaiboon N, Yoovidhya T. Fabrication, gastromucoadhesivity, swelling, and degradation of zein-chitosan composite ultrafine fibers[J]. Journal of Food Science, 2013, 78(6): N926-N935.
[16]Gontard N, Duchez C, Cuq J L, et al. Edible composite films of wheat gluten and lipids: water vapor permeability and other physical properties[J]. International Journal of Food Science & technology, 1994, 29(1): 39-50.
[17]Cho S Y, Lee S Y, Rhee C. Edible oxygen barrier bilayer film pouches from corn zein and soy protein isolate for olive oil packaging[J]. LWT-Food Science and Technology, 2010, 43(8): 1234-1239.
[18]Huang W, Zou T, Li S, et al. Drug-loaded zein nanofibers prepared using a modified coaxial electrospinning process[J]. AAPS Pharm Sci Tech, 2013, 14(2): 675-681.
[19]Izzo M T, Ho C T. Protein-lipid interaction during single-screw extrusion of zein and corn oil[J]. Cereal Chemistry, 1989, 66(1): 47-51.
[20]O'Donnell P B, Wu C, Wang J, et al. Aqueous pseudolatex of zein for film coating of solid dosage forms[J]. European Journal of Pharmaceutics and Biopharmaceutics, 1997, 43(1): 83-89.
[21]McKinney L L, Clarke G L. The encyclopedia of chemistry[M]. Reinhold: New York, 1958: 319-320.
[22]Athamneh A I, Griffin M, Whaley M, et al. Conformational changes and molecular mobility in plasticized proteins[J]. Biomacromolecules, 2008, 9(11): 3181-3187.
[23]Shukla R, Cheryan M. Zein: the industrial protein from corn[J]. Industrial Crops and Products, 2001, 13(3): 171-192.
[24]Argos P, Pedersen K, Marks M D, et al. A structural model for maize zein proteins[J]. Journal of Biological Chemistry, 1982, 257(17): 9984-9990.
[25]Matsushima N, Danno G, Takezawa H, et al. Three-dimensional structure of maize α-zein proteins studied by small-angle X-ray scattering[J]. Biochim Biophys Acta, Protein Struct Mol Enzymol, 1997, 1339(1): 14-22.
[26]Wang Q, Wang J F, Geil P H, et al. Zein adsorption to hydrophilic and hydrophobic surfaces investigated by surface plasmon resonance[J]. Biomacromolecules, 2004, 5(4): 1356-1361.
[27]Wang Q, Yin L L, Padua G W. Effect of hydrophilic and lipophilic compounds on zein microstructures[J]. Food Biophys, 2008, 3(2): 174-181.
[28]Wang Y, Padua G W. Formation of zein microphases in ethanol-water[J]. Langmuir, 2010, 26(15): 12897-12901.
[29]Li Y, Li J, Xia Q, et al. Understanding the dissolution of α-zein in aqueous ethanol and acetic acid solutions[J]. The Journal of Physical Chemistry B, 2012, 116(39): 12057-12064.
[30]Selling G W. The effect of extrusion processing on zein[J]. Polymer Degradation and Stability, 2010, 95(12): 2241-2249.
[31]Saithongdee A, Praphairaksit N, Imyim A. Electrospun curcumin-loaded zein membrane for iron(III) ions sensing[J]. Sensors and Actuators B: Chemical, 2014, 202: 935-940.
[32]Dong J, Sun Q, Wang J Y. Basic study of corn protein, zein, as a biomaterial in tissue engineering, surface morphology and biocompatibility[J]. Biomaterials, 2004, 25(19): 4691-4697.
[33]Zhong Q, Jin M. Nanoscalar structures of spray-dried zein microcapsules and in vitro release kinetics of the encapsulated lysozyme as affected by formulations[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3886-3894.
[34]张春红, 常 南, 高慧楠. 谷朊粉与玉米醇溶蛋白复合膜的制备及其在榛子仁保鲜中的应用[J]. 中国油脂, 2010, 35(4): 21-24. Zhang Chunhong, Chang Nan, Gao Huinan. Preparation of edible com posite film with wheat gluten and zein and its application in hazelnut kernels preservation[J]. China Oil and Fats, 2010, 35(4): 21-24.
[35]刘志国, 赵 岩, 韩世柳. 玉米醇溶蛋白的涂膜保鲜作用研究[J]. 武汉工业学院学报, 2007, 26(3): 1-3. Liu Zhiguo, Zhao Yan, Han Shiliu. Fresh preservation study on zein film coatings[J]. Journal of Wuhan Polytechnic University, 2007, 26(3): 1-3.
[36]周柏玲, 李 蕾, 孙秋雁, 等. 玉米醇溶蛋白复合膜包衣对核桃仁酸败抑制效果的研究[J]. 农业工程学报, 2004, 20(3): 180-183. Zhou Bailing, Li Lei, Sun Qiuyan, et al. Inhibiting effect of zein film-coating to rancidification of walnut meat[J]. Transactions of the CSAE, 2004, 20(3): 180-183.
[37]王海粟, 赵 婷, 于佳弘, 等. 玉米醇溶蛋白膜的制备及其对黄金梨保鲜效果的研究[J]. 粮油食品科技, 2012, 19(6): 43-46. Wang Haisu, Zhao Ting, Yu Jiahong, et al. Preparation of zein film and study of the effect on hwangkumbae preservation[J]. Science and Technology of Cereals, Oils and Foods, 2011, 19 (6): 43-46.
[38]Park H Y, Kim S J, Kim K M, et al. Development of antioxidant packaging material by applying corn-zein to LLDPE film in combination with phenolic compounds[J]. Journal of Food Science, 2012, 77(10): E273-E279.
[39]Wang H J, Gong S J, Lin Z X, et al. In vivo biocompatibility and mechanical properties of porous zein scaffolds[J]. Biomaterials, 2007, 28(27): 3952-3964.
[40]Paliwal R, Palakurthi S. Zein in controlled drug delivery and tissue engineering[J]. Journal of Controlled Release, 2014, 189: 108-122.
[41]Zelikin A N. Drug releasing polymer thin films: new era of surface-mediated drug delivery[J]. ACS Nano, 2010, 4(5): 2494-2509.
[42]Zhang M, Liu Y, Yi H, et al. Electrospun zein/PVA fibrous mats as three-dimensional surface for embryonic stem cell culture[J]. The Journal of the Textile Institute, 2014, 105(3): 246-255.
[43]Parris N, Dickey L C, Kurantz M J, et al. Water vapor permeability and solubility of zein/starch hydrophilic films prepared from dry milled corn extract[J]. Journal of Food Engineering, 1997, 32(2): 199-207.
[44]Siuraki T, Isbihara T, Nemoto N. Mechanical properties of cellulose derivative/zein blend films[J]. Japanese Journal of Polymer Science and Technology, 2001, 58(11): 598-605.
[45]Lakshmana R S. Development of novel zein-cellulose nanocomposite films[D]. New Brunswick: Rutgers University, 2013.
[46]Lai H M, Padua G W, Wei L S. Properties and microstructure of zein sheets plasticized with palmitic and stearic acids[J]. Cereal Chemistry, 1997, 74(1): 83-90.
[47]Selling G W, Sessa D J, Palmquist D E. Effect of water and tri (ethylene) glycol on the rheological properties of zein[J]. Polymer, 2004, 45(12): 4249-4255.
[48]Selling G W, Woods K K, Sessa D, et al. Electrospun zein fibers using glutaraldehyde as the crosslinking reagent: effect of time and temperature[J]. Macromolecular Chemistry and Physics, 2008, 209(10): 1003-1011.
[49]李新松, 姚 琛, 浦跃朴, 等. 玉米蛋白纳米纤维多孔膜及其制备方法: 中国, 200510094401.9[P]. 2005-10-09.
[50]Xu Weijie, Karst D, Yang Wen, et al. Novel zein-based eletrospun fibers with the water stability and strength necessary for variousapplications[J]. Polymer International, 2008, (57): 1110-1117.
[51]Shi K, Huang Y, Yu H, et al. Reducing the brittleness of zein films through chemical modification[J]. Journal of Agricultural and Food Chemistry, 2010, 59(1): 56-61.
[52]Wu Q, Sakabe H, Isobe S. Studies on the toughness and water resistance of zein-based polymers by modification[J]. Polymer, 2003, 44(14): 3901-3908.
[53]Senna M M, Salmieri S, El-Naggar A W, et al. Improving the compatibility of zein/poly (vinyl alcohol) blends by gamma irradiation and graft copolymerization of acrylic acid[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4470-4476.
[54]Wang H J, Fu J X, Wang J Y. Effect of water vapor on the surface characteristics and cell compatibility of zein films[J]. Colloids and Surfaces B: Biointerfaces, 2009, 69(1): 109-115.
[55]Budi S F X, Padua G W. Tensile properties and water absorption of zein sheets plasticized with oleic and linoleic acids[J]. Journal of Agricultural and Food Chemistry, 1999, 47(5): 2070-2074.
[56]Koh H Y, Chinnan M S. Characteristics of corn zein and methyl cellulose bilayer edible films according to preparation protocol[J]. Food Science and Biotechnology, 2002, 11(3): 310-315.
[57]Torres G S, Ocio M J, Lagaron J M. Novel antimicrobial ultrathin structures of zein/chitosan blends obtained by electrospinning[J]. Carbohydrate Polymers, 2009, 77(2): 261-266.
[58]Song T, Yao C. Electrospinning of zein/chitosan composite fibrous membranes[J]. Chinese Journal of Polymer Science, 2010, 28(2): 171-179.
[59]Müller V, Piai J F, Fajardo A R, et al. Preparation and characterization of zein and zein-chitosan microspheres with great prospective of application in controlled drug release[J]. Journal of Nanomaterials, 2011, 2011: 10.
[60]Takahashi K, Ogata A, Yang W H, et al. Increased hydrophobicity of carboxymethyl starch film by conjugation with zein[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(6): 1276-1280.
[61]Zhang H, Xiong J, Li N, et al. Morphology and properties of zein ultrafine fibrous membranes adjusted and controlled by PLA[J]. Polymer Materials Science & Engineering, 2011, 27(8): 57-60.
[62]Corradini E, Mattoso L H C, Guedes C G F, et al. Mechanical, thermal and morphological properties of poly (ε-caprolactone)/zein blends[J]. Polymers for Advanced Technologies, 2004, 15(6): 340-345.
[63]Chen Y, Ye R, Li X, et al. Preparation and characterization of extruded thermoplastic zein-poly(propylene carbonate) film[J]. Industrial Crops and Products, 2013, 49: 81-87.
[64]Ghanbarzadeh B, Musavi M, Oromiehie A R, et al. Effect of plasticizing sugars on water vapor permeability, surface energy and microstructure properties of zein films[J]. LWT-Food Science and Technology, 2007, 40(7): 1191-1197.
[65]Ghanbarzadeh B, Oromiehie A R, Musavi M, et al. Study of mechanical properties, oxygen permeability and AFM topography of zein films plasticized by polyols[J]. Packaging Technology and Science, 2007, 20(3): 155-163.
[66]Xu W, Yang Y. Drug loading onto and release from wheat gluten fibers[J]. Journal of Applied Polymer Science, 2010, 116(2): 708-717.
[67]Yang J M, Zha L, Yu D G, et al. Coaxial electrospinning with acetic acid for preparing ferulic acid/zein composite fibers with improved drug release profiles[J]. Colloids and Surfaces B: Biointerfaces, 2013, 102: 737-743.
Recent Developments in Functional Zein Films
Wei Dongwei, Liu Guijin, Jiang Yanbin
School of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou 510640, China
In this review, the structure and composition of zein films were introduced briefly. Then, preparation methods, properties and applications of zein films were reviewed. And recent developments in modifications for zein films to satisfy performance requirements in application, such as strengthening the mechanical properties, enhancing the hydrophilic/hydrophobic properties, improving the oxygen/water vapor barrier, increasing the drug-loaded mass and efficiency, heightening the drug-loaded control and release, were introduced and discussed in detail respectively. In summary, the future orientations of zein films focus on new methods for preparation and modification, further investigation of the modification mechanism, new application fields and elimination of the initial burst release for the drug-loaded control and release.
Zein film; performance; application; modification; drug-loaded efficiency; drug controlled release
TS201.2; TS206.4
A
1001—7631 ( 2015 ) 06—0538—10
2015-05-11;
2015-11-23。
魏东伟(1984—),男,博士研究生;江燕斌(1970—),男,教授,通讯联系人。E-mail: cebjiang@scut.edu.cn。
国家自然科学基金(21276091,21476086);教育部博士点基金(20120172110010)。
