神经酰胺在非酒精性脂肪性肝病中的作用研究进展
2015-12-16刘浩雷综述阳学风审校
刘浩雷综述,阳学风审校
(南华大学附属南华医院消化内科,湖南衡阳421002)
神经酰胺在非酒精性脂肪性肝病中的作用研究进展
刘浩雷综述,阳学风审校
(南华大学附属南华医院消化内科,湖南衡阳421002)
肝病;乙醇;脂肪类/代谢;神经酰胺类;胰岛素;细胞凋亡;综述
非酒精性脂肪性肝病(NAFLD)在欧美国家已取代病毒性肝炎,成为最主要的肝病[1]。近年来研究表明,神经酰胺能阻断胰岛素信号转导,诱发胰岛素抵抗(IR)和炎性反应,提示神经酰胺可能对NAFLD的发病起着重要的作用[2-3]。因此,本文就近年来神经酰胺与NAFLD的研究作一综述。
1 神经酰胺生理功能与合成
神经酰胺由长链脂肪酸和鞘氨醇链接而成,是细胞膜的组成成分,同时,其作为重要的第二信使参与了细胞增殖、分化和凋亡活动。神经酰胺主要由3种途径产生:从头合成途径、鞘磷脂循环途径和鞘氨醇合成途径(图1)。从头合成途径主要发生在内质网或线粒体中,首先是丝氨酸与棕榈酰辅酶A在丝氨酸棕榈酰转移酶(SPT)催化下形成3-酮-二氢鞘氨醇,再依次转化为二氢鞘氨醇、二氢神经酰胺,最后形成神经酰胺。其中SPT是从头合成的限速酶[4-5]。鞘磷脂循环途径是鞘磷脂(SM)在鞘磷脂酶(SMase)作用下分解为神经酰胺和磷酸胆碱;而神经酰胺和磷酸胆碱又可在鞘磷脂合成酶作用下合成为SM,因此称为鞘磷脂循环。另外,鞘氨醇在神经酰胺合成酶作用下形成神经酰胺,同时,神经酰胺也可分解为鞘氨醇,鞘氨醇进一步磷酸化成鞘氨醇-1-磷酸(S1P),S1P能促进细胞生长和增殖,与神经酰胺主要促细胞凋亡的作用相反[6]。
神经酰胺与氧化应激和炎性反应密切相关。谷胱甘肽等抗氧化剂通过抑制二氢神经酰胺还原酶阻止神经酰胺的生成[7]。脂多糖、炎症因子(如TNF-α、IL-1)和氧化应激则通过增加SPT的表达和活性,促进神经酰胺的生成[8]。TNF-α还能激活ASMase或NSMase刺激神经酰胺的合成,使炎症细胞聚集于肝脏导致炎性反应加重[9]。其他促炎性细胞因子(如IL-1、IL-6)也能诱导神经酰胺生成,引起炎性反应[10]。而抗炎性细胞因子脂联素能激活神经酰胺酶,使神经酰胺分解为鞘氨醇,继而磷酸化为S1P,降低神经酰胺的含量,使肝脏的炎性反应减轻[11]。
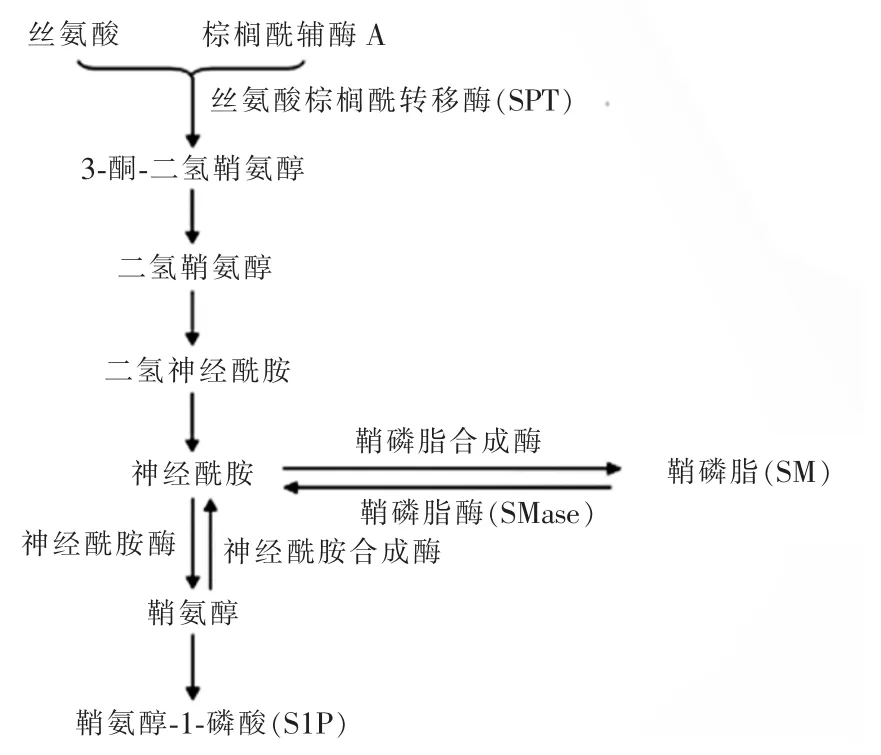
图1 神经酰胺合成途径
2 神经酰胺与脂毒性
肝细胞脂肪变的主要机制是外周脂肪组织的脂肪分解加速,导致回流至肝脏中的游离脂肪酸(FFA)增加。FFA在肝脏转化为不同的脂类如三酰甘油(TG)等,然后TG以极低密度脂蛋白(VLDL)的形式从肝脏输出。然而,当FFA输入肝脏的量远超过VLDL的输出量时,则会导致肝内脂类(包括TG和神经酰胺)堆积,这些在肝脏堆积的脂类能引起肝细胞功能障碍甚至死亡即脂毒性。研究发现,NAFLD患者肝内饱和脂肪酸(如软脂酸)和不饱和脂肪酸(如油酸)的含量明显高于健康人[12-13]。有文献报道,H4IIE大鼠肝癌细胞经饱和脂肪酸(软脂酸或硬脂酸)处理后其细胞内的神经酰胺明显增加[14]。Chocian等[15]采用高脂饲料喂养大鼠,发现其肝细胞内神经酰胺和SM的含量明显增加。相反,应用多球壳菌素阻断神经酰胺的从头合成途径,能减轻高脂喂养老鼠肝内的脂肪沉积[16]。另外,不同类型的脂肪酸也影响神经酰胺的生成。Hollang等[17]分别采用猪油(饱和脂肪酸)和大豆油(主要是不饱和脂肪酸)喂养大鼠,发现猪油喂养的大鼠肝内神经酰胺含量明显高于大豆油喂养的大鼠。除了高脂肪饮食能引起神经酰胺生成外,神经酰胺也可由细胞因子如TNF-α诱导产生,TNF-α参与了细胞凋亡死亡受体信号通路,同时能激活炎性反应的信号通路[18]。上述研究表明,FFA回流肝脏与神经酰胺的生成可能存在一定的联系,但目前还不清楚是肝脂肪变导致了神经酰胺的增加,还是神经酰胺的增加诱导了脂肪组织的IR,从而引起FFA沉积和脂毒性。
3 神经酰胺与IR
IR是外周组织和靶器官(主要是肝脏)对胰岛素的敏感性和反应性降低的一种代谢状态。生理情况下胰岛素主要是通过Akt/PKB途径发挥生理效应,胰岛素与细胞膜上的胰岛素受体结合,通过胰岛素受体底物蛋白(IRS)激活磷脂酰肌醇3-激酶(PI3K),后者再激活Akt,活化的Akt主要有以下生物效应:(1)促进葡萄糖转运体囊泡(主要是GLUT4)易位至细胞膜并与细胞膜融合,从而有利于葡萄糖转运至细胞内;(2)激活糖原合成酶激酶-3(GSK-3)促进糖原的合成;(3)激活磷酸二酯酶3B(PDE3B),抑制脂肪分解(图2)。研究表明,神经酰胺能抑制骨骼肌和肝脏的胰岛素信号转导,还能抑制GLUT4的易位,使GLUT4不能固定至细胞膜上影响骨骼肌细胞对葡萄糖的摄取[19]。另外,神经酰胺能增加使Akt失活的蛋白磷酸酶2A(PP2A)的活性[20]。有研究发现,将肝细胞经短链神经酰胺处理后Akt和葡萄糖激酶活性均降低,而葡萄糖激酶是己糖激酶的同工酶,其能使葡萄糖磷酸化,从而有利于葡萄糖的摄取和糖原的合成[21]。反之,采用多球壳菌素抑制神经酰胺合成则能促进AKt的磷酸化[16]。Hollad等[17]发现,地塞米松除了能诱导大鼠肝内神经酰胺含量增加外,还能抑制Akt信号通路,而该抑制作用能用多球壳菌素逆转。因此,上述研究表明,神经酰胺可能是通过抑制Akt的活性参与了IR的形成,该抑制作用可能是神经酰胺上调IκBk和JNK基因的表达所致,因为IκBk和JNK能阻止胰岛素信号转导,是促进IR的细胞因子[21]。
4 神经酰胺与线粒体活性氧(ROS)生成
生物体内绝大多数的氧分子在线粒体中被消耗,线粒体也是产生ROS的一个重要部位。研究发现,氧化应激会引起非酒精性脂肪性肝炎(NASH)患者线粒体的结构和功能异常,其中呼吸链电子漏途径产生的超氧阴离子自由基和过氢氧化合物是ROS的重要来源。Colombini等[22]发现,短链神经酰胺对线粒体具有毒性作用,神经酰胺能在线粒体外膜形成稳定的跨膜通道,导致线粒体膜的通透性增加和细胞色素C释放。也有研究发现,TNF-α能诱导神经酰胺的生成增加,而加入抗氧化剂GSH后能减少神经酰胺的形成,同时减轻神经酰胺对线粒体的损伤作用[23]。通过建立ASMase-/-小鼠模型,增加TNF-α浓度并不能使小鼠肝脏内的ROS生成增加,说明TNF-α通过激活ASMase刺激神经酰胺的生成,继而引起线粒体中ROS生成增加,同时也说明ASMase在ROS的形成过程中发挥了重要作用[24]。
5 神经酰胺与肝细胞凋亡
肝细胞凋亡有死亡受体途径、线粒体途径和内质网应激3种途径,其中死亡受体途径是肝细胞凋亡的主要途径[25]。神经酰胺在电离辐射、紫外线、化学试剂、自由基、TNF-α和FAS配体等诱导的细胞凋亡过程中充当第二信使[26]。肝细胞凋亡后,肝星状细胞通过吞噬凋亡细胞而发生表型改变,成为活化的肝星状细胞,释放大量细胞因子如TGF-β、TNF-α、PDGF、IL-1、IL-6导致炎症和纤维化,其炎症和纤维化程度与凋亡呈正相关[27]。另外,TNF-α能激活溶酶体型ASMase,使细胞内神经酰胺增加,后者激活组织蛋白酶D,进一步导致线粒体的渗透性增加,释放出细胞色素C,继而引起caspase级联反应诱导细胞凋亡[28]。NAFLD还可因增多的游离脂肪酸诱导转谷氨酰胺酶2(TGase2)的表达,启动内质网应激PERK通路引起细胞凋亡[29]。由此可见,神经酰胺通过不同的途径诱导肝细胞凋亡。
6 神经酰胺的临床研究
目前对NAFLD相关的神经酰胺的临床研究较少,大部分是肥胖与神经酰胺的研究。研究表明,肥胖患者肝内神经酰胺含量明显升高;脂肪肝患者肝内神经酰胺含量也高于健康人[29]。相反,肥胖患者通过有氧锻炼减肥或手术减肥后肝内神经酰胺的含量较减肥前明显减少[30]。也有研究发现,肥胖合并2型糖尿病患者的血清神经酰胺水平较健康人明显升高,并且神经酰胺含量与IR程度和TNF-α含量呈正相关,这可能与TNF-α能诱导IR,从而引起FFA回流肝脏增加有关,而且神经酰胺通过正反馈机制导致体内TNF-α进一步增加[31]。以上临床研究均表明,神经酰胺在肥胖、2型糖尿病和代谢综合征发病过程中发挥了重要作用,提示神经酰胺在NAFLD的发病过程可能也起着相似的作用。
7 展望
神经酰胺作为第二信使参与了IR、氧化应激、炎性反应和细胞凋亡过程,而IR、氧化应激、炎性反应和细胞凋亡与NAFLD的发病密切相关。另外,在NAFLD发病过程中,促炎性细胞因子TNF-α和IL-6水平增加和抗炎性细胞因子脂褐素水平下降的同时伴随着神经酰胺水平的升高,这些细胞因子水平的变化可能导致神经酰胺生成增加,而神经酰胺则可能通过正反馈作用进一步加重NAFLD患者的炎性反应、IR、线粒体功能障碍和氧化应激而导致恶性循环,从而促使单纯性脂肪肝发展至NASH;当损伤作用超过肝脏修复能力时,细胞坏死或凋亡则不可避免,肝星状细胞在活化吞噬凋亡细胞的同时分泌细胞外基质,最终促使肝纤维化的形成。因此,将血清神经酰胺水平作为NAFLD特别是NASH的无创性诊断指标,选择性神经酰胺抑制剂作为NAFLD新的治疗药物,是进一步的研究目标。
[1]沈峰,范建高.2013年非酒精性脂肪性肝病新进展[J].中华肝脏病杂志,2014,22(3):178-180.
[2]Boon J,Hoy AJ,Stark R,et al.Ceramides contained in LDL are elevated in type 2 diabetes and promote inflammation and skeletal muscle insulin resistance[J].Diabetes,2013,62(2):401-410.
[3]Birkenfeld AL,Shulman GI.Nonalcoholic fatty liver disease,hepatic insulin resistance,and type 2 diabetes[J].Hepatology,2014,59(2):713-723.
[4]Vinodh R,Hannun YA.Sphingolipid metabolism and signaling as a target for cancer treatment[J].Cell Death Dis,2013,28(4):205-229.
[5]Venable ME.Elevation of Ceramide in Senescence:Role of Sphingolipid Metabolism[J].Tumor Dormancy,2014,32(2):81-88.
[6]Goñi FM,Sot J,Alonso A.Biophysical properties of sphingosine,ceramides and other simple sphingolipids[J].Biochem Soc Trans,2014,42(5):1401-1408.
[7]Airola MV,Hannun YA.Sphingolipid metabolism and neutral sphingomyelinases[J].Handb Exp Pharmacol,2013(215):57-76.
[8]Chang ZQ,Lee SY,Kim HJ,et al.Endotoxin activates de novo sphingolipid biosynthesis via nuclear factor kappa B-mediated upregulation of Sptlc2[J].Prostaglandins Other Lipid Mediat,2011,94(1/2):44-52.
[9]Schwabe RF,Brenner DA.Mechanisms of liver injury.I.TNF-α-induced liver injury:role of IKK,JNK,and ROS pathways[J].Am J Physiol Gastrointest Liver Physiol,2006,290(4):G583-589.
[10]Holland WL,Summers SA.Sphingolipids,insulin resistance,and metabolic disease:new insights from in vivo manipulation of sphingolipid metabolism[J].Endocr Rev,2008,29(4):381-402.
[11]Holland WL,Miller RA,Wang ZV,et al.Receptor-mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin[J].Nat Med,2011,17(1):55-63.
[12]Lake AD,Novak P,Hardwick RN,et al.The adaptive endoplasmic reticulum stress response to lipotoxicity in progressive human nonalcoholic fatty liver disease[J].Toxicol Sci,2014,137(1):26-35.
[13]Puri P,Baillie RA,Wiest MM,et al.A lipidomic analysis of nonalcoholic fatty liver disease[J].Hepatology,2007,46(4):1081-1090.
[14]Wei Y,Wang D,Topczewski F,et al.Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells[J].2006,291(2):E275-281.
[15]Chocian G,Chabowski A,endzian-Piotrowska M,et al.High fat diet induces ceramide and sphingomyelin formation in rat′s liver nuclei[J].Mol Cell Biochem,2010,340(1/2):125-131.
[16]Yang G,Badeanlou L,Bielawski J,et al.Central role of ceramide biosynthesis in body weight regulation,energy metabolism,and the metabolic syndrome[J].Am J Physiol Endocrinol Metab,2009,297(1):E211-224. [17]Holland WL,Brozinick JT,Wang LP,et al.Inhibition of ceramide synthesis ameliorates glucocorticoid-,saturated-fat-,and obesity-induced insulin resistance[J].Cell Metabol,2007,5(3):167-179.
[18]Comi C.Fas-mediated T-cell apoptosis in chronic inflammatory demyelinating polyneuropathy[J].J Peripher Nerv Syst,2011,Suppl 1:45-47.
[19]Chiu TT,Sun Y,Koshkina A,et al.Rac-1 superactivation triggers insulinindependent glucose transporter 4(GLUT4)translocation that bypassessignaling defects exerted by c-Jun N-terminal kinase(JNK)-and ceramideinduced insulin resistance[J].J Biol Chem,2013,288(24):17520-17531.
[20]Bikman BT,Summers SA.Ceramides as modulators of cellular and wholebody metabolism[J].J Clin Invest,2011,121(11):4222-4230.
[21]Ribaux PG,Iynedjian PB.Analysis of the role of protein kinase B(cAKT)in insulin-dependent induction of glucokinase and sterol regulatory elementbinding protein 1(SREBP1)mRNAs in hepatocytes[J].Biochem J,2003,376(Pt 3):697-705.
[22]Colombini M.Ceramide channels and their role in mitochondria-mediated apoptosis[J].Biochem Biophys Acta,2010,1797(6/7):1239-1244.
[23]Marí M,Caballero F,Colell A,et al.Mitochondrial free cholesterol loading sensitizes to TNF-and Fas-mediated steatohepatitis[J].Cell Metab,2006,4(3):185-198.
[24]Marí M,Colell A,Morales A,et al.Mechanism of mitochondrial glutathionedependent hepatocellular susceptibility to TNF despite NF-κB activation[J]. Gastroenterology,2008,134(5):1507-1520.
[25]Feldstein AE,Wieckowska A,Lopez AR,et al.Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis:A multicenter validation study[J].Hepatology,2009,50(4):1072-1078.
[26]Castro BM,Prieto M,Silva LC.A simple sphingolipid with unique biophysical properties[J].Prog Lipid Res,2014(54):53-67.
[27]Guicciardi ME,Gores GJ.Apoptosis as a mechanism for liver disease progression[J].Semin Liver Dis,2010,30(4):402-410.
[28]Edelmann B,Bertsch U,Tchikov V,et al.Caspase-8 and caspase-7 sequentially mediate proteolytic activation of acid sphingomyelinase in TNFR1 receptosomes[J].EMBO J,2011,30(2):379-394.
[29]Kuo TF,Tatsukawa H,Matsuura T,et al.Free fatty acids induce transglutaminase 2-dependent apoptosis in hepatocytes via ER stress-stimulated PERK pathways[J].J Cell Physiol,2012,227(3):1130-1137.
[30]Promrat K,Longato L,Wands JR,et al.Weight loss amelioration of nonalcoholic steatohepatitis linked to shifts in hepatic ceramide expression and serum ceramide levels[J].Hepatol Res,2011,41(8):754-762.
[31]Haus JM,Kashyap SR,Kasumov T,et al.Plasma ceramides are elevated in obese subjects with type 2 diabetes and correlate with the severity of insulin resistance[J].Diabetes,2009,58(2):337-343.
10.3969/j.issn.1009-5519.2015.02.021
A
1009-5519(2015)02-0217-04
2014-10-29)
刘浩雷(1978-),男,湖南攸县人,硕士研究生,主治医师,主要从事肝硬化防治研究;E-mail:417125944@qq.com。
阳学风(E-mail:yxf9988@126.com)。
