超声动态定量检测对早产儿脑白质损伤的诊断价值
2015-12-16冯婷陆双泉周建敏
冯婷,陆双泉,周建敏
(苏州大学附属儿童医院超声科,江苏苏州215003)
超声动态定量检测对早产儿脑白质损伤的诊断价值
冯婷,陆双泉,周建敏
(苏州大学附属儿童医院超声科,江苏苏州215003)
目的利用超声设备仪动态地对早产儿脑白质损伤进行定量测量及分析并研究其诊断价值。方法通过应用颅脑超声仪及图像处理软件,对2011年7月至2014年7月在该院儿科住院的120例不同胎龄早产儿[异常组(81例)和对照组(39例)]脑白质分别在产后第7、14、21、28天4个时间段进行不同层面(分别为侧脑室后角旁白质区、侧脑室旁皮质下白质区及半卵圆中心区)平均灰度值测量,研究两组不同时间段、不同层面脑白质灰度值的动态变化,并进行对比研究。结果早产儿产后第7、14、21、28天这4个时间段对照组所测不同层面脑白质平均灰度值均低于相对应同层面异常组水平,差异有统计学意义(P<0.05);异常组产后第7、14、21、28天4个时间段所测不同层面脑白质平均灰度值前后差值均呈递增趋势。结论超声定量检测能够动态地监测早产儿脑白质损伤的变化情况,对判断脑白质损伤病情程度有重要帮助,能够为临床诊断及调整治疗方案提供依据。
婴儿,早产;脑损伤;脑白质病;超声检查,多普勒,彩色;诊断
早产儿脑损伤是早产儿常见临床问题之一,也是引起儿童脑瘫、智力障碍等伤残的主要病因之一,因此,是当今世界和我国新生儿医学重点攻克的目标。对该病的治疗提倡早期诊断、早期干预及早期治疗,并及时地根据病情调整治疗方案。超声作为无创、无辐射并可移动的影像学检查设备,能够及时、动态地对早产儿脑损伤病情进行准确诊断。但多数研究虽能够利用超声诊断早产儿脑损伤,但一般都只能定性诊断,对更为重要的定量研究缺乏报道,且对疾病的动态观察研究较少。本研究通过大样本颅脑超声脑白质平均灰度值定量检测,动态地对早产儿脑白质损伤进行分析评价。
1 资料与方法
1.1 一般资料收集2011年7月至2014年7月本院儿科住院早产儿120例。以小于7 d颅脑超声检查示脑白质病变者为异常组,共81例,其中男48例,女33例,胎龄(32±3)周;以小于7 d颅脑超声检查阴性,1个月后复查阴性者为对照组,共39例,其中男22例,女17例,胎龄(33±2)周。所有研究对象排除脑发育畸形、脑实质出血性损伤、孕妇重度妊娠高血压综合征及产前宫内窘迫等。本研究经医院伦理委员会批准,全部患儿家属对本研究项目知情,并签署知情同意书。
1.2 方法采用东芝400彩色多普勒超声检测仪及医学图像分析系统,利用颅脑超声条件,参数相同(扇形小突阵扫描探头频率为5.5~7.5MHz,增益条件为100dB),分别取矢状面扫描的侧脑室后角层面图像、侧脑室旁皮质下白质区图像及半卵圆中心区图像。两组检查时间段分别位于产后第7、14、21、28天。应用医学图像分析软件,对120例新生儿脑超声图像侧脑室后角层面、侧脑室旁皮质下白质区及半卵圆中心区回声进行测量分析。感兴趣区(ROI)以直径0.3~0.5 cm的圆形进行选取,避开异常强回声,用“手动分析”测得该区域的平均灰度值,并以大脑左右半球相同部位的平均灰度值作为回声强度的量化指标。
1.3 统计学处理应用Stata12.0统计软件进行数据分析,计量资料以±s表示,采用两样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组不同时间段侧脑室后角旁白质区平均灰度值比较异常组产后第7、14、21、28天4个时间段所测侧脑室后角旁白质区平均灰度值均高于同层面对照组水平,差异均有统计学意义(t=6.99、7.83、11.32、15.87,P<0.05)。见表1。
表1 两组不同时间段侧脑室后角旁白质区平均灰度值比较(±s)

表1 两组不同时间段侧脑室后角旁白质区平均灰度值比较(±s)
注:-表示无此项。
组别对照组异常组39 81 t P 99.76±11.17 136.63±12.26 15.87<0.05 --n第7天第14天第21天第28天101.26±10.19 117.20±12.33 6.99<0.05 100.41±12.31 120.35±13.41 7.83<0.05 101.33±13.28 127.11±10.84 11.32<0.05
2.2 两组不同时间侧脑室旁皮质下白质区平均灰度值比较异常组产后第7、14、21、28天4个时间段所测侧脑室旁皮质下白质区平均灰度值均高于同层面对照组水平,差异均有统计学意义(t=7.55、10.51、16.20、20.98,P<0.05)。见表2。
表2 两组不同时间段侧脑室旁皮质下白质区平均灰度值比较(±s)

表2 两组不同时间段侧脑室旁皮质下白质区平均灰度值比较(±s)
注:-表示无此项。
组别对照组异常组n第7天第14天第21天第28天104.84±12.49 147.43±9.27 20.98<0.05 39 81 t P --104.22±12.11 120.21±10.23 7.55<0.05 105.11±10.21 127.43±11.21 10.51<0.05 104.34±9.98 136.12±10.11 16.20<0.05
2.3 两组不同时间段半卵圆中心区平均灰度值比较 异常组产后第7、14、21、28天4个时间段所测半卵圆中心区平均灰度值均高于同层面对照组水平,差异均有统计学意义(t=3.12、4.40、5.83、8.94,P<0.05)。见表3。
表3 两组不同时间段半卵圆中心区平均灰度值比较(±s)
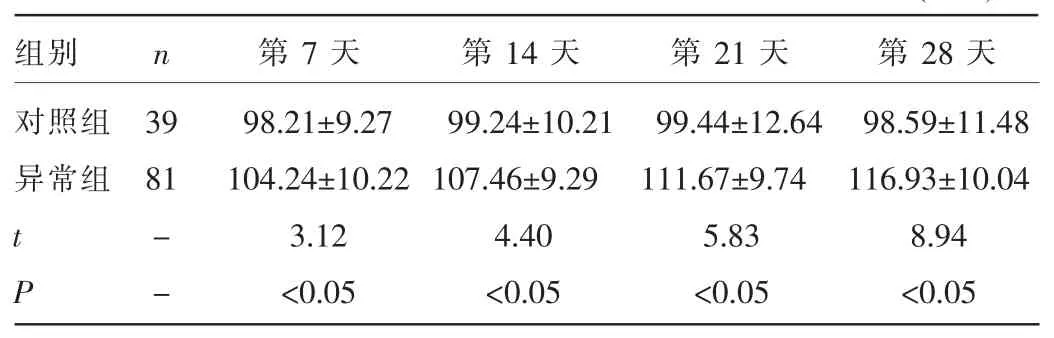
表3 两组不同时间段半卵圆中心区平均灰度值比较(±s)
注:-表示无此项。
组别对照组异常组n第7天第14天第21天第28天98.59±11.48 116.93±10.04 8.94<0.05 39 81 t P --98.21±9.27 104.24±10.22 3.12<0.05 99.24±10.21 107.46±9.29 4.40<0.05 99.44±12.64 111.67±9.74 5.83<0.05
2.4 异常组不同时间段不同层面脑白质平均灰度值增加情况异常组产后第7、14、21、28天4个时间段所测不同层面白质区平均灰度值前后差异呈递增趋势。与第7天比较,第14、21、28天侧脑室后角旁白质区平均灰度值分别递增2.69%、5.26%及7.49%;第14、21、28天侧脑室旁皮质下白质区平均灰度值分别递增6.01%、6.82%及8.31%;第14、21、28天半卵圆中心区平均灰度值分别递增3.09%、3.92%及4.71%。见表4。
3 讨论
Cakir等[1]研究提示,早产儿脑白质损伤是由于血管损伤及炎性反应导致的脑白质病变,整个过程呈现一个动态的改变。早产儿脑白质血管有两方面的特点。首先是解剖特点:越不成熟的早产儿,脑室周围动脉长穿支越少且侧支循环亦少[2],生发基质周围虽然血管丰富,但血管缺少平滑肌[3],抗血流冲击能力差。其次是血流调节特点:白质区血流量低,自调能力差、范围窄,血管反应性不成熟[4]。早产儿脑白质损伤早期可表现为局部水肿,极轻者1周左右恢复正常,3~4周后部分病例受损白质萎缩,损伤严重的白质最终液化成囊腔,形成脑室周白质软化(PVL)的典型改变[5]。在这个持续的动态过程中,怎样监测这些变化,成为影像学中的一个重要热点,其变化情况能够成为早产儿脑白质损伤的临床治疗方案依据。而对早产儿各时期脑白质损伤的定量测量是本次研究的重点,能够准确地对脑白质损伤及时作出量化评估。
超声在早期就可以发现脑室旁白质损伤,是一种很好的可连续监测早产儿大脑变化的工具,国外学者报道,脑白质损伤患儿早期颅脑超声检出率较高,部分研究显示高达97.2%[6-7]。陈海燕等[8]研究表明,脑白质回声增强是其损伤的重要超声表现。本研究利用计算机将脑区域的黑白深浅程度分为256个等级即灰度值,并加权平均得出平均灰度值,代表该区域的组织密度及含量。作者发现在各个不同检查层面分组中同时间段内异常组的平均灰度值均大于对照组,此现象提示异常组中组成脑白质的胶质细胞坏死崩解后,巨噬细胞经行吞噬[9],导致组织密度增加,同时轴突出现水肿[10],二者同时发生导致该区域的平均灰度值增加。本研究同时发现,异常组侧脑室旁皮质下白质区在早期(即第7天时)的平均灰度值相对于同时期对照组变化最大,提示早产儿脑白质损伤中侧脑室旁皮质下白质区损害最大,这与脑微血管由白质进入灰质时的血管形态及走形角度变化有关。本研究还发现,两组间的差异水平随着周数的延长逐渐增大且异常组侧脑室旁皮质下白质区最明显,表明7 d内超声查出脑白质损伤者其预后一般都不佳,在之后的数周时间,坏死部位组织溶解并形成囊腔[11],严重者呈多发性囊腔、脑室变形,尤其以侧脑室旁皮质下白质区发生损害者最为严重,这种区域的白质损伤进展较快,如不及时干预,损害将是不可逆的。
该项研究结果提示,在对早产儿脑白质损伤的临床诊治中,7 d内超声未表明的脑白质损伤预后一般良好,7 d内即超声诊断的脑白质损伤在今后的数周会不断进展[12],极易形成PVL,不同阶段的脑白质平均灰度值变化有助于对损伤程度进行评价,若及时分阶段性地进行治疗,能够保证最大限度地对早产儿的脑功能进行恢复。本研究同时还提示,在早产儿多区域脑白质损伤中,尤其要注意侧脑室旁皮质下白质区损伤的变化,此区域由于脑微血管由白质进入灰质的特殊改变,其治疗手段及效果都是较其他白质区域评估困难的,更需要谨慎地注意动态变化。
[1]Cakir Z,Aslan S,Umudum Z,et al.S-100 beta and neuron-specific enolase levels in carbon monoxide-related brain injury[J].Am J Emerq Med,2010,28(1):61-67.
[2]蒋海燕,刘利军,何海英,等.脑白质损伤早产儿血清S100B蛋白、神经元特异性烯醇化酶及肌酸激酶脑型同工酶的变化[J].临床儿科杂志,2013,31(3):221-224.
[3]牛莹,富建华,薛辛东.早产儿局灶性脑白质损伤近期MRI结局及神经发育评价[J].中华儿科杂志,2014,52(1):23-27.
[4]刘汉楚,邵剑波,曾凌空,等.延长使用布洛芬预防早产儿脑白质损伤的疗效和安全性[J].实用儿科临床杂志,2012,27(14):1119-1121. [5]陆俊秀,陈敬国,陈海燕,等.脑白质病变早产儿神经节苷脂治疗前后血清IL-6、NSE和颅脑超声的变化及意义[J].广东医学,2012,33(16):2410-2412.
[6]Selton D,Andre M,Debruille C,et al.Cognitive outcome at 5 years in very premature children without severe early cerebral abnormalities.Relationships with EEG at 6 weeks after birth[J].Neurophysiol Clin,2013,43(5/6):289-297.
[7]Pham H,Vottier G,Pansiot J,et al.Inhaled NO prevents hyperoxia-induced white matter damage in neonatal rats[J].Exp Neurol,2014,252:114-123.
[8]陈海燕,陈敬国.脑白质损伤早产儿颅脑超声的动态变化[J].实用医学影像杂志,2013,14(3):225-226.
[9]陆俊秀,陈敬国,陈海燕.颅脑超声与血清NSE对早产儿脑白质损伤诊断价值及二者相关性分析[J].临床儿科杂志,2012,30(9):836-839.
[10]Malk K,Metsäranta M,Vanhatalo M.Drug effects on endogenous brain activity in preterm babies[J].Brain Dev,2014,36(2):116-123.
[11]Dammann O,Leviton A.Infection remote from the brain,neonatal white matter damage,and cerebral palsy in the preterm infant[J].Semin Pediatr Neurol,1998,5(3):190-201.
[12]韦永南,赵浙民,廖源.儿童脑室周围白质软化症的CT诊断[J].实用医学影像杂志,2007,8(2):69-71.
Diagnostic value in brain white matter damage of preterm neonates by ultrasonic dynamic quantitative detection
Feng Ting,Lu Shuangquan,Zhou Jianmin
(Department of Ultrasound,Soochow University Affiliated to Children′s Hospital,Suzhou,Jiangsu 215003,China)
Objective Take advantage of ultrasonic equipment to detect and analyze dynamically quantitative the brain white matter damage in premature infants and study its diagnostic value.Methods The average gray-scale values of 120 premature infants′s cerebral white matter with different gestational age on the postpartum 7th d,14th d,the 21th d and 28th d from July 2011 to July 2014 in various layers(the narrator white matter at the posteior horn of lateral ventricle,subcortical white matter area near the lateral ventricle and half egg circle center)were measured by craniocerebral ultrasound and image disposal software,including 81 cases in the abnormal group and 39 cases in the control group.The dynamic variation of gray-scale values in the different layers at various times of the two groups were compared and analyzed.Results The premature infants in the control group on the postpartum 7th d,14th d,the 21th d and 28th d were lower than the abnormal group in average gray level values of differentplane white matter,the difference was statistically significant(P<0.05);The abnormal group on the postpartum 7th d,14th d,the 21th d and 28th d had an increasing trend in difference of average gray level values of different-plane white matter.Conclusion Quantitative ultrasonic detection could dynamically monitor the change of premature white matter lesions and help to judge white matter damage degree of illness,which could provide the basis for clinical diagnosis and treatment.
Infant,premature;Brain injuries;Leukoencephalopathy;Ultrasonography,doppler,color;Diagnosis
10.3969/j.issn.1009-5519.2015.03.010
A
1009-5519(2015)03-0346-02
2014-09-24)
冯婷(1988-),女,江苏宜兴人,主要从事儿童中枢系统超声诊断工作;E-mail:www.salary_hi@126.com。
