大孔树脂联用硅胶柱色谱法富集制备人工蛹虫草中虫草素的工艺研究
2015-12-16张莉莉梁国强陈伟
张莉莉,梁国强,陈伟
(1.苏州市市立医院本部药剂科门诊药房,江苏215000;2.苏州市中医医院吴门医派研究院,江苏215000)
大孔树脂联用硅胶柱色谱法富集制备人工蛹虫草中虫草素的工艺研究
张莉莉1,梁国强2,陈伟2
(1.苏州市市立医院本部药剂科门诊药房,江苏215000;2.苏州市中医医院吴门医派研究院,江苏215000)
目的优选一种简单快捷分离制备人工蛹虫草中虫草素的工艺。方法首先考察7种不同极性的大孔树脂,优选出最佳吸附树脂,然后对树脂富集虫草素的吸附量、洗脱剂浓度、洗脱体积等工艺进行考察,最后对硅胶柱洗脱剂比例等条件进行考察,优选出最佳的硅胶柱分离洗脱剂。结果根据实验考察数据得出最佳工艺条件:大孔树脂型号为HPD-D,树脂对虫草提取液(0.1 mg/mL)的吸附量为2树脂床体积(2BV),用20%乙醇,洗脱体积为3BV可将虫草素洗脱完全,硅胶柱洗脱剂为乙酸乙酯∶丙酮(2∶1),分离制得虫草素晶体纯度约为93.60%。结论优选出的人工蛹虫草中虫草素的富集分离工艺简单快捷,适用于大规模生产制备虫草素。
虫草素/分析;冬虫夏草/化学;色谱法,高压液相;树脂类,合成
蛹虫草,又名北冬虫夏草,与冬虫夏草同属异种[1]。蛹虫草内含有虫草素、虫草酸、多糖、腺苷等多种有效成分。《新华本草纲要》称,蛹草有益肺肾、补精髓、止血化痰的功能[2-3]。有药理研究表明,虫草素是一种腺苷类活性物质,具有抗菌、抗病毒、干扰人体RNA及DNA合成,明显抑制多种肿瘤生长的作用[4-7]。
目前对虫草素的分离制备主要采用单一硅胶色谱法,分离较困难,无法实现工业化生产,本研究考查不同型号大孔吸附树脂对虫草素的吸附效果,并首先用大孔树脂对人工蛹虫草中虫草素进行富集,联用硅胶柱色谱对虫草素分离制备,降低虫草素的分离难度,为虫草素大规模生产制备提供参考。
1 材料与方法
1.1 材料人工蛹虫草购置于南通市海安县泓寿生物科技有限公司,经南京中医药大学吴启南教授鉴定为人工蛹虫草。大孔树脂D101、HPD-417、HPD-600、AB-8、HPD-800、HPD-100、HPD-D均购于河北沧州宝恩吸附树脂厂,薄层层析硅胶HG/T2354-92为化学纯,购于青岛海洋化工有限公司。加压层析柱(40 cm×6cm,瑞士BUCHI公司),广性pH试纸(上海化学试剂总厂),试剂均为分析纯,BUCHI旋转蒸发仪(瑞士BUCHI公司),Aglient1110型高效液相色谱仪(美国安捷伦公司)。
1.2 方法
1.2.1 大孔树脂预处理在容器内加入相当于装填树脂体积0.4~0.5倍的乙醇,然后将新树脂各自投入浸泡24 h左右,使其充分溶胀[8-9]。取出需要质量的树脂装在柱中备用,然后用每小时2树脂床体积(2 bed volume,2BV)乙醇淋洗树脂,每淋洗0.5BV取样1次,洗至流出液加入少量蒸馏水不出现白色混浊为止[8-10]。并用蒸馏水以同样的流速洗净乙醇。再用2BV的2%氢氧化钠溶液,以4~6 BV/h的流速通过树脂层,并浸泡2~4 h,再用蒸馏水以同样流速洗至出水pH呈中性。然后用2BV的2%盐酸溶液,以4~6 BV/h的流速通过树脂层,并浸泡2~4 h,最后用蒸馏水以同样流速洗至出水pH呈中性。
1.2.2 蛹虫草提取液制备取人工蛹虫草药材2 kg,粉碎成粗粉,过60目筛,8倍量的水连续回流提取2次,每次2 h,抽滤,合并滤液,将合并后的滤液用蒸馏水分散至生药量约为0.1 g/mL的溶液,用3 mol/L氢氧化钠溶液将虫草水分散液调pH值至10。
1.2.3 虫草素测定采用高效液相色谱(HPLC)法检测[10],检测流动相为15%甲醇∶85%水(0.05%二乙胺),检测波长260 nm,流速1.0 mL/min,色谱柱Kromasil C18(250 mm×4.6 mm×5 μm),柱温30℃。
1.2.4 虫草素标准品的HPLC测定精确称取虫草素标准品1 mg,置于25 mL容量瓶中,甲醇溶解后并定容至刻度,进行HPLC检查,采用面积归一化法计算峰面积。
1.2.5 大孔吸附树脂吸附条件的考察
1.2.5.1 大孔树脂型号的筛选分别精密称取预处理好的大孔吸附树脂D101、HPD-417、HPD-600、HPD-D、AB-8、HPD-800、HPD-100各200 g置于100 mL带塞锥形瓶中,分别加入升麻提取液(0.1 g/mL)50 mL,静置过夜,过滤,取药材提取液与滤液的续滤液进行HPLC检测虫草素的含量,以虫草素的含量为指标来计算各型号树脂对其静态吸附量,考查各型号树脂对虫草素的吸附效果。
1.2.5.2 大孔树脂吸附量的考察取1.2.1项中预处理大孔树脂500 g装柱,以1.2.2项中虫草提取液500 mL为1BV,缓慢上样1BV上样流出液取样,0.45 μm微孔滤膜过滤进行HPLC检测,采用外标一点法计算流出液中虫草素含量。
1.2.5.3 大孔吸附树脂洗脱剂浓度的考察采用单因素考察,分别考察虫草素经大孔树脂吸附后,水洗脱,5%乙醇、10%乙醇、20%乙醇、30%乙醇、50%乙醇洗脱虫草素的效果,每种洗脱剂洗脱5BV,各洗脱液0.45 μm微孔滤膜过滤后均进行HPLC检测,采用外标一点法计算洗脱液中虫草素的含量。
1.2.5.4 虫草素大孔树脂洗脱体积的考察采用单因素考察,考察虫草素经大孔树吸附后,20%乙醇洗脱,1BV洗脱液取样进行HPLC检测,采用外标一点法计算洗脱液中虫草素的含量。
1.2.6 虫草素的大孔树脂富集预处理的大孔树脂装柱,按2 mL/g树脂的量进行虫草素的大孔树脂富集,上样后先水和5%乙醇各洗脱2BV,洗脱液弃去,20%乙醇洗脱3BV,回收溶剂,得浸膏。
1.2.7 虫草素的硅胶柱分离条件考察
1.2.7.1 虫草素分离洗脱剂的考察采用虫草素标准溶液进行薄层层析,筛选洗脱剂。用HG/T2354-92硅胶板点样,在不同展开剂中展开,紫外灯下观察暗斑。选择Rf值在0.1左右的展开剂[乙酸乙酯∶丙酮(2∶1)]为硅胶柱分离洗脱剂。
1.2.7.2 虫草素的硅胶柱分离将1.2.6项中浸膏用乙酸乙酯溶解,1.1.5项的比例加入薄层层析硅胶,搅拌均匀后水浴蒸发挥去溶剂,样品研磨粉碎过200目筛后装填中压硅胶柱,先用乙酸乙酯洗脱,硅胶柱洗脱通透,再以乙酸乙酯∶丙酮(2∶1)洗脱,每500毫升洗脱液收集为1个流份,流份14~19个中出现沉底物,合并流份,滤取沉淀,滤液静置,析晶后再滤出沉淀,合并沉淀在甲醇中重结晶,过滤,得无色针状结晶。
1.2.8 虫草素的纯度检查称取1.2.7.2项中虫草素晶体1 mg,置于25 mL容量瓶中,甲醇溶解后并定容至刻度,进行HPLC检查,重复进样6次,采用面积归一化法计算分离出虫草素的纯度。
1.2.9 虫草素的结构鉴定取1.2.7.2项中虫草素晶体,氘代氯仿溶解后进行NMR鉴定。
1.3 数据处理数据检测结果运用Excel软件进行统计分析。
2 结果
2.1 虫草素大孔吸附树脂吸附条件的考察
2.1.1 大孔树脂型号的筛选不同型号的大孔吸附树脂对虫草素的吸附效果有较大差异,7种树脂中,HPDD吸附能力最佳,见图1。

图1 不同型号树脂对虫草素的静态吸附量考察
2.1.2 大孔树脂吸附量的考察结果发现上样约2.2BV时,大孔树脂对虫草素吸附饱和,试验确定大孔树脂对虫草提取液(0.1 mg/mL)的吸附量为2BV。
2.1.3 大孔吸附树脂洗脱剂浓度的考察结果显示,5%乙醇不能洗脱虫草素,10%乙醇可以洗脱部分虫草素,20%乙醇可将虫草素洗脱完全。
2.1.4 虫草素大孔树脂洗脱体积的考察结果发现,20%乙醇洗脱3BV可将虫草素洗脱完全。
2.2 虫草素的纯度检查虫草素的纯度检查HPLC结果见图2。检测纯度约为(93.6)%,RSD为0.90%,见表1。
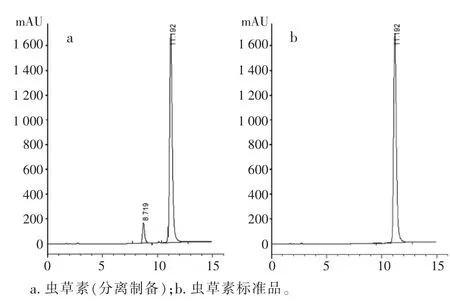
图2 虫草素纯度检查HPLC图

表1 制备虫草素的纯度检查
2.3虫草素的结构鉴定取1.2.7.2项中虫草素晶体,氘代氯仿溶解后进行NMR鉴定,结果如下。
1H-NMR(DMSO-d6,600 MHz)δ:8.15(1H,s,H-2),8.35(1H,s,H-8),5.87(1H,d,H-1′),4.37(1H,m,H-2′),2.24(1H,ddd,Ha-3′),1.92(1H,ddd,Hb-3′),4.34(1H,m,H-4′),3.67(1H,ddd,Ha-5′),3.53(1H,ddd,Hb-5′),5.65(1H,d,2′-OH),5.13(1H,t5′-OH),7.27(2H,br s,N6H2)。
13C-NMR(DMSO-d6,125 MHz)δ:152.5(C-2),148.4(C-4),119.2(C-5),156.1(C-6),139.2(C-8),90.9(C-1′),74.7(C-2′),34.1(C-3′),80.8(C-4′),62.7(C-5′)。
以上数据经文献研究,与报道的虫草素NMR数据一致,确认化合物为虫草素,见图3、4。
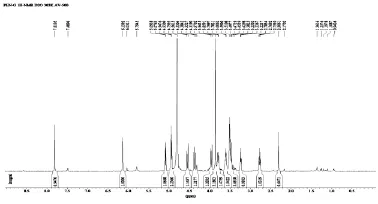
图3 虫草素的1H-NMR情况
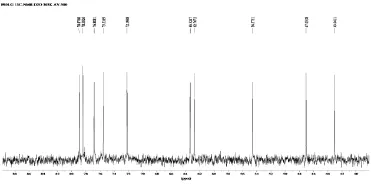
图4 虫草素的13C-NMR情况
3 讨论
通过多次单因素试验考察,首先从7种大孔吸附树脂中,选出HPD-D对虫草素的吸附效果最佳,通过多次的单因素考察,发现HPD-D树脂对虫草素的吸附饱和量为每克树脂可吸附2 mL的0.1 g/mL虫草提取液,洗脱剂为20%的乙醇洗脱3BV可将虫草素洗脱完全。通过薄层色谱法筛选出硅胶柱色谱洗脱剂为乙酸乙酯∶丙酮(2∶1),洗脱出的虫草素在甲醇中进行重结晶,纯度约为93.6%。
总之,利用大孔树脂对虫草素先进行吸附富集,去除了人工蛹虫草中的较多杂质,连用硅胶柱色谱进行虫草素的分离简单便捷,此工艺方法为虫草素的生产提供了指导意义。
[1]邵力平.真菌分类学[M].北京:中国林业出版社,1984:109.
[2]吴征镒.新华本草纲要[M].上海:上海科学技术出版社,1990:731.
[3]汪宇,于荣敏,杨光照,等.HPCE法测定蛹虫草及其培养物中核苷类化合物的含量[J].解放军药学学报,2003,19(5):331-334.
[4]姜泓,刘珂,孟舒,等.人工蛹虫草子实体化学成分[J].药学学报,2000,35(9):663-668.
[5]潘家峰.浅谈冬虫夏草的主要成分及其保健治疗作用[J].内蒙古中医药,2011,30(4):48-49.
[6]贺元川,刘飞,陈仕江,等.虫草素药理学及作用机理研究进展[J].重庆中草药研究,2013(1):35-40.
[7]古燕翔,张国良,魏芸,等.大孔吸附树脂对分离富集苜蓿皂苷天然产物研究[J].天然产物研究与开发,2007,19(3):504-507.
[8]陈伟,李存玉,彭国平,等.大孔树脂联用法制备升麻总酚酸[J].现代医药卫生,2012,28(7):963-965.
[9]胡瑕,谢红旗,罗巍,等.大孔吸附树脂分离纯化蛹虫草固体培养基中虫草素工艺[J].食品科学,2012,33(6):110-114.
[10]王均理.HPLC测定虫草破壁灵芝孢子粉中虫草素与腺苷含量[J].中国现代药物应用,2013,7(18):11-13.
Macroporous resin combined silicagel column in preparation of cordycepin in the made-up cordyceps militaris
Zhang Lili1,Liang Guoqiang2,Chen Wei2
(1.Outpatient Dispensary of Department of Pharmacy,Suzhou Municipal Hospital,Jiangsu215000,China;2.School of Wu Medicine,Suzhou Hospital of Traditional Chinese Medicince,Jiangsu 215000,China)
Objective To optimize a simple and fast technique of separating and preparing cordycepin from made-up cordyceps militaris.Methods It was studied 7 kinds of different polar macroporous resins to select the best adsorbent resins,as well as the adsorbent quantity,eluent concentrations,elution volumes.Finally,the proportion of silicagel column elution and so on were surveyed and then optimize the best silicagel column elution.Results According to the survey data in the study,the best technique was HPD-D macroporous resin,the adsorbing capacity of resin to cordyceps extraction(0.1 mg/mL)was 2 times resin bed volumn(2BV)with 20%ethyl alcohol.The cordycepin was completely eluted with 3BV eluant.The silicagel column eluent was ethyl acetate vs acetone(2∶1),obtained about 93.60%of the cordycepin crystalline purity by separation.Conclusion The gathered separating tequnique of cordycepin from made-up cordyceps militaris is simple and convenient,which is suitable for large-scale cordycepin production and preparation.is a quick and simple technique to prepare cordycepin.
Cordycepin/analysis;Cordyceps sinensis/chemistry;Chromatography,high pressure liquid;Resins,synthetic
10.3969/j.issn.1009-5519.2015.03.009
A
1009-5519(2015)03-0343-03
2014-07-01
2014-10-01)
张莉莉(1976-),女,江苏苏州人,主管中药师,主要从事中药学药剂方面工作;E-mail:144361866@qq.com。
陈伟(E-mail:sztcmcw@sina.com)。
