明绿豆苯丙氨酸解氨酶的分离纯化及性质初步研究
2015-12-16李梅青代蕾莉付志伟
张 瑜 李梅青,2 代蕾莉 蔡 娟 付志伟
(安徽农业大学茶与食品科技学院1,合肥 230036)
(合肥农产品加工研究院2,合肥 230036)
明绿豆苯丙氨酸解氨酶的分离纯化及性质初步研究
张 瑜1李梅青1,2代蕾莉1蔡 娟1付志伟1
(安徽农业大学茶与食品科技学院1,合肥 230036)
(合肥农产品加工研究院2,合肥 230036)
为了研究明绿豆中苯丙氨酸解氨酶(PAL)的动力学特性,采用35%和65%饱和度的硫酸铵分级沉淀、DE-52阴离子交换层析方法对明绿豆中的PAL进行了分离纯化,并对其基本性质做了初步研究。结果表明,PAL的纯化倍数为6.982 9,蛋白质得率为4.65%,酶得率为32.45%。PAL在硼砂-硼酸缓冲溶液中适宜的pH范围为7.6~9.0,最适pH有2个:8.0和8.6。PAL适宜的温度范围为35~45℃,最适反应温度为40℃。得到 PAL的 2个 Km值,分别是:Km1为6.94×10-5mol/L,Km2为 1.23×10-4mol/L。本研究结果可为进一步研究和开发明绿豆的PAL提供参考。
明绿豆 苯丙氨酸解氨酶 分离纯化 基本性质
绿豆(Mung bean)为豆科草本植物绿豆(Phaseolus radiatus)的成熟种子[1]。《本草纲目》中提及:“绿豆,消肿治痘之功虽同于赤豆,而压热解毒之力过之”,并可“解金石、砒霜、草木一切诸毒”。可见古人认识到绿豆具有清热解暑、止渴利尿、消肿止痒、解毒等药用功效[2-3]。
苯丙氨酸解氨酶(L-phenylalanine ammonialyase,PAL;EC4.3.1.5)能催化L-苯丙氨酸生成反式肉桂酸进入苯丙烷代谢途径,为多种酚类、生物碱及类黄酮等终产物提供前体物质,是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的关键酶和限制酶[4-5]。Abell等[6]依据 PAL特异的催化反应将其用于抗肿瘤和治疗苯丙酮尿症的研究中,并取得了肯定的结果。PAL主要存在于高等植物(如:银杏叶[7]、山药[8]、石斛[9]、绿豆[10]等)、部分微生物(丝状真菌、酵母及链霉菌)和某些藻类中。国内有研究证明,从绿豆中提取的PAL对小鼠淋巴白细胞白血病细胞株(L1210)的抑制作用随作用时间的延长和药物剂量的增加而增强[10]。然而,绿豆中PAL纯化及基本性质的研究鲜见报道。
明光绿豆以其色泽晶莹碧绿,粒大皮薄、汤清易烂,清香可口等特点,质量为全国之冠,被称为“明绿”,曾经被作为贡品。2008年,“明光绿豆”获得国家原产地保护标志,然而,对其功能性成分分析研究极少。
本研究采用盐析方法分离明绿豆中的PAL,采用离子层析法对其进一步纯化,并对其性质进行初步研究,系统了解明绿豆PAL的反应动力学特性,为明绿豆功能性成分的高效利用提供依据。
1 材料与方法
1.1 材料与仪器
明绿豆:安徽燕之坊食品有限公司;β-巯基乙醇、EDTA、L-苯丙氨酸、牛血清蛋白均为分析纯。高速冷冻离心机(LR16-A):北京雷勃尔离心机有限公司;DE-52:Whatman分装。
1.2 试验方法
1.2.1 酶活性及蛋白质的测定
1.2.1.1 酶活性测定及活性单位的定义
采用Koukol等[11]的方法,略加修改。吸取0.5mL 0.06mol/L的L-苯丙氨酸和9.45mL硼酸-硼砂缓冲溶液(pH 8.7,20 mmol/Lβ-巯基乙醇,1 mmol/L的EDTA),加入0.05mL的酶液。同时调零管取0.5mL 0.06mol/L的L-苯丙氨酸,加9.5mL的硼酸-硼砂缓冲溶液;对照管加入9.95mL的硼酸-硼砂缓冲溶液和0.05mL的酶液。40℃水浴反应1 h,滴加6mol/L的 HCl 0.2mL终止反应,于290 nm处比色。以每小时每毫升酶液光密度值增加0.01为一个酶活单位(U)。所有测定均重复3次。
1.2.1.2 蛋白质含量的测定
参照Bradford等[12]方法以牛血清蛋白做标准曲线得到回归方程:y=0.492 8x+0.026 5。
1.2.2 明绿豆PAL粗酶液的制备及分离纯化
1.2.2.1 PAL粗酶液的提取
取明绿豆80 g,加入预冷的硼酸-硼砂缓冲溶液160mL,于4℃的冰箱浸泡24 h。捣碎,匀浆,4℃下12 000 r/min离心20min,上清液即为粗酶液,取粗酶液4℃下保存以供纯化。
1.2.2.2 硫酸铵分级沉淀及脱盐浓缩
将固体硫酸铵粉末加入粗酶液至35%饱和度,磁力搅拌30min,4℃静置4 h。4℃下12 000 r/min离心20min,取上清液加固体硫酸铵粉末到65%饱和度,然后依据上述方法,4℃下12 000 r/min离心20min,弃上清液。将沉淀复溶于70mL 0.05mol/L的Tris-HCl(pH=8.8)缓冲溶液中。将复溶后的酶液装入已经处理好的透析袋中,4℃下用0.05mol/L的Tris-HCl缓冲溶液中脱盐10 h,然后再用聚乙二醇浓缩1 h。
1.2.2.3 PAL粗酶液的纯化
将浓缩后的酶液过DE-52层析柱(Φ2.6 cm×30 cm,已用 pH为8.8的0.05mol/L Tris-HCl缓冲溶液平衡),以0~0.8mol/L的 NaCl Tris-HCl(pH 8.8)缓冲溶液梯度洗脱,每5min 1管,每管10mL。合并有酶活的部分,然后经透析、超滤浓缩、冷冻干燥得纯酶。
1.2.3 PAL酶学性质
1.2.3.1 明绿豆PAL最适pH、温度、酶浓度、底物浓度的测定
根据酶活性测定的反应体系,以0.06mol/L的L-苯丙氨酸为底物,在pH值为7.6~9.2的硼酸-硼砂缓冲溶液反应体系中设定一系列pH梯度,测定各梯度pH的酶活力,确定PAL的最适pH;在25~80℃温度范围内,设置一系列的温度梯度,测定各温度梯度下PAL的酶活力,确定最适反应温度;分别取PAL酶液0.1~1.7mL,设置一定酶浓度梯度的反应体系,并测定各酶浓度梯度下PAL的酶活,确定最适酶浓度。在L-苯丙氨酸的终物质的量浓度为0.5~9 mmol/L内,设置一系列底物浓度的反应体系,并测定各体系中PAL的活力,确定最适底物浓度。
1.2.3.2 明绿豆PAL动力学曲线
取0.05mL的酶液和0.5mL的0.06mol/L的L-苯丙氨酸溶液,加pH 8.7硼酸-硼砂缓冲溶液定容至10mL,于40℃水浴。5~360min内设置一系列的时间梯度,并测定各时间梯度PAL的酶活力。
1.2.3.3 明绿豆PAL的Km值
在9.45mL pH 8.7硼酸-硼砂缓冲溶液中加入0.05mL酶液,再分别加入0.5mL物质的量浓度0.001~0.01mol/L的L-苯丙氨酸溶液,测定各浓度对应的PAL酶活力。将各底物浓度的酶活力对反应时间作图,求出酶促反应速度V。分别求出1/[V]及1/[S],按照 Lineweaver-Burk双倒数法作图,求出PAL的Km值。
2 结果与分析
2.1 明绿豆PAL的分离纯化
明绿豆PAL粗酶液经硫酸铵分级沉淀、脱盐浓缩以及DE-52层析,分离纯化结果见表1,洗脱结果见图1。

表1 明绿豆PAL的分离纯化结果

图1 明绿豆PAL纤维素DE-52层析结果
由表1可知,明绿豆PAL的纯化倍数为6.982 9,蛋白质得率为4.65%,酶得率为32.45%。由图1可知有2个活力峰,从而推测PAL有2种同工酶。
2.2 明绿豆PAL最适pH、温度、酶浓度、底物浓度
由图2可以看出,在不同pH的硼酸-硼砂缓冲溶液中酶活力出现2个峰值,即2个最适pH值:8.0和8.6,这可能与明绿豆体内含有PAL的同工酶有关[13]。明绿豆PAL在 pH 7.6~9.0时酶活力都在其最大活力的50%以上,因此该酶在pH 7.6~9.0之间比较稳定。PAL维持活性的最适pH范围为8.0~9.5。

图2 酶的最适pH
由图3可知,明绿豆PAL在25~40℃时,酶活性随着温度的升高而上升。当温度处于35~40℃范围时,酶活力较高,为最适温度范围,40℃时明绿豆PAL活力最高,45℃以后酶活性受到抑制。当温度接近80℃时PAL的活力已基本丧失。此结果与其他材料中的PAL研究结果基本一致[14-18]。
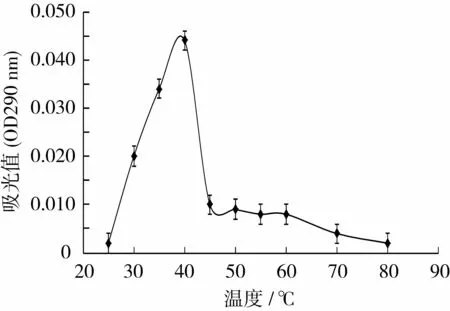
图3 酶的最适温度
如图4所示,明绿豆PAL的最适底物物质的量浓度为1.5 mmol/L,此时酶活力达到最大值,而当底物物质的量浓度达到5 mmol/L时,酶活性到达第二个峰值。然后随底物浓度的增大,酶活力减少。当底物物质的量浓度增大到7 mmol/L时,酶活力逐渐保持稳定。
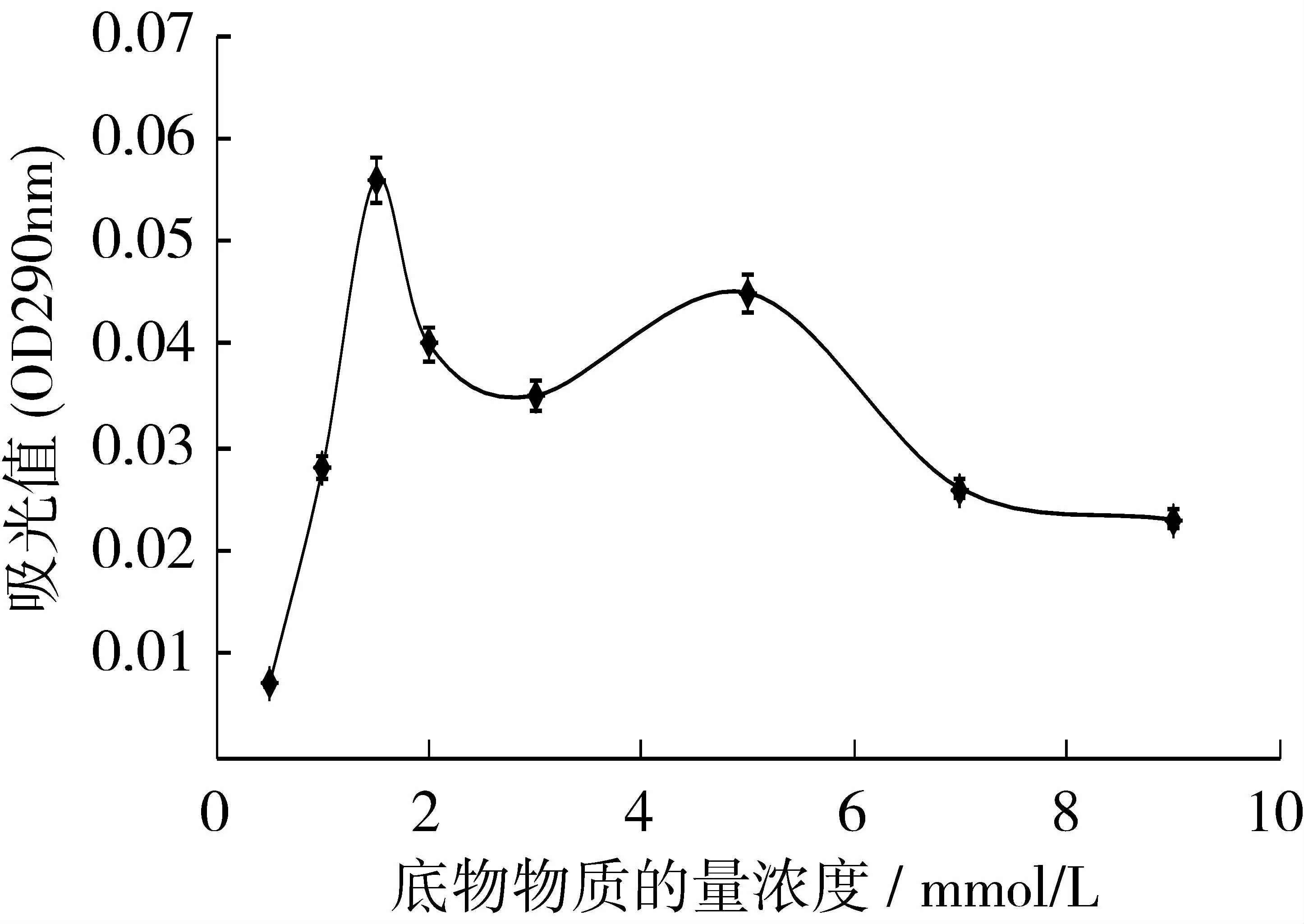
图4 底物浓度对酶活力的影响
由图5可知,在酶量较低,即酶量小于0.13mL时,随着酶量的增加,其吸光值增加较明显。当加酶量高于0.13mL时,吸光值的增加缓慢。这可能是因为此时底物相对于酶是过量的,而高浓度的底物会抑制底物,增加酶的浓度能解除这种抑制,从而增加酶的含量,提高酶的反应速率。当酶浓度较高而底物浓度不足时将产生限制因子,反应速度与酶浓度之间不再保持线性关系,或者是酶作用产物的增加对酶产生抑制作用,从而导致反应速度增长量的下降[9]。
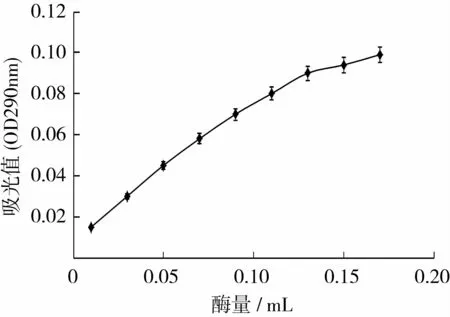
图5 酶量对酶活力的影响
2.3 明绿豆PAL的动力学曲线
PAL催化L-苯丙氨酸反应生成反式肉桂酸,在反应开始的3 h内,反应产物与反应时间基本成线性关系(图6),但是反应在80min内的速率比80~180min内的反应速率高。PAL在反应3 h之后,反应进程曲线逐渐变平。这是因为苯丙氨酸逐渐减少,反式肉桂酸的生成量逐渐积累,对酶的反馈抑制作用加强,所以反应速度逐渐下降[8]。
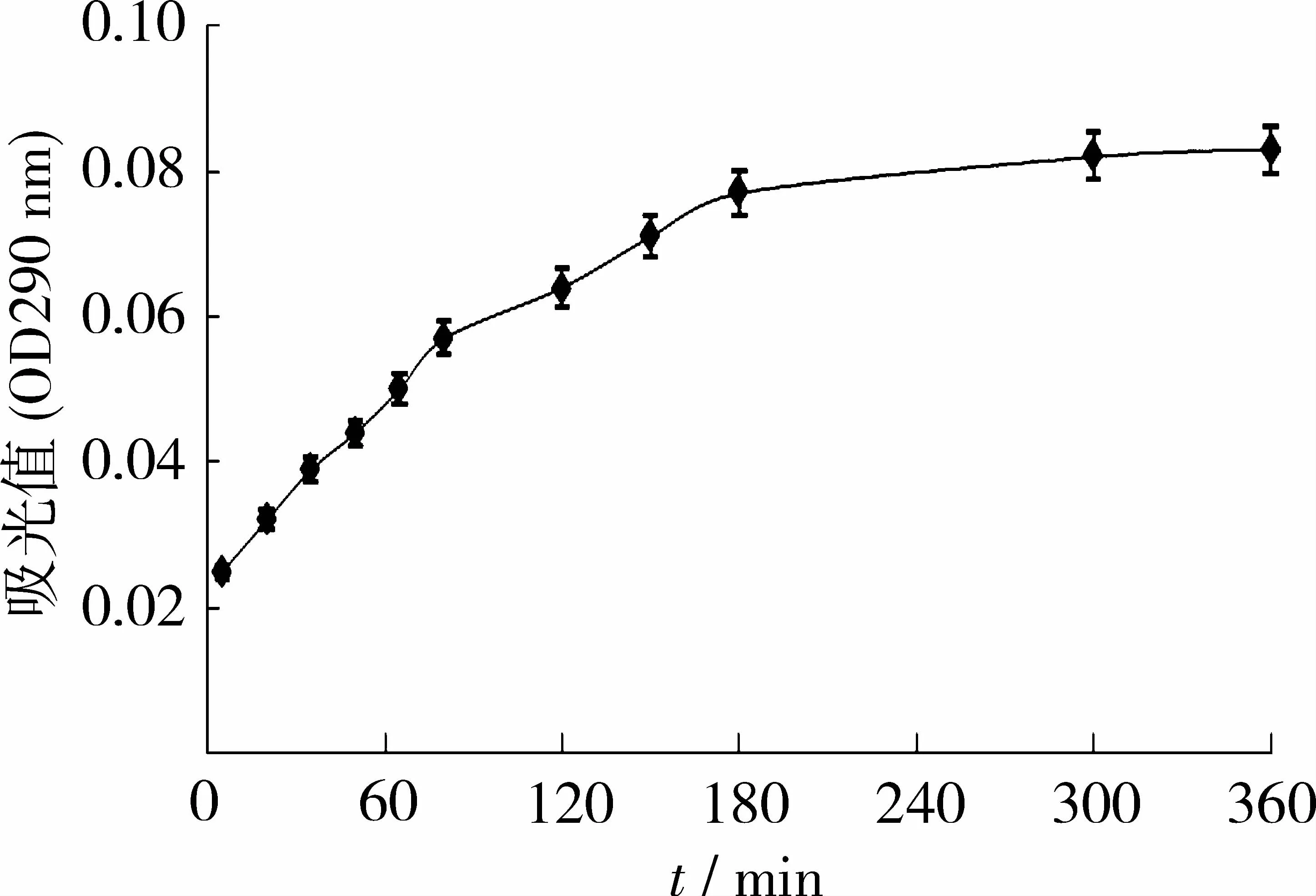
图6 PAL的反应进程曲线
2.4 明绿豆PAL的Km
用Lineweaver-Burk双倒数法作图,结果如图7所示。Km即为直线在X负轴上截距的负倒数。由图7可知明绿豆PAL有2个Km值,通过计算可得:Km1为 6.94×10-5mol/L,Km2为 1.23×10-4mol/L,这与0.3×10-4~1.5×10-2mol/L之间的结果相一致[5]。

图7 PAL双倒数作图
3 讨论
试验结果的蛋白质得率偏低,这或许与本试验在进行粗酶分离时所采用的硫酸铵的饱和度、离子强度以及缓冲溶液的pH没有经过优化有关。离子洗脱时PAL得率偏低,主要是因为PAL存在同工酶[13],经硫酸铵分级沉淀及DE-52柱后去除了部分同工酶,纯化出单一酶的过程可能造成部分损失所致。
对PAL性质的前期研究发现:银杏叶中PAL的2个最适pH 8.0和8.8[19]、山药中PAL的2个最适pH 8.0和 8.8[8]、霍山石斛中 PAL的最适 pH 8.4[9],无壳葫芦籽中的最适pH 8.5[14],这表明不同植物来源的PAL的最适pH存在差异。
本研究中底物浓度对PAL活力的影响曲线图呈S型,这与其他原材料 PAL研究结果类似,如银杏[19]、石斛[9]、山药[8]及芦笋[20]等,这可能与不同来源PAL普遍存在同工酶有关。同时有报道称,如果PAL存在别构酶,也会导致这种情况的出现[21]。对此,还需进一步研究。
4 结论
明绿豆PAL的纯化倍数为6.982 9,蛋白质得率为4.65%,酶得率为32.45%。PAL适宜的pH范围为7.6~9.0,最适pH值分别为8.0和8.6。适宜的温度范围为35~45℃,最适反应温度为40℃,45℃以后酶活性受到抑制。当温度接近80℃时PAL的活力已基本丧失。
明绿豆PAL的最适底物物质的量浓度为1.5 mmol/L。当底物物质的量浓度增大到7 mmol/L时,酶活力逐渐保持稳定。
明绿豆PAL催化L-苯丙氨酸反应生成反式肉桂酸,在反应的开始3 h内,反应产物与反应时间基本成线性关系。反应3 h之后,反应进程曲线逐渐变平。所以在测定PAL的活性时,反应时间选择3 h之内为基准,以1 h的反应产物量表示酶的活力。
Lineweaver-Burk双倒数法作图,得到明绿豆PAL的2个 Km值,分别是:Km1为6.94×10-5mol/L,Km2为 1.23×10-4mol/L。
[1]江苏新医学院.中药大词典[M].上海:上海科技出版社,1986:2272
[2]赵守训,黄泰康,丁志尊.中药辞海[M].第三卷.北京:中国医药科技出版,1997:642-643
[3]佘纲哲,张恒.绿豆的营养成分及利用[J].生物学通报,1991(7):18-19
[4]江昌俊,余有本.苯丙氨酸解氨酶的研究进展[J].安徽农业大学学报:自然科学版,2001(4):425-430
[5]MacDonald M Jason,Godwin BD'Cunha.A modern view of phenylalanine ammonia lyase[J].Biochemistry and Cell Biology,2007,85(3):273-282
[6]Abell CW.The effects of PAL on leukemic lymphocytes in vitro[J].Cancer Research,1972,32:215-290
[7]刘卫红,王燕,杜何为,等.银杏叶苯丙氨酸解氨酶分离纯化条件的研究[J].湖北农学院学报,2004,24(3):196-198
[8]江力,袁怀波,张世杰,等.山药苯丙氨酸解氨酶特性的研究[J].食品科学,2006,27(10):36-40
[9]张宽朝,金青,谈俊,等.霍山石斛苯丙氨酸解氨酶的分离纯化及基本性质研究[J].食品工业科技,2009,30(8):133-136
[10]唐煦,周国林.绿豆苯丙氨酸解氨酶的性质及抗肿瘤作用研究[J].微生物学免疫学进展,1996,24(1):35-39
[11]Koukol J,Conn E E.The metabolism of aromatic compounds in higher plants.Ⅳ.Purification and properties of the phenylalanine deaminase of Hordeum vulagare[J].Journal of Biology and Chemistry,1961,236:2692-2698
[12]Bradford Marion M.A rapid and sensitive method for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254
[13]Jorrin J,Dixon R A.Stress responses in alfalfa II.Purification,characterization and induction of phenylalanine ammonia lyase isoforms from elicitor-treated cell suspension cultures[J].Plant Physiology,1990,92:447-455
[14]孟延发.无壳葫芦籽苯丙氨酸解氨酶的纯化及其基本性质[J].兰州大学学报:自然科学版,1991,27(2):134-139
[15]Given N L.Purification and properties of phenylalanine ammonia-lyase from straw berry fruit and its synthesis during ripening[J].Journal of Plant Physiology,1988,133(1):31-37
[16]H W Lim,SSPark,C JLim.Purification and properties of phenylalanine ammonia-lyase from leafmustard[J].Canadian Metallurgical Quarterly,1997,7(6):715-720
[17]Havir EA.Phenylalanine ammonia-lyase:purification and characterization from soybean cell suspension cultures[J].Archives of Biochemistry and Biophysics,1981,211(2):556-563
[18]刘鸿年,刘发敏.茶鲜叶苯丙氨酸解氨酶的提取及其活性测定[J].中国茶叶,1989(1):4-5
[19]王燕,刘卫红,杜何为,等.银杏叶中苯丙氨酸解氨酶基本特性的研究[J].湖北农业科学,2004(5):72-74
[20]李艳华,王庆国.芦笋过氧化物酶和苯丙氨酸解氨酶特性及抑制条件的研究[J].食品与发酵工业,2007,33(11):55-59
[21]程水源,陈昆松,刘卫红,等.植物苯丙氨酸解氨酶基因的表达调控与研究展望[J].果树学报,2003,20(5):351-357.
Purification and Properties of Phenylalanine Ammonia-Lyase in Ming Mung Bean
Zhang Yu1Li Meiqing1,2Dai Leili1Cai Juan1Fu Zhiwei1
(Anhui Agricultural University School of Tea and Food Science&Technology1,Hefei 230036)
(Institute of Hefei Agricultural Products Processing2,Hefei 230036)
The study in this paper aimed to research the dynamics characteristics of phenylalanine ammonialyase(PAL)from Mingmung bean.The isolation,purification and basic properties of L-phenylalanine ammonialyase in Mingmung bean were studied by 35%and 65%saturation of ammonium sulfate grade deposition,DE-52 anion exchange chromatography.The results showed that the purification multiple was 6.982 9 and protein yield and PAL yield were 4.65%and 32.45%respectively.The optimal pH range of PAL in borax-boric acid buffer was 7.6~9.0 and there were two optimal pH as 8.0 and 8.6.The optimal temperature range of PAL was 35~45℃.The optimal temperaturewas40℃.Therewere two Kmvalues including 6.94×10-5mol/L and 1.23×10-4mol/L.The results provided the reference for further studying and developing PAL of Mingmung bean.
mingmung bean,L-phenylalanine ammonia-lyase,isolation and purification,basic properties
Q946.5
A
1003-0174(2015)06-0101-05
合肥农产品加工研究院资助院企合作项目(2012HAP P002)
2014-01-22
张瑜,女,1988年出生,硕士,植物源食品开发与利用
李梅青,女,1965年出生,副教授,农产品加工与贮藏
